Аннотация
РНК-вирусы, которые когда-то считались специфическими для медоносных пчел, предположительно переходят от управляемых пчел к диким опылителям; однако пути передачи в основном неизвестны. Широко распространенная, но не проверенная гипотеза гласит, что цветы служат мостом в передаче вирусов между пчелами. Здесь, используя серию контролируемых экспериментов с колониями пчел в неволе, мы изучили роль цветов в передаче пчелиных вирусов. Сначала мы исследовали, переносят ли медоносные пчелы вирусы на цветы и заражаются ли шмели после посещения зараженных цветов. Затем мы изучили, различаются ли виды растений по своей склонности к укрытию вирусов и увеличивает ли частота посещения пчелами цветков вероятность отложения вирусов на них. Наш эксперимент впервые показал, что медоносные пчелы переносят вирусы на цветы. Однако два изученных нами вируса — вирус черной маточной клетки (BQCV) и вирус деформированного крыла (DWV) — не были одинаково распределены по видам растений, что позволяет предположить, что различия в цветочных признаках, экологии вирусов и/или кормовом поведении могут определять вероятность осаждения. Шмели не заражались после посещения цветов, ранее посещаемых медоносными пчелами, что говорит о том, что передача вируса через цветы может быть редким явлением и зависеть от мультипликативных факторов и вероятностей, таких как инфекционность штамма вируса для разных видов пчел, иммунокомпетентность, вирулентность вируса, вирусная нагрузка и вероятность контакта шмеля с частицей вируса на цветке. Наше исследование является одним из первых, экспериментально изучающих роль цветов в передаче вируса пчелами, и открывает перспективные направления для будущих исследований.
Введение
Патогены являются одной из главных угроз для пчел, вызывающих гибель колоний, сокращение популяции и растущую обеспокоенность продовольственной безопасностью и функционированием экосистем [1—4]. Хотя важность патогенов для пчел привлекла большое внимание за последние два десятилетия, остается много вопросов без ответа относительно механизмов рассеивания и динамики передачи патогенов пчел [5]. Многочисленные патогены были обнаружены в широком диапазоне хозяев, включая одиночных пчел, шмелей, медоносных пчел, муравьев, ос и жуков [6—8]. Общие цветочные ресурсы, которые могут выступать в качестве дисперсионных платформ между скрещивающимися видами опылителей, были связаны с обеспечением путей передачи, через которые эти патогены могут быть приобретены [5,9—12]. Однако лишь немногие исследования непосредственно изучали этот путь для пчелиных паразитов. Crithidia bombi, трипаносомный паразит шмелей, передавался среди шмелей после посещения цветов, инокулированных вручную или ранее посещенных зараженными шмелями [11]. Совсем недавно паразиты Apicysistis bombi, Nosema spp. и Crithidia bombi передавались от пчел-хозяев к цветам и между видами пчел через общие цветы [10,13]. Хотя эта работа показывает, что цветы могут служить мостом для патогенов, перемещающихся между видами и/или популяциями, способ передачи множества РНК-вирусов, заражающих пчел, до сих пор неизвестен.
Когда-то считалось, что РНК-вирусы характерны только для медоносных пчел, однако они были обнаружены у целого ряда видов опыляющих членистоногих, включая жуков, мух, одиночных пчел и шмелей [6,9,14]. Эти однонитевые вирусы с положительным смыслом очень распространены среди медоносных пчел и обычно сохраняются как скрытые инфекции, способные реплицироваться при определенных условиях, таких как воздействие пестицидов и иммуносупрессия, вызванная клещами Варроа, эктопаразитами, являющимися переносчиками РНК-вирусов [15,16]. Два из наиболее распространенных в США вирусов — это вирус деформированного крыла (DWV), который вызывает деформацию крыльев как у медоносных пчел [17,18], так и у шмелей [19], и вирус черной матки (BQCV), который вызывает почернение и отмирание маточных ячеек у медоносных пчел [20]; однако его воздействие на шмелей неизвестно. У медоносных пчел клещи Варроа служат переносчиками РНК-вирусов, причем высокая инвазия обычно приводит к высоким титрам вирусов.
Управляемые пчелы, включая как медоносных пчел, так и коммерческих шмелей, были вовлечены в распространение многочисленных патогенов и паразитов [21—25]. Имеющиеся данные свидетельствуют о том, что РНК-вирусы также переходят от управляемых медоносных пчел к диким пчелам. В Соединенном Королевстве (Великобритания) симпатрические пчелы используют одни и те же штаммы вирусов [23], а распространенность вирусов у медоносных пчел является значительным предиктором распространенности вирусов у диких шмелей [25]. Последние исследования показывают, что управляемые пасеки медоносных пчел могут быть «горячими точками» для РНК-вирусов. Шмели с большей вероятностью являются носителями вирусов, когда их собирают вблизи пасек медоносных пчел, и только цветы, собранные вблизи пасек, оказались носителями пчелиных вирусов [12]. Кроме того, глобальное распространение DWV тесно связано с перемещением Apis mellifera и клеща Varroa [26]. Однако другие виды пчел не являются известными хозяевами клеща Варроа. Необходимы дополнительные исследования для тщательного изучения принципиальной направленности передачи, а также путей передачи вирусов между видами.
Обнаруженные в фекалиях и железистых выделениях рабочих медоносных пчел, а также в пыльце, переносимой пчелами, РНК-вирусы, вероятно, оставлены на цветах кормящимися посетителями [9,27,28]. Предыдущие работы также показали, что вирусные частицы на пыльцевых зернах могут оставаться инфекционными в течение шести месяцев в условиях окружающей среды [9]. Таким образом, было выдвинуто предположение, что цветки служат платформами для распространения РНК-вирусов среди посещающих их членистоногих. Однако, насколько нам известно, только в одном предыдущем исследовании проверялась передача РНК-вирусов между видами пчел в результате использования цветов. В эксперименте с контролируемыми полетными клетками израильский вирус острого паралича (IAPV) передавался между колониями медоносных пчел и шмелей, которые кормились рядом друг с другом в течение нескольких недель. Хотя общие цветы могли послужить путем передачи вируса, пчелы также могли заразиться при прямом контакте либо при сближении, либо если пчелы попали в ульи друг друга в результате грабежа ресурсов или дрейфа [9]. Кроме того, пока неизвестно, происходит ли передача инфекции при однократном или хроническом контакте с зараженными цветами. Хотя Сингх и др. (2010) сыграли важную роль в демонстрации передачи вируса между видами пчел, роль цветов в передаче РНК-вируса остается неясной.
Передача инфекции через цветки может быть опосредована многими факторами, такими как признаки растений и/или поведение опылителей. Например, способность цветков служить проводниками для патогенов может быть облегчена или ограничена цветочными признаками или морфологией [5,29]. В предыдущих исследованиях, изучавших передачу паразитов через цветки, паразиты неравномерно рассеивались по морфотипам растений [11] и видам [10,29], что говорит о том, что цветочная архитектура может влиять на рассеивание и скорость передачи. Цветочная архитектура может влиять на продолжительность посещения и на то, как пчела физически контактирует с цветком [30], что может повлиять на вероятность осаждения или приобретения вируса. Склонность растений к укрытию вирусов также может быть связана с частотой посещения опылителями, при этом высокопривлекательные растения чаще выступают в качестве фомитов. Цветочные признаки, такие как размер цветка, глубина венчика [31], цвет [32], а также скорость выделения нектара и его состав [33,34], могут влиять на частоту посещения опылителями. Разнообразие цветущих растений также может быть важным фактором, поскольку доступность ресурсов может влиять на цветочные предпочтения кормовых пчел [35,36]. Для заполнения этих пробелов в знаниях о передаче вирусов необходимы дополнительные исследования [5,37].
Здесь мы провели серию экспериментов в клетках с контролируемыми полетами, чтобы проверить, могут ли цветы служить мостом в передаче вирусов между видами пчел. В частности, мы исследовали, наносят ли медоносные пчелы вирусы на цветы и заражаются ли шмели после посещения зараженных цветов. Кроме того, мы исследовали, влияет ли на отложение вирусов вид растений и/или их разнообразие. Измеряя посещение цветов, мы исследовали, увеличивают ли частота посещения медоносными пчелами и/или продолжительность посещения вероятность отложения вирусов на цветах. Для дальнейшего изучения роли цветов в передаче РНК-вирусов мы проверили, происходит ли передача вируса от медоносных пчел к шмелям косвенным путем через цветы, включая хроническое воздействие зараженных цветов. Мы также проверили, происходит ли передача вируса при прямом контакте или сближении во время кормежки на цветах.
Материал и методы
Обзор экспериментов
Чтобы проверить возможность осаждения вирусов на цветы медоносными пчелами и передачу вирусов между видами пчел, использующими общие цветочные ресурсы, мы провели серию экспериментов (рис. 1). Сначала мы позволили зараженным медоносным пчелам кормиться на массивах цветущих растений в экранированном вольере, а затем перенесли эти растения в вольеры, где кормились неинфицированные шмели. После каждого эксперимента мы проверяли всех пчел и цветы. Все кормовые опыты проводились в Берлингтоне, штат Вермонт (44°29’07.2 «N 73°11’12.6 «W).
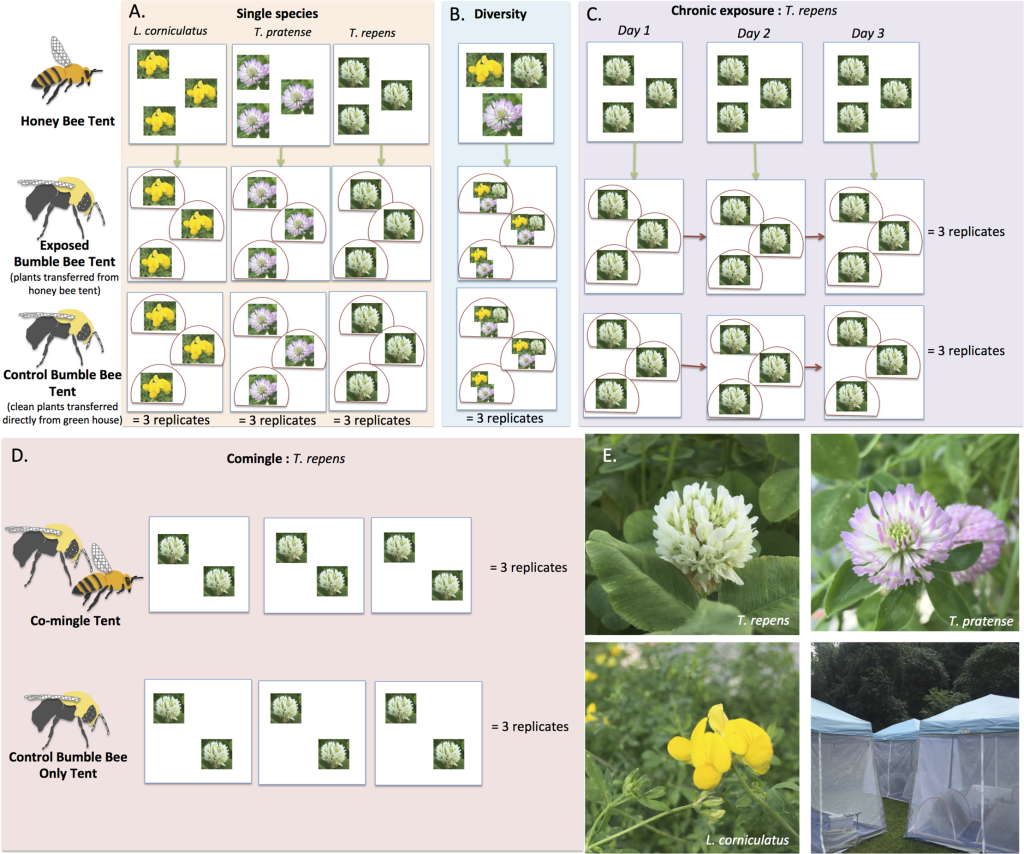
В серии из четырех экспериментов мы исследовали осаждение вируса на цветках медоносными пчелами и/или передачу вируса между медоносными пчелами и шмелями. Для изучения влияния вида растений и/или разнообразия растений, виды цветущих растений предоставлялись пчелам в качестве корма либо в виде отдельных видов растений (A), либо в виде разнообразных массивов, состоящих из всех трех видов (B). Чтобы проверить, является ли хроническое воздействие зараженных цветов необходимым для передачи вируса, микроколонии шмелей трижды подвергались воздействию цветов, посещаемых медоносными пчелами, в течение трех дней (C). Чтобы проверить, необходим ли прямой контакт или сближение для передачи вируса, медоносным пчелам и шмелям позволяли вместе кормиться в палаточных вольерах (D). Синие коробки на схеме представляют палатки, назначенные как палатка медоносных пчел (где инфицированным медоносным пчелам разрешалось кормиться на цветах), палатка шмелей (где растения, зараженные медоносными пчелами, переносились в три обруча для фуражировки микроколониями шмелей) и контрольная палатка шмелей (где микроколонии шмелей фуражировали на «чистых» растениях, принесенных прямо из теплицы). Красные полукруги представляют собой обручи внутри палаток шмелей, каждый из которых содержит одну микроколонию шмелей. Зеленые стрелки показывают перемещение растений из палатки медоносных пчел в открытую палатку шмелей после 15-часового периода восстановления нектара. В хроническом эксперименте в каждый из трех дней использовались одни и те же три колонии шмелей (показаны красными стрелками, соединяющими домик-обруч по времени). На протяжении всей серии экспериментов использовались три вида растений: Trifolium repens, T. pratense и Lotus corniculatus. Фотографии соцветий и палаток (с обручами) представлены для наглядности (E).
https://doi.org/10.1371/journal.pone.0221800.g001
Установка и предварительный отбор
Чтобы сосредоточиться на цветочной архитектуре и уменьшить вариации других признаков растений, мы выбрали три вида бобовых (семейство Fabaceae), два из которых имеют схожую морфологию: Trifolium pratense (красный клевер), Trifolium repens (белый клевер) и Lotus corniculatus (трилистник) (рис. 1E). Оба вида Trifolium схожи, но отличаются от Lotus corniculatus по количеству соцветий и форме соцветия — признакам, которые могут влиять на частоту посещения пчелами, продолжительность посещения и способ контакта пчел с цветочной поверхностью, что приводит к различиям в осаждении вирусов на цветочные поверхности. Соцветия T. pratense и T. repens расположены на стеблях и состоят из шаровидных скоплений из 20-40 трубчатых цветков. Соцветия L. corniculatus представляют собой зонтиковидные циммы, состоящие из восьми цветков, расположенных на конце пазушных ветвей. Мы выбрали три вида растений, которые, по нашим данным, в полевых условиях часто посещаются как медоносными пчелами, так и дикими шмелями (неопубликованные данные) и широко выращиваются в сельском хозяйстве в качестве азотфиксирующих покровных культур и кормов. Мы вырастили растения из семян и содержали их в теплице до начала эксперимента. Начиная с середины мая, мы высевали семена (Seedway, NY) T. pratense, T. repens и L. corniculatus в пластиковые горшки диаметром 8 дюймов и глубиной 6,5 дюймов, заполненные смесью Miracle Grow Potting Mix, чтобы получить около 100 семян на горшок. 100 семян на горшок. Чтобы стимулировать цветение, мы обрезали растения T. repens и T. pratense один и два раза, соответственно, и использовали лампы для выращивания для поддержания 14 часов солнечного света. Чтобы убедиться, что растения не содержат вирусов в начале эксперимента, мы бессистемно собрали три составных образца по 1,5 грамма с каждого вида растений и проверили их на DWV и BQCV с помощью протоколов RT-qPCR.
Чтобы убедиться, что наши экспериментальные колонии медоносных пчел были заражены обоими вирусами, мы собрали по 50 пчел из каждой из двух пятирамочных колоний медоносных пчел (исследовательские колонии Университета Вермонта) и проверили каждый составной образец на DWV и BQCV с помощью RT-qPCR. Таким образом, мы знали, что эти колонии были инфицированы обоими вирусами. Мы получили семь колоний шмелей от коммерческого поставщика (BioBest). Чтобы убедиться, что эти пчелы не заражены DWV и BQCV, мы лишили пыльцы 10 пчел из каждой колонии на 72 часа и проверили каждую пчелу с помощью RT-qPCR. Пчел лишили пыльцы, чтобы избавить их кишечник от пыльцы, которая могла содержать частицы вируса. Все колонии шмелей показали отрицательный результат на DWV и BQCV. Из семи колоний мы создали микроколонии из 12 взрослых пчел, обеспечили их 30% раствором сахарозы ad libitum и позволили им акклиматизироваться в течение пяти дней в ростовой камере при температуре 26°C и 52-55% относительной влажности. Мы создавали новые микроколонии каждые три дня, чтобы каждая микроколония, используемая в эксперименте, была примерно одного возраста.
Все эксперименты проводились в трех экранированных палатках размером 3 x 3 x 3 м с брезентовым дном. Каждая палатка была отнесена к одному методу лечения: палатка медоносных пчел, контрольная палатка шмелей или открытая палатка шмелей (рис. 1E). Мы использовали одну дополнительную палатку в качестве места для содержания растений, чтобы нежелательные насекомые не посещали растения во время эксперимента. Чтобы ограничить шмелей меньшей кормовой площадью, мы установили три домика-обруча в каждой из двух контрольных и открытых палаток. Обручи (1 x 1 x 0,7 м) были построены из белой ткани, натянутой и скрепленной степлером на два куска арочных ПВХ трубок, которые были прикручены к деревянной раме.
Схема эксперимента
В каждый день эксперимента мы переносили растения из теплицы в палатку для содержания растений и поливали их. Мы подсчитывали все соцветия, чтобы обеспечить стандартный диапазон между репликами и обработками, и распределяли их соответствующим образом. Для акклиматизации пчел в вольере, две колонии (состоящие из пяти рамок каждая) были помещены в палатку для пчел за 24 часа до начала эксперимента. Чтобы заразить цветущие растения, мы поместили растения в экранированный вольер с двумя колониями медоносных пчел и позволили пчелам посещать цветы. После кормовых испытаний мы перенесли растения в палатку, чтобы пополнить запасы нектара. Через 15 часов мы перенесли растения, посещенные медоносными пчелами, в открытую палатку для шмелей и равномерно распределили их между тремя обручами, в каждом из которых находилась одна микроколония шмелей. В то же время, мы провели три повторных контроля для каждого эксперимента в трех домиках-обручах в контрольной палатке шмелей. Шмели в контрольном шатре получали чистые цветущие растения, привезенные прямо из теплицы. Все опыты проводились в тени, чтобы уменьшить воздействие ультрафиолета на цветы и деградацию вирусной РНК. В каждый день кормовых испытаний медоносным пчелам и шмелям позволяли кормиться на цветочных решетках в течение девяти и шести часов, соответственно. В эксперименте по сближению, где медоносные пчелы и шмели кормились вместе в одной палатке, пчелам разрешалось кормиться в течение семи часов. Такое время кормежки было выбрано для того, чтобы максимально увеличить количество кормового времени за один день для повышения вероятности обнаружения эффекта.
Для измерения посещаемости мы наблюдали за шмелями до тех пор, пока 50% цветков в каждом повторе не были посещены. Чтобы тщательно изучить, как посещение медоносными пчелами может повлиять на осаждение вируса на цветках, мы снимали каждый опыт в течение трех часов. Мы просмотрели видеозаписи и записали общее количество посещений медоносными пчелами каждого вида растений и вычислили продолжительность посещения каждой кормящей медоносной пчелой (в секундах) каждого соцветия во время съемок.
В каждом опыте мы позволяли микроколониям по 12 пчел кормиться на цветках, которые подвергались или не подвергались воздействию медоносных пчел. Через шесть часов мы собрали все соцветия и шмелей. Мы хранили соцветия при температуре -80°C. Микроколонии шмелей помещали в новые контейнеры и кормили 30% сахарозой ad libitum в течение одной недели в ростовой камере. Если шмели подвергались воздействию инфекционного вируса во время эксперимента, недельный «инкубационный» период позволял начать вирусную инфекцию. В течение этого периода мы не кормили пчел пыльцой, чтобы очистить их кишечник от пыльцы, которая могла содержать неактивные частицы вируса, что привело бы к ложноположительному результату при вирусном анализе. Через неделю мы собрали всех пчел и хранили их при температуре -80°C до выделения РНК и проведения вирусных анализов.
Чтобы проверить, влияет ли вид растения на осаждение вируса и/или передачу вируса между видами пчел, мы провели описанные выше кормовые испытания с тремя повторами для каждого вида растений: T. repens, T. pratense и L. corniculatus (эксперимент «один вид») (рис. 1А). Мы стандартизировали количество соцветий, используемых в каждой репликации: 15-20 соцветий T. repens, 13-15 соцветий T. pratense и 31-40 соцветий L. corniculatus. Поскольку соцветия L. corniculatus содержат менее половины количества соцветий, чем T. pratense и T. repens, мы использовали примерно вдвое больше соцветий.
Чтобы проверить, влияет ли разнообразие растений на осаждение и/или передачу вируса, мы позволили пчелам кормиться на цветочных массивах, содержащих все три вида растений одновременно (эксперимент «разнообразие») (рис. 1B). Каждый массив разнообразия был повторен три раза и состоял из 7-8 соцветий T. repens, 6 соцветий T. pratense и 15-21 соцветия L. corniculatus. Как для испытаний с одним видом растений, так и для испытаний с разнообразием, мы собирали отдельные образцы каждого вида растений после каждого повторения, в общей сложности по три образца цветов каждого вида за испытание для каждой из подвергшихся воздействию и контрольных групп.
Чтобы проверить, является ли хроническое воздействие зараженных цветов необходимым для передачи вируса, мы повторили эксперимент с использованием T. repens (эксперимент «хроническое воздействие») в трех повторах (рис. 1С). Шесть микроколоний шмелей были отнесены либо к группе, подвергшейся воздействию, либо к контрольной группе, и им разрешили кормиться на растениях T. repens, подвергшихся или не подвергшихся воздействию, три дня подряд (по шесть часов каждый день). Мы позволяли растениям пополнять запасы нектара между кормлениями медоносных пчел и шмелей, как и в других экспериментах. Каждый день использовалось новое растение T. repens. После трех экспозиций мы собрали всех шмелей, перенесли их в новые контейнеры, обеспечили 30% сахарозой ad libitum и «инкубировали» их в течение одной недели, как в предыдущих экспериментах, а затем перенесли их при -80°C. Мы также собирали цветы каждый день эксперимента по хроническому воздействию и хранили их при -80°C. Поскольку каждый день использовались новые растения, мы собрали в общей сложности девять образцов цветов, подвергшихся воздействию, и девять контрольных образцов цветов.
Чтобы проверить, необходим ли прямой контакт или сближение на цветках для передачи вирусов между видами пчел, мы использовали колонии шмелей, состоящие из 75-100 рабочих, и массивы T. repens, состоящие из 41-47 соцветий (эксперимент «сближение») (рис. 1D). Мы поместили две колонии медоносных пчел, одну колонию шмелей и горшки с растениями T. repens в палаточный вольер. В качестве контроля мы поместили одну колонию шмелей с растениями в отдельную палатку. Мы позволили всем пчелам кормиться на растениях в течение семи часов, в течение которых мы наблюдали, пока и медоносные пчелы, и шмели не посетили более 50% цветков, присутствующих в каждом экземпляре. Через семь часов мы вернули всех кормящихся шмелей обратно в их колонию и перенесли их обратно в ростовую камеру. Эту процедуру повторяли три раза в течение трех дней, используя те же колонии медоносных пчел, но разные колонии шмелей. Мы кормили колонии шмелей пыльцой и 30% сахарозой ad libitum в течение трех недель в камерах роста, чтобы стимулировать распространение вирусов по всей колонии. Через три недели мы создали микроколонии, лишенные пыльцы и состоящие из 12 пчел. После недельного периода пыльцевого голодания мы собрали этих пчел и хранили их при -80°C. Из каждой репликации было собрано по два образца цветков, в общей сложности шесть образцов цветков, подвергшихся воздействию, и шесть образцов контрольных цветков.
Выделение РНК
Мы выделяли тотальную РНК, следуя протоколам набора Qiagen RNeasy mini kit. Все брюшко каждой отдельной шмелевой пчелы вскрывали, замораживали на N2 и гомогенизировали в 600 мл буфера RLT (10% β-меркаптоэтанола), после чего использовали протоколы Qiagen для каждой отдельной шмелевой пчелы. Для предварительного скрининга медоносных пчел образцы 50 пчел были объединены в пул, заморожены в N2 и гомогенизированы вместе в экстракционном мешке с 10 мл буфера GITC. Полученный гомогенат центрифугировали и 100 мл лизата смешивали с буфером RLT (10% β-меркаптоэтанола), после чего использовали протоколы Qiagen. Для предварительно отобранных и экспериментальных растений 1,5 г цветочного материала, состоящего из целых соцветий, переносили в пакет для экстракции (Bioreba, Швейцария) и замораживали в N2. Растительный материал измельчали в порошок с помощью керамического пестика на внешней стороне экстракционного мешка в течение 30 секунд. В пакет добавляли 3 мл буфера GITC и снова использовали пестик с внешней стороны пакета для перемешивания гомогената в буфере в течение 2 минут. Полученный гомогенат центрифугировали и 200 ul использовали для выделения РНК в соответствии с протоколами набора Qiagen RNeasy mini kit. Количество и качество РНК оценивали на спектрометре (Nanodrop, Thermo Scientific).
Обнаружение и количественная оценка вирусов
Для шмелей и медоносных пчел все экстракты РНК были разбавлены до 20 нг/л перед проведением анализа на наличие вирусов. РНК, полученную из растений, не разбавляли перед дальнейшим анализом. Для обратной транскрипции РНК и абсолютного количественного определения для каждого образца проводили дублирующую количественную полимеразную цепную реакцию обратной транскрипции (RT-qPCR) с использованием одношагового набора SYBR green RT-qPCR в 10 ul реакциях с использованием следующей программы термоциклирования: 10 мин при 50°C (RT), затем 1 мин при 95°C, и 40 циклов амплификации 95°C в течение 15 с, 60°C в течение 60 с. В последнюю очередь получали кривую расплава, начиная с 65-95°C (с шагом 0,5°C, каждые 2 с). Мы использовали праймеры, специфичные к положительной нити следующих РНК-вирусов-мишеней: DWV и BQCV, а также ген домашнего хозяйства (ACTIN) в качестве положительного контроля эффективности выделения РНК (Таблица S1). Количественное определение рассчитывали с использованием дублированных стандартных кривых генных фрагментов gBlocks, которые были разработаны с использованием двухцепочечных, проверенных по последовательности геномных блоков, состоящих из четырех интересующих мишеней, разделенных десятью случайными парами оснований (S1 Дополнительная информация). Последовательности случайных пар оснований, состоящие не менее чем на 50% из G и Cs, использовались в начале и конце фрагмента. Эффективность составила 91,06% (DWV), 95,21% (BQCV) и 90,12% (Actin), с коэффициентами корреляции (R2) в диапазоне 0,993-0,999.
Секвенирование
Для подтверждения идентичности вирусов мы секвенировали фрагменты вирусов, полученные от шмелей, медоносных пчел и цветов. Продукты qPCR очищали (ExoSAP-IT PCR Product Cleanup) и проводили секвенирование на генетическом анализаторе 3130xl в центре передовых геномных технологий онкологического центра университета Вермонта. Данные секвенирования просматривались для оценки качества (FinchTV 1.4) и выравнивались на глаз по геномным эталонам с помощью Geneious v 6.0.6 (BQCV: GenBank: KY243932.1; DWV: GenBank: KJ437447.1).
Представление данных и анализ
Под распространенностью вируса на цветках мы понимаем процент образцов цветков с вирусом в каждом экспериментальном опыте. Вирусная нагрузка представлена как количество копий генома на образец цветка или пчелу. Частота посещений рассчитывалась как общее количество посещений медоносной пчелой в час для каждого вида растений. Продолжительность посещения измерялась как количество времени, в течение которого наблюдалось посещение соцветий пчелами-фуражирами (в секундах). Поскольку растения в опытах с хроническим воздействием экспериментально обрабатывались так же, как и растения в опытах с одним видом, мы объединили эти данные в анализе осаждения вируса на растениях. Данные по испытаниям сближения были опущены из анализа осаждения вируса на растениях, поскольку эти испытания проводились только для изучения передачи вируса при прямом контакте между видами пчел и имели другие экспериментальные условия, которые могли повлиять на результаты (количество соцветий, время кормежки).
Для изучения влияния вида растений, вида вируса и их взаимодействия на распространенность вируса (здесь анализируется как наличие/отсутствие) на цветках, использованных в одновидовых испытаниях, мы использовали обобщенную линейную модель смешанных эффектов (GLMM) с образцом цветка в качестве случайного эффекта. Для изучения распространенности РНК-вирусов на цветках модель была построена таким образом, что каждый образец цветка включался дважды, по одному разу для каждого вируса. Для изучения эффекта взаимодействия разнообразия растений и видов растений на распространенность вирусов, мы провели отдельное GLMM, тестируя взаимодействие разнообразия (один вид против смеси трех видов) и видов растений с образцом цветка в качестве случайного эффекта. Поскольку частота посещений и продолжительность посещений могут аддитивно влиять на осаждение вируса на цветках, мы провели третью GLMM, включив частоту посещений и продолжительность посещений в качестве фиксированных эффектов и включив образец цветка в качестве случайного эффекта. Все модели GLMM по распространенности вирусов были проведены с биномиальным распределением (связь = «logit»). Вирусная нагрузка зараженных цветов была преобразована в log10 для достижения нормальности перед анализом. Для вирусной нагрузки мы провели линейные смешанные модели (LMM) с идентичными структурами, условиями и случайными эффектами, как и GLMM. Взаимодействие разнообразия (один вид против смеси трех видов) и видов растений не было включено в модель вирусной нагрузки, так как модель была ранговой и не могла вычислить член взаимодействия [38]. Поскольку ни один шмель не был инфицирован в ходе испытаний, мы не смогли проверить влияние экспериментов с одним видом, разнообразием, хроническим или смешиванием на распространенность или вирусную нагрузку на шмелей.
Все модели смешанных эффектов проводились с помощью пакета LME4 с использованием функции glmer() для распространенности вируса и функции lmer() для вирусной нагрузки [39]. Значимость для всех моделей определялась путем сравнения полной и сокращенной моделей с помощью тестов на отношение правдоподобия. Попарное сравнение проводили с помощью контрастов Тьюки в пакете MULTCOMP, используя функции glht() и mcp() [40]. Чтобы избежать ошибок, связанных с post hoc тестами для взаимодействующих переменных, парные сравнения проводились только для значимых главных эффектов с тремя и более уровнями факторов в моделях с не значимыми эффектами взаимодействия. Все анализы проводились с использованием статистического программного обеспечения «R» v 3.5.1 [41].
Результаты
В начале эксперимента все виды растений были отрицательными на DWV и BQCV. Вирусная нагрузка РНК в двух колониях медоносных пчел составляла 104 и 109 геномных копий на пчелу для DWV и 108 и 106 геномных копий на пчелу для BQCV. Все шмели были отрицательными на оба вируса в начале эксперимента (n = 70). Ни один шмель не заразился ни в одном из экспериментов (один вид растений, разнообразие, хроническое воздействие, объединение) ни в контрольной группе (n = 192), ни в группе, подвергшейся воздействию (n = 220).
Все цветы, которые посещали только шмели (контрольная группа), были отрицательными для обоих вирусов. На 24,2% и 21,2% цветков, посещенных как медоносными пчелами, так и шмелями, мы обнаружили DWV и BQCV. Когда зараженным медоносным пчелам предлагались отдельные виды растений, мы обнаружили вирусы на всех трех видах (Таблица 1). Однако мы обнаружили значительный эффект взаимодействия вида растений и вида вируса (χ22 = 11,15, p = 0,004), в результате чего DWV и BQCV не были одинаково распределены между видами растений (Таблица 2). Главные эффекты вида растений и вида вируса не были значимыми. В испытаниях разнообразия, где все три вида растений предлагались вместе, мы обнаружили вирусы только на T. pratense (Таблица 1). Анализируя наборы данных из опытов с одним растением и разнообразием, мы обнаружили значительное взаимодействие вида растения и эксперимента (χ 22 = 17,91, p < 0,001; Таблица 2). Цветы, которые дольше всего посещались фуражирами медоносных пчел, были более вероятно заражены вирусами (χ 22 = 4,076, p = 0,044, Таблица 2). Однако мы наблюдали противоположную тенденцию с частотой посещений. Цветы, получившие наименьшее количество посещений, были менее вероятно заражены вирусами (χ 22 = 5,452, p = 0,020, Таблица 2).
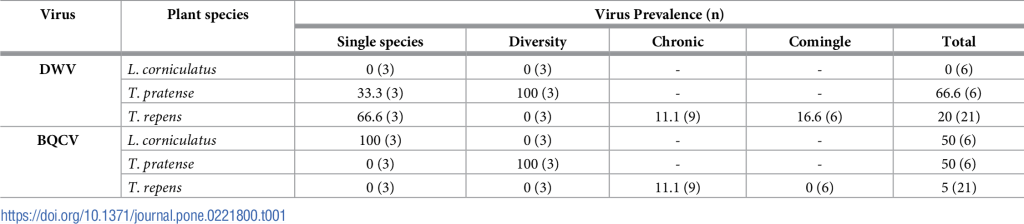
Все растения, на которых кормились только шмели, были отрицательными на вирусы и поэтому исключены из данной таблицы. Распространенность вируса представлена как количество образцов цветов с обнаруженным вирусом, деленное на общее количество образцов цветов, протестированных для каждого испытания (n), умноженное на 100. В столбце «Итого» приведена распространенность вируса для каждого вида растений во всех экспериментах.
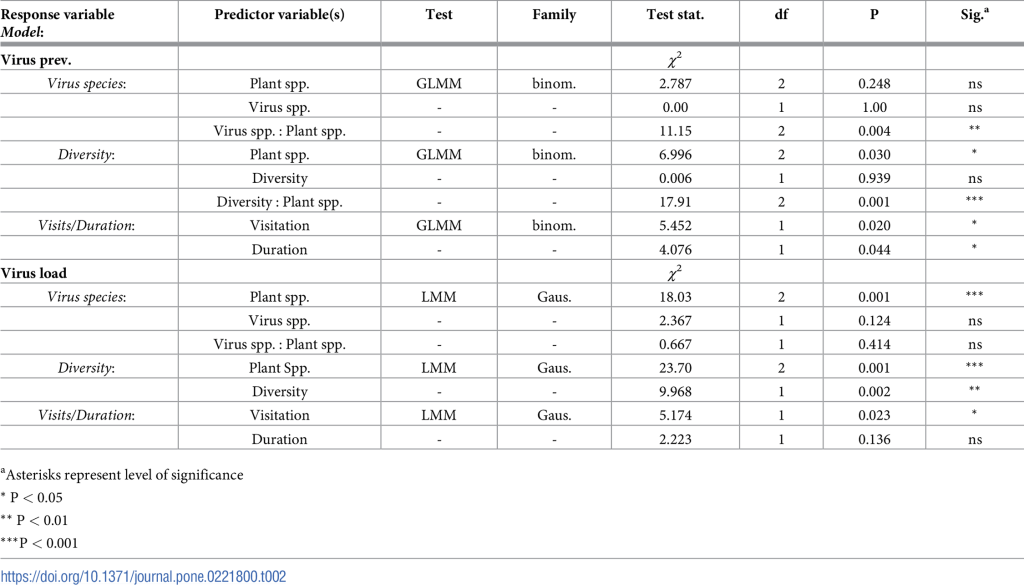
Для каждой модели указаны переменные отклика и предикторные переменные с соответствующими сводными статистическими данными. Virus prev. представляет собой распространенность вируса и представляется как число образцов растений с обнаруженным вирусом, деленное на общее число образцов растений в наборе данных, умноженное на 100. Вирусная нагрузка представлена в виде копий генома вируса на образец цветка. Виды растений означают виды растений, использованные в экспериментах: Lotus corniculatus (трилистник), Trifolium pratense (красный клевер) или Trifolium repens (белый клевер). Виды вирусов — либо вирус деформированного крыла (DWV), либо вирус черной королевы клеток (BQCV). Разнообразие — либо «один вид», либо «смесь трех видов». В эксперименте «один вид» пчелы кормились на массивах, состоящих только из одного вида за раз. В эксперименте «смесь видов» пчелы кормились на массивах, состоящих из всех трех видов растений одновременно. Посещаемость (частота посещений) рассчитывалась как количество посещений пчелами цветов в час. Продолжительность (длительность посещения) рассчитывалась как количество времени, в течение которого каждая пчела посещала соцветие (в секундах).
Нагрузка вируса на цветки варьировала в пределах 103-105 копий генома (рис. 2). В испытаниях на видовое разнообразие нагрузка вируса различалась по видам растений (χ 12 = 18,03, p < 0,001, Таблица 2) и была наименьшей на T. repens по сравнению с T. pratense (p = 0,02) и L. corniculatus (p = 0,005), но не различалась по видам вирусов (χ 22 = 2,367, p = 0,124). Взаимодействие вида растений и вида вируса не было значимым для вирусной нагрузки. Вирусная нагрузка различалась в зависимости от разнообразия (один вид растений против смеси трех видов), причем самая высокая вирусная нагрузка наблюдалась на растениях в испытаниях смеси трех видов (χ 12 = 9,968, p = 0,002). Цветы, которые посещало меньшее количество медоносных пчел, имели самую высокую вирусную нагрузку (χ 22 = 5,174, p = 0,023). Продолжительность посещения не повлияла на вирусную нагрузку, оставленную на цветах пчелами-фуражирами (χ 22 = 2,223, p = 0,136).

Коробчатые графики с цветовым кодированием по видам растений. Усики представляют максимальное и минимальное значения, края коробки — 1-й и 3-й квартили, а средняя линия — медиану. Вирус деформированного крыла (DWV), вирус черной королевы клеток (BQCV). Виды растений: Lotus corniculatus (птичий трилистник), Trifolium pratense (красный клевер) или Trifolium repens (белый клевер).
Обсуждение
Несмотря на то, что цветы были связаны мостами в распространении болезней пчел [5], роль цветов в передаче РНК-вирусов среди видов опылителей оставалась практически неизученной. Используя серию кормовых экспериментов с колониями медоносных пчел в неволе и массивами цветущих растений, мы экспериментально продемонстрировали, что медоносные пчелы депонируют вирусы на цветках. Мы также обнаружили доказательства того, что виды цветущих растений и/или поведение пчел могут влиять на вероятность отложения вирусов. Наше исследование является одним из первых, в котором тщательно изучается роль цветов в передаче вирусов пчелами, и первым, в котором продемонстрировано отложение вирусов на цветах медоносными пчелами.
Вирус деформированного крыла и BQCV по-разному осаждались на трех видах растений, что указывает на то, что способы осаждения вирусов различны для разных видов и что осаждение может быть опосредовано цветочными признаками. В нашем исследовании осаждение вирусов на L. corniculatus было уникальным, поскольку BQCV был обнаружен во всех образцах, но не был обнаружен DWV. Напротив, DWV и BQCV были обнаружены на обоих видах Trifolium в ходе исследования. По сравнению с видами Trifolium, соцветия L. corniculatus наименее похожи морфологически и состоят только из восьми соцветий (по сравнению с 20-40 у видов Trifolium). Чтобы посетить нектарники Trifolium, опылители получают доступ к нектарникам, прощупывая многочисленные трубчатые цветки, ползая по поверхности головки соцветия. У L. corniculatus доступ к нектарникам может осуществляться только через контакт с передней частью пчелы. Если вирус попадает с фекалиями, цветочная морфология, способствующая «парящему» поведению, может снизить вероятность попадания вируса [5]. Аналогичным образом, если вирусы попадают в организм через ротовые выделения, то сложные соцветия с многочисленными соцветиями для зондирования могут увеличить вероятность осаждения вируса. В других системах пчела-патоген, признаки растений, такие как цветочная морфология [10,11] или количество открытых цветков [29], определены как важные факторы, влияющие на передачу вируса. Чтобы понять, какие именно цветочные признаки способствуют осаждению вируса, в будущих исследованиях следует провести количественные измерения цветочных признаков и манипулировать такими признаками, как количество соцветий и глубина венчика. Сингх и др. (2010) отметили, что виды вирусов, обнаруженные у медоносных пчел, и соответствующая им пыльцевая нагрузка значительно различались, что говорит о различиях в вирусной экологии и/или различиях в контакте опылителей с зараженной пыльцой [9]. Изучение различий в том, как различные РНК-вирусы вылетают из посещающих опылителей, также помогло бы объяснить эффект взаимодействия.
Мы обнаружили, что цветки, которые дольше посещались медоносными пчелами, с большей вероятностью содержали вирусы. Однако цветы с более высокой частотой посещений реже становились носителями вирусов, а также имели более низкую вирусную нагрузку. Эти результаты подчеркивают сложность данной системы исследования и необходимость понять, как вирусы переносятся пчелами на цветы во время кормежки.
Мы наблюдали взаимодействие цветочного разнообразия и видов растений, которое не объясняется только различиями в продолжительности посещения. Когда пчелы кормились на одновидовых цветочных массивах, вирусы попадали на все три вида. Однако, когда пчелам предлагали разнообразные сети, состоящие из всех трех видов растений, мы обнаружили вирусы только на T. pratense, несмотря на отсутствие различий в продолжительности посещения T. pratense между испытаниями разнообразия (один вид против смеси трех видов) (S1 рис.). Наши результаты можно объяснить, если в колониях медоносных пчел были как инфицированные, так и неинфицированные особи, которые по-разному кормились в зависимости от статуса инфекции. Кормление отличается для зараженных паразитами пчел от корма для незараженных, что позволяет предположить, что пчелы ищут выгоду от лекарственных свойств вторичных растительных метаболитов [42—46]. По сравнению с T. repens, в T. pratense значительно выше концентрация изофлавоноидов [47], группы фенольных соединений, обладающих противовирусными свойствами против широкого спектра вирусов [48]. Однако в начале эксперимента мы не смогли отличить инфицированных пчел от неинфицированных. Будущая работа должна изучить потенциальные различия в кормовом поведении особей, инфицированных РНК-вирусами.
В наших экспериментальных условиях у шмелей не развилась инфекция после прямого контакта с медоносными пчелами через сближение или косвенного контакта через общие цветы. Эти результаты показывают, что передача вирусов между видами пчел через цветы является редким явлением, а экспериментальное обнаружение зависит от множества факторов. Например, такие факторы, как иммунокомпетентность, вирулентность вируса, вирусная нагрузка и вероятность контакта шмеля с вирусной частицей на цветке могут способствовать обнаружению. Хотя передача вируса через цветки может иметь низкую вероятность, высокая распространенность зараженных цветков и высокая частота посещения цветков пчелами в дикой природе могут быть признаками процесса, который часто происходит в природе, но который трудно уловить в экспериментальных условиях. Мы также отмечаем, что мы не проверяли, являются ли штаммы вируса наших медоносных пчел инфекционными для шмелей. Таким образом, хотя мы не продемонстрировали передачу вируса шмелям в нашем эксперименте, мы по-прежнему осторожны, чтобы исключить такую возможность в других экспериментальных условиях и при большем объеме выборки.
Наши результаты представляют несколько перспективных направлений для будущих исследований. Нам удалось продемонстрировать осаждение вируса на цветы медоносными пчелами в экспериментальных условиях. Чтобы проверить, насколько наши результаты применимы в природе, в будущих исследованиях следует проверить полевые цветы, собранные вблизи пасек медоносных пчел. Поскольку другие виды пчел также могут откладывать вирусы на цветочные ресурсы, выбор полевых участков с различной плотностью медоносных пчел и измерение посещения цветов может пролить свет на важность медоносных пчел в сравнении с другими пчелами для отложения вирусов на цветах. Для дальнейшего понимания направленности передачи вируса в будущих экспериментах следует проверить, будут ли зараженные шмели и/или другие виды пчел также откладывать вирусы на цветках [49]. Кроме того, будущие эксперименты должны быть сосредоточены на второй половине пути передачи и изучить, могут ли шмели и/или другие виды пчел приобретать частицы вируса или заражаться после посещения инокулированных цветков. Наши результаты свидетельствуют о том, что виды цветущих растений могут различаться по своей склонности к укрытию вирусов. Таким образом, тщательное изучение механизмов осаждения вируса в сочетании с цветочными признаками может помочь объяснить наблюдаемые нами различия. Наконец, необходимы дополнительные поведенческие исследования, чтобы выяснить, как вирусная инфекция может повлиять на кормовое поведение.
Вспомогательная информация
S1 Таблица. Праймеры, использованные для амплификации ампликонов РНК вируса и актина.
https://doi.org/10.1371/journal.pone.0221800.s001
(PDF)
S1 Дополнительная информация. Последовательность gBlocks Gene Fragments (Integrated DNA Technologies).
Вирусные и актиновые ампликоны окрашены для визуализации: Зеленый = DWV, Синий = IAPV, Красный = Актин, Желтый = BQCV. Десять случайных пар оснований (не окрашены) фланкируют каждую интересующую мишень. https://doi.org/10.1371/journal.pone.0221800.s002
(PDF)
S1 Рис. Продолжительность визита медоносных пчел и частота посещений в зависимости от вида растений и эксперимента.
Врезные диаграммы показывают среднюю продолжительность посещения медоносными пчелами трех видов растений: Lotus corniculatus (птичий трилистник), Trifolium pratense (красный клевер) и T. repens (белый клевер). Цвета квадратных диаграмм представляют данные эксперимента «разнообразие», где все виды растений предоставлялись одновременно, и «один вид», где каждый вид растений предоставлялся по отдельности. Буквы над квадратными диаграммами показывают результаты парных сравнений для данных о продолжительности посещения. Красные линии показывают скорость посещения (количество посещений пчелами/час) каждого вида растений для каждого эксперимента. Перед анализом данные о продолжительности посещения были преобразованы в log10 для достижения нормальности. Мы изучили влияние вида растений на продолжительность посещения в ANOVA, используя данные опытов с одним видом растений. Попарное сравнение проводилось с помощью контрастов Тьюки (библиотека R multcomp, функции glht и mcp). В отдельном ANOVA, используя данные испытаний одного вида и разнообразия, мы исследовали эффект взаимодействия вида растений и эксперимента (один вид против разнообразия) на продолжительность посещения. https://doi.org/10.1371/journal.pone.0221800.s003
(TIF)
Ссылки
1.Goulson D, Nicholls E, Botías C, Rotheray EL. Bee declines driven by combined stress from parasites, pesticides, and lack of flowers. Sciencexpress. 2015;2010: 1–16.
View Article Google Scholar
2.Potts SG, Biesmeijer JC, Kremen C, Neumann P, Schweiger O, Kunin WE. Global pollinator declines: Trends, impacts and drivers. Trends Ecol Evol. 2010;25: 345–353. pmid:20188434
View Article PubMed/NCBI Google Scholar
3.Williams PH, Osborne JL. Bumblebee vulnerability and conservation world-wide. Apidologie. 2009;40: 367–387.
View Article Google Scholar
4.Evans JD, Schwarz RS. Bees brought to their knees: Microbes affecting honey bee health. Trends Microbiol. Elsevier Ltd; 2011;19: 614–620. pmid:22032828
View Article PubMed/NCBI Google Scholar
5.McArt SH, Koch H, Irwin RE, Adler LS. Arranging the bouquet of disease: Floral traits and the transmission of plant and animal pathogens. Ecol Lett. 2014;17: 624–636. pmid:24528408
View Article PubMed/NCBI Google Scholar
6.Levitt AL, Singh R, Cox-Foster DL, Rajotte E, Hoover K, Ostiguy N, et al. Cross-species transmission of honey bee viruses in associated arthropods. Virus Res. 2013;176: 232–240. pmid:23845302
View Article PubMed/NCBI Google Scholar
7.Ravoet J, Smet L De, Meeus I, Smagghe G, Wenseleers T, Graaf DC De. Widespread occurrence of honey bee pathogens in solitary bees. J Invertebr Pathol. 2014;122: 55–58. pmid:25196470
View Article PubMed/NCBI Google Scholar
8.Li J, Peng W, Wu J, Strange JP, Boncristiani H, Chen Y. Cross-species infection of deformed wing virus poses a new threat to pollinator conservation. J Econ Entomol. 2011;104: 732–739. pmid:21735887
View Article PubMed/NCBI Google Scholar
9.Singh R, Levitt AL, Rajotte EG, Holmes EC, Ostiguy N, Vanengelsdorp D, et al. RNA viruses in hymenopteran pollinators: Evidence of inter-taxa virus transmission via pollen and potential impact on non-Apis hymenopteran species. PLoS One. 2010;5: e14357. pmid:21203504
View Article PubMed/NCBI Google Scholar
10.Graystock P, Goulson D, Hughes WOH. Parasites in bloom: flowers aid dispersal and transmission of pollinator parasites within and between bee species. Proc R Soc B Biol Sci. 2015;282. Available: http://dx.doi.org/10.1098/rspb.2015.1371
View Article Google Scholar
11.Durrer S, Schmid-Hempel P. Shared Use of Flowers Leads to Horizontal Pathogen Transmission. Proc R Soc B Biol Sci. 1994;258: 299–302.
View Article Google Scholar
12.Alger SA, Burnham PA, Boncristiani HF, Brody AK. RNA virus spillover from managed honeybees (Apis mellifera) to wild bumblebees (Bombus spp.). PLoS One. 2019;14: e0217822. pmid:31242222
View Article PubMed/NCBI Google Scholar
13.Purkiss T, Lach L. Pathogen spillover from Apis mellifera to a stingless bee. Proc R Soc B Biol Sci. 2019;286.
View Article Google Scholar
14.Melathopoulos A, Ovinge L, Wolf P, Castillo C, Ostermann D, Hoover S. Viruses of managed alfalfa leafcutting bees (Megachille rotundata Fabricus) and honey bees (Apis mellifera L.) in Western Canada: Incidence, impacts, and prospects of cross-species viral transmission. J Invertebr Pathol. Elsevier; 2017;146: 24–30. pmid:28400199
View Article PubMed/NCBI Google Scholar
15.Yang X, Cox-Foster DL. Impact of an ectoparasite on the immunity and pathology of an invertebrate: evidence for host immunosuppression and viral amplification. Proc Natl Acad Sci U S A. 2005;102: 7470–7475. pmid:15897457
View Article PubMed/NCBI Google Scholar
16.Di Prisco G, Cavaliere V, Annoscia D, Varricchio P, Caprio E, Nazzi F. Neonicotinoid clothianidin adversely affects insect immunity and promotes replication of a viral pathogen in honey bees. Proc Natl Acad Sci. 2013;110: 18466–18471. pmid:24145453
View Article PubMed/NCBI Google Scholar
17.Chen Y, Pettis JS, Collins A, Feldlaufer MF. Prevalence and transmission of honeybee viruses. Appl Environ Microbiol. 2006;72: 606–611. pmid:16391097
View Article PubMed/NCBI Google Scholar
18.Bowen-Walker P, Martin S, Gunn A. The transmission of deformed wing virus between honeybees (Apis mellifera L.) by the ectoparasitic mite varroa jacobsoni Oud. J Invertebr Pathol. 1999;73: 101–106. pmid:9878295
View Article PubMed/NCBI Google Scholar
19.Genersch E, Yue C, Fries I, De Miranda JR. Detection of Deformed wing virus, a honey bee viral pathogen, in bumble bees (Bombus terrestris and Bombus pascuorum) with wing deformities. J Invertebr Pathol. 2006;91: 61–63. pmid:16300785
View Article PubMed/NCBI Google Scholar
20.Leat N, Ball B, Govan V, Davison S. Analysis of the complete genome sequence of black queen-cell virus, a picorna-like virus of honey bees. J Gen Virol. 2000;81: 2111–2119. pmid:10900051
View Article PubMed/NCBI Google Scholar
21.Otterstatter MC, Thomson JD. Does pathogen spillover from commercially reared bumble bees threaten wild pollinators? PLoS One. 2008;3. pmid:18648661
View Article PubMed/NCBI Google Scholar
22.Colla SR, Otterstatter MC, Gegear RJ, Thomson JD. Plight of the bumble bee: Pathogen spillover from commercial to wild populations. Biol Conserv. 2006;129: 461–467.
View Article Google Scholar
23.Fürst M a, McMahon DP, Osborne JL, Paxton RJ, Brown MJF. Disease associations between honeybees and bumblebees as a threat to wild pollinators. Nature. 2014;506: 364–6. pmid:24553241
View Article PubMed/NCBI Google Scholar
24.Graystock P, Goulson D, Hughes WOH. The relationship between managed bees and the prevalence of parasites in bumblebees. Peer J. 2014; 1–24. pmid:25165632
View Article PubMed/NCBI Google Scholar
25.McMahon DP, Fürst M a., Caspar J, Theodorou P, Brown MJF, Paxton RJ. A sting in the spit: widespread cross-infection of multiple RNA viruses across wild and managed bees. J Anim Ecol. 2015;84: 615–624. pmid:25646973
View Article PubMed/NCBI Google Scholar
26.Wilfert L, Long G, Leggett HG, Schmid-Hempel P, Butlin R, Martin SJM, et al. Deformed wing virus is a recent global epidemic in honeybees driven by Varroa mites. Science (80-). 2016;351: 594–597. pmid:26912700
View Article PubMed/NCBI Google Scholar
27.Mazzei M, Carrozza ML, Luisi E, Forzan M, Giusti M, Sagona S, et al. Infectivity of DWV associated to flower pollen: experimental evidence of a horizontal transmission route. PLoS One. 2014;9: e113448. pmid:25419704
View Article PubMed/NCBI Google Scholar
28.Chen YP, Higgins JA, Feldlaufer MF. Quantitative real-time reverse transcription-PCR analysis of deformed wing virus infection in the honeybee (Apis mellifera L.). Appl Env Microbiol. 2005;71: 436–441.
View Article Google Scholar
29.Adler LS, Michaud KM, Ellner SP, McArt SH, Stevenson PC, Irwin RE. Disease where you dine: Plant species and floral traits associated with pathogen transmission in bumble bees. Ecology. 2018;99: 2535–2545. pmid:30155907
View Article PubMed/NCBI Google Scholar
30.Heinrich B. “Majoring” and “minoring” by foraging bumblebees, Bombus vagans: an experimental analysis. Ecology. 1979;60: 246–255.
View Article Google Scholar
31.Portlas ZM, Tetlie JR, Prischmann-Voldseth D, Hulke BS, Prasifka JR. Variation in floret size explains differences in wild bee visitation to cultivated sunflowers. Plant Genet Resour Characterisation Util. 2018;16: 498–503.
View Article Google Scholar
32.Braman SK, Quick JC. Differential bee attraction among crape myrtle cultivars (Lagerstroemia spp.: Myrtales: Lythraceae). Environ Entomol. 2018;47: 1203–1208. pmid:30085015
View Article PubMed/NCBI Google Scholar
33.Hernández IG, Palottini F, Macri I, Galmarini CR, Farina WM. Appetitive behavior of the honey bee Apis mellifera in response to phenolic compounds naturally found in nectars. J Exp Biol. 2019;222. pmid:30559301
View Article PubMed/NCBI Google Scholar
34.Arenas A, Kohlmaier MG. Nectar source profitability influences individual foraging preferences for pollen and pollen-foraging activity of honeybee colonies. Behav Ecol Sociobiol. Behavioral Ecology and Sociobiology; 2019;73.
View Article Google Scholar
35.Ghazoul J. Floral diversity and the facilitation of pollination. J Ecol. 2006;94: 295–304.
View Article Google Scholar
36.Hegland SJ, Boeke L. Relationships between the density and diversity of floral resources and flower visitor activity in a temperate grassland community. Ecol Entomol. 2006;31: 532–538.
View Article Google Scholar
37.Manley R, Boots M, Wilfert L. Emerging viral disease risk to pollinating insects: ecological, evolutionary and anthropogenic factors. J Appl Ecol. 2015; pmid:25954053
View Article PubMed/NCBI Google Scholar
38.Graham, James M. Interaction Effects: Their Nature and Some Post Hoc Exploration Strategies. Annual Meeting of the Southwest Educational Research Association. 2000.
39.Bates D, Maechler M, Bolker B, Walker S. Fitting Linear Mixed-Effects Models Using lme4. J Stat Softw. 2015;67: 1–48.
View Article Google Scholar
40.Hothorn T, Bretz F, Westfall P, Heiberger RM, Schuetzenmeister A, Scheibe S. simultaneous inference in general parametric models. Biometrical J. 2008;50: 346–363. Available: https://cran.r-project.org/web/packages/multcomp/citation.html
View Article Google Scholar
41.R Core Team. R: a language and environment for statistical computing. Vienna: R Foundation for Statistical Computing; 2016.
42.Richardson LL, Bowers MD, Irwin RE. Nectar chemistry mediates the behavior of parasitized bees: Consequences for plant fitness. Ecology. 2016;97: 325–337. pmid:27145608
View Article PubMed/NCBI Google Scholar
43.Manson JS, Otterstatter MC, Thomson JD. Consumption of a nectar alkaloid reduces pathogen load in bumble bees. Oecologia. 2010;162: 81–89. pmid:19711104
View Article PubMed/NCBI Google Scholar
44.Simone-Finstrom MD, Spivak M. Increased resin collection after parasite challenge: A case of self-medication in honey bees? PLoS One. 2012;7: 17–21. pmid:22479650
View Article PubMed/NCBI Google Scholar
45.Richardson LL, Adler LS, Leonard AS, Andicoechea J, Regan KH, Anthony WE, et al. Secondary metabolites in floral nectar reduce parasite infections in bumblebees. Proc R Soc London B Biol Sci. 2015;282: 20142471. pmid:25694627
View Article PubMed/NCBI Google Scholar
46.Annoscia D, Zanni V, Galbraith D, Quirici A, Grozinger C, Bortolomeazzi R, et al. Elucidating the mechanisms underlying the beneficial health effects of dietary pollen on honey bees (Apis mellifera) infested by Varroa mite ectoparasites. Sci Rep. Springer US; 2017;7: 1–13.
View Article Google Scholar
47.Chang CF, Suzuki A, Kumai S, Tamura S. Chemical Studies on “Clover Sickness”: Part II. Biological functions of isoflavonoids and their related compounds. Agric Biol Chem. 1969;33: 398–408.
View Article Google Scholar
48.Andres A, Donovan SM, Kuhlenschmidt MS. Soy isoflavones and virus infections. J Nutr Biochem. Elsevier Inc.; 2009;20: 563–569. pmid:19596314
View Article PubMed/NCBI Google Scholar
49.Graystock P, Blane EJ, Mcfrederick QS, Goulson D, Hughes WOH. Parasites and Wildlife Do managed bees drive parasite spread and emergence in wild bees ? Int J Parasitol Parasites Wildl. Elsevier Ltd; 2016;5: 64–75. pmid:28560161
View Article PubMed/NCBI Google Scholar

Добавить комментарий