Аннотация
У медоносных пчел антенны являются высокомобильными сенсорными органами, которые выражают сканирующие движения в различных поведенческих контекстах и в отношении многих стимулов, особенно запахов. Правила, лежащие в основе этих движений, до сих пор неясны. Используя систему захвата движения, мы проанализировали реакцию антенн пчел на ряд феромонов и других биологически значимых одорантов. Мы наблюдали четкие различия в реакциях антенн пчел: противоположные движения в ответ на стимулы, связанные с противоположными контекстами: медленные движения назад были выражены в ответ на феромоны тревоги, в то время как быстрые движения вперед были вызваны сигналами, связанными с пищей, а также феромонами, связанными с расплодом и королевой. Эти реакции воспроизводимы, так как подобная картина специфических реакций на запахи наблюдалась у пчел из разных колоний в разные годы. Затем мы проверили, может ли привлекательность одорантов для пчел, измеренная с помощью оригинальной установки обонятельной ориентации, предсказывать движения антенны. Однако эта простая мера валентности запахов не коррелировала ни с положением антенн, ни с показателями скорости, показывая, что в основе реакции антенн пчел на запахи лежат более сложные правила, чем простая гедонистика. Наконец, мы показали, что только что появившиеся пчелы выражают лишь ограниченные антеннальные реакции по сравнению со старыми пчелами, что позволяет предположить, что значительная часть наблюдаемых реакций приобретается в процессе развития поведения пчел.
Введение
Поведение животных являетс#11я продуктом восприятия ими стимулов окружающей среды и внутренней оценки своих физиологических потребностей. Большинство форм поведения включает движения всего животного и демонстрирует открытое отвращение или влечение к воспринимаемым стимулам (1,2,3,4). Однако изучение такого поведения иногда затруднено в лабораторных условиях и не может быть легко совмещено с ограничениями нейрофизиологических записей, таких как электрофизиология или визуализация мозга. Другие, более тонкие формы поведения включают ограниченные движения небольших частей тела. Тем не менее, они могут раскрыть важную информацию о физиологическом и эмоциональном состоянии этих животных и их положительной или отрицательной оценке воспринимаемых стимулов. Движения органов чувств, как правило, относятся к этой категории. Например, движения глаз у людей (5,6) или ушей у овец (7,8,9) и мышей (10) могут предоставить информацию о внимании и эмоциональном состоянии этих животных. Если у этих животных информационное содержание движений органов чувств представляется очевидным, то в случае беспозвоночных это менее очевидно. Тем не менее, щупальца улитки вздрагивают при запахе пищи, и эта реакция модулируется голодом (11) , предыдущим опытом улитки (12) , а также характеристиками стимула, например, его концентрацией (13). Таким образом, даже у беспозвоночных анализ движений органов чувств может обеспечить неинвазивный метод получения критической информации о восприятии стимулов, их биологическом значении для животного, а также о том, как на них влияет физиологическое состояние животного, предыдущий опыт, генетическое происхождение и т.д.
У медоносной пчелы Apis mellifera усики используются для восприятия стимулов различных сенсорных модальностей (обонятельных, вкусовых, термосенсорных, механосенсорных и т.д. (14,15,16,17,18,19). Пчелы используют свои антенны в самых разных ситуациях. Внутри улья антенны пчел позволяют им прощупывать пищу, воск или другие субстраты (20,21,22) и общаться с сородичами во время обмена пищей (23,24,25,26,27,28) или танца виляния (29) , передавая таким образом социальное подкрепление (30). Вне улья пчелы используют свои антенны во время кормежки, что позволяет им обнаруживать и изучать мультисенсорные сигналы от цветов (обонятельные, тактильные, вкусовые (31,32,33). Таким образом, антенны медоносной пчелы являются важнейшими, высокомобильными сенсорными органами, движения которых имеют большое значение для ее сенсорной экологии и поведения. Однако, какой тип информации о физиологическом состоянии пчел или их гедонистической оценке стимулов окружающей среды может содержаться в движениях антенн, в основном неизвестно.
Обоняние является важнейшей сенсорной модальностью для медоносных пчел, участвующей в большинстве этапов их жизни (34,35,36). Пчелы полагаются на обонятельные сигналы, например, для ухода за расплодом (22,37) и королевой (38,39,40,41), удаления трупов (42,43,44), защиты гнезда (45,46,47), передачи информации об источниках пищи (48) и изучения цветочных запахов во время кормежки (49). Все одоранты, участвующие в этих задачах, имеют различную биологическую ценность для пчел, а также возможные различия в привлекательности. Здесь мы задались вопросом, могут ли движения антенн медоносных пчел различаться между такими одорантами и интегрировать информацию об их биологической значимости и/или гедонистической ценности.
Обычно пчелы демонстрируют сканирующее поведение антенн в ответ на стимуляцию сахаром (инициирующую выдвижение хоботка и кормление) или на предъявление одорантов, характеризующееся размашистыми движениями антенн в направлении стимула (50,51). В предыдущем исследовании наблюдалось, что 4 различных одоранта вызывали сканирующие антеннальные реакции различной интенсивности (50). Направление антенн вперед наблюдалось для двух основных компонентов феромонов агрегации пчел (гераниол и цитраль) и для основного летучего вещества маточного молочка (октаноид, называемый каприловой кислотой), тогда как компонент феромона тревоги (изопентилацетат) не вызывал никаких изменений (50). Исходя из результатов всех этих исследований, можно предположить, что одоранты, имеющие, благодаря врожденным или приобретенным механизмам, сильное положительное значение для пчел, вызывают сильную антеннальную реакцию. Однако, чтобы сделать вывод, не хватает более комплексного исследования, основанного на большей панели одорантов с различной биологической ценностью для пчел. Для решения этого вопроса мы использовали недавно разработанную технику, основанную на принципе захвата движения, для мониторинга движений антенн с высокой частотой (52). Мы проанализировали изменения в положении и скорости движения антенн в ответ на панель из 15 общих и феромональных одорантов, сильно различающихся по биологической ценности для пчел. Кроме того, мы разработали высокопроизводительный анализ обонятельной ориентации для измерения привлекательности каждого одоранта для пчел и сравнили эту меру валентности одорантов с реакцией антенн пчел. Наконец, чтобы понять онтогенез этих движений антенн, мы измерили вызванные запахом антеннальные реакции у только что появившихся пчел.
Результаты
Антеннальная реакция на одоранты
Для наблюдения за движениями антенн у запряженных медоносных пчел над головой пчелы была установлена система слежения на основе камеры, использующая принцип захвата движения (рис. 1A). Верхние стороны кончиков антенн пчел были помечены маленькими точками красной акриловой краски, которые отслеживались системой на частоте 90 Гц. Антенны пчел очень подвижны и могут перемещаться вокруг своего гнезда (далее называемого «основанием антенны») от передней части головы к задней с каждой стороны (перемещаясь под углом ~ 180°). Поэтому положение каждого кончика антенны лучше всего описывать с помощью полярных координат, т.е. с помощью радиуса (r) и угла (θ), центром которого является основание антенны (рис. 1B). Радиус r определялся как расстояние между кончиком и основанием антенны, а угол θ измерялся от передней (0°) до задней части пчелы (180°) через ипсилатеральную сторону (90°). Угловая скорость (Vθ) рассчитывалась как угол θ перемещения за единицу времени (°/с). Процесс обонятельной стимуляции длился 40 с. После 15 с воздушного потока без запаха подавался 5 с стимул с запахом. Медоносные пчелы получали стимуляцию панелью из 15 одорантов, отобранных с учетом их разнообразия с точки зрения источников эмиссии (феромоны, испускаемые различными членами улья и/или выделяемые в противоположных контекстах) и возможной биологической ценности для пчел (цветочные, фекальные, см. таблицу 1). Пчелы показали большое разнообразие антеннальных реакций на представленные одоранты. Средние ответы на два замечательных одоранта и воздушный контроль показаны на рис. 1С,D (N = 24 пчелы). В то время как антенны пчел двигались вперед (рис. 1С) и увеличивали свою скорость (рис. 1D) при предъявлении соединения маточного молочка — октановой кислоты, они двигались назад (рис. 1С) и медленнее (рис. 1D) в ответ на защитное соединение 2-гептанон. Для сравнения, радиус (r) не сильно менялся во время стимуляции одорантами (Suppl. Fig. S1).
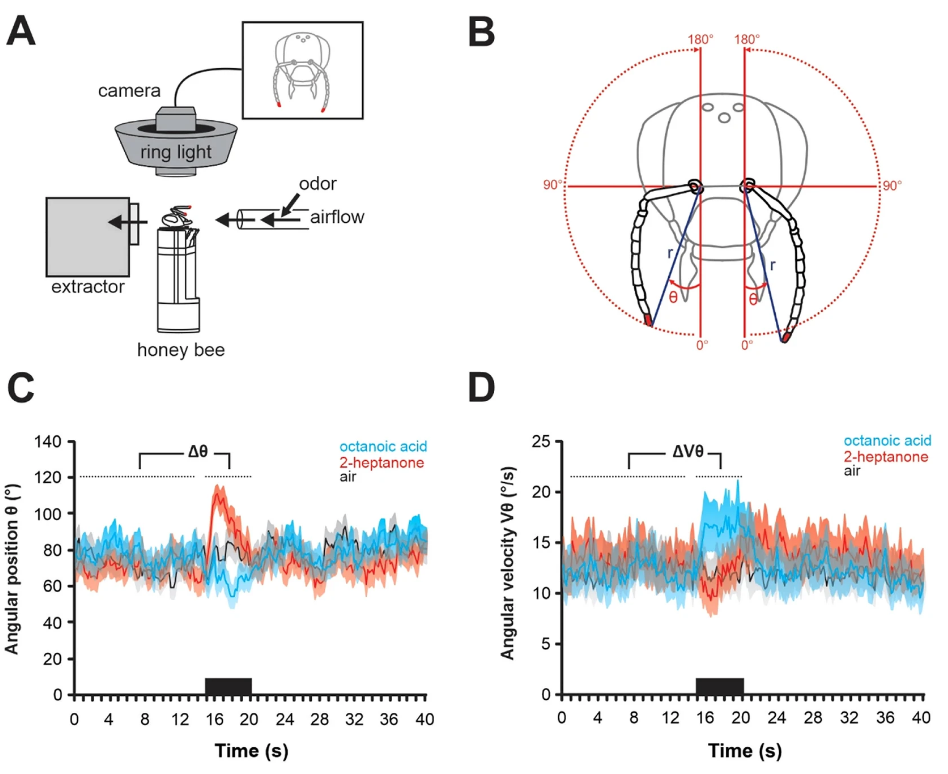
Чтобы сравнить реакции пчел на различные стимулы, мы вычислили Δθ и ΔVθ, определяемые как разница в среднем угловом положении и скорости между 5 с во время и 15 с до предъявления одоранта (рис. 2A,B, N = 24 пчелы). Пятнадцать одорантов в нашей панели вызывали широкий диапазон антеннальных ответов между двумя конкретными случаями, показанными на рис. 1С,D. Соответственно, мы обнаружили значительный эффект стимула как для угла (рис. 2A, Δθ: RM-ANOVA, F15,345 = 4,45, p < 0,001), так и для скорости (рис. 2B, ΔVθ, RM-ANOVA, F15,345 = 5,32, p < 0,001). Что касается угла, антенны значительно отклонились назад (относительно воздушного контроля) в ответ на 2-гептанон (тест Даннетта, p < 0,05) и значительно вперед в ответ на октановую кислоту (p < 0,05). Что касается скорости, антенны пчел двигались значительно быстрее в ответ на октановую кислоту (p < 0,001), метил линолеат (p < 0,05), феромон мандибулярной королевы (QMP; p < 0,001) и цветочное соединение октанал (p < 0,001). Единственным одорантом, который вызывал снижение скорости, был 2-гептанон, но он существенно не отличался от контроля (воздух, p = 0,835).
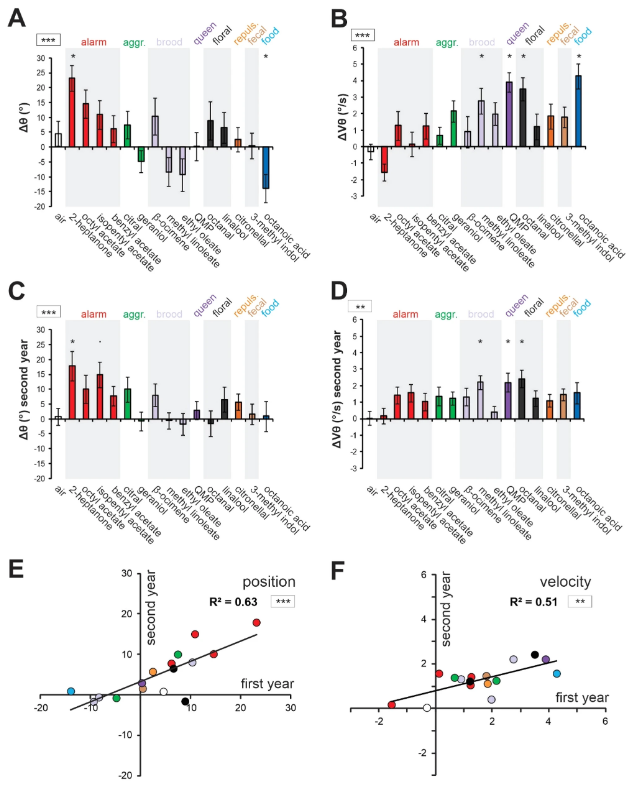
Таким образом, различные одоранты вызывали различные антеннальные реакции у взрослых рабочих медоносных пчел. Далее мы задались вопросом, насколько воспроизводимы наблюдаемые реакции, протестировав ту же панель из 15 одорантов на рабочих из другой колонии на следующий год (рис. 2C,D). И снова мы обнаружили значительный эффект стимула для угла (рис. 2C, Δθ: RM-ANOVA: F15,360 = 2.87, p < 0.001), с таким же значительным движением назад в ответ на 2-гептанон (p < 0.01), и тенденцией к аналогичному движению назад для другого сигнального соединения, изопентилацетата (p = 0.0502). Примечательно, что на второй год мы наблюдали менее многочисленные движения антенн вперед. Мы также обнаружили значительный эффект стимула для скорости движения антенн (рис. 2D; ΔVθ: RM-ANOVA, F15,360 = 2.20, p < 0.01), и, как и в первый год, значительное увеличение скорости на октанал (p < 0.01), QMP (p < 0.05) и метил линолеат (p < 0.05). На этот раз сильного, ускоренного движения вперед к октановой кислоте не наблюдалось.
Несмотря на несколько наблюдаемых различий, ответы антенн на одоранты значительно коррелировали между двумя годами, как по углу (рис. 2E, корреляция Пирсона, R2 = 0,63, p < 0,001), так и по скорости (рис. 2F, R2 = 0,51, p < 0,01). Мы не обнаружили влияния года ни для угла (эффект года, F1, 47 = 0,27, p = 0,60), ни для скорости (F1, 47 = 0,78, p = 0,38). Однако для скорости наблюдалось взаимодействие между стимулом и годом (F15, 705 = 2,07, p = 0,010), что можно объяснить тем, что на второй год различия в скорости между одорантами были менее заметны, чем на первый (рис. 2B, D).
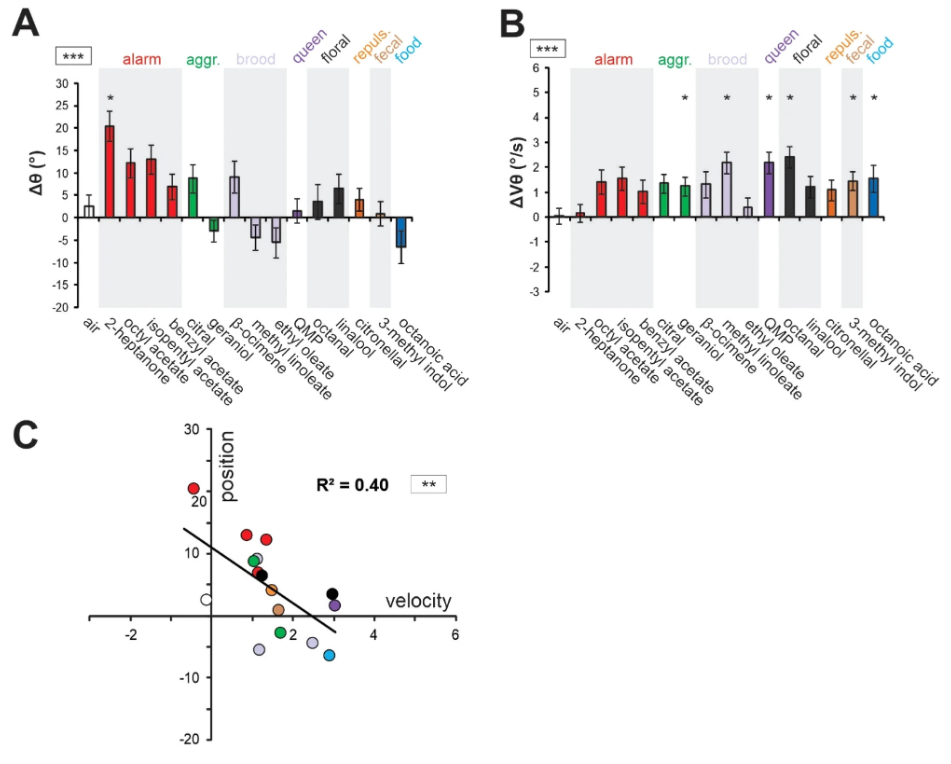
Из-за высокой корреляции между наборами данных за два года они были объединены для дальнейшего анализа. Полученный объединенный набор данных сохранил сильные эффекты стимула как для угла (рис. 3A, RM-ANOVA; эффект стимула: F15, 360 = 2,87, p < 0,001), так и для скорости (рис. 3B, RM-ANOVA; эффект стимула: F15, 360 = 2,20, p < 0,01). Затем мы проанализировали связь, существующую между изменениями углового положения и скорости в ответ на одоранты. Мы обнаружили значительную отрицательную корреляцию между Δθ и ΔVθ (рис. 3C; корреляция Пирсона, R2 = 0,40, p < 0,01), предполагая, что в целом одоранты, которые приводили антенны вперед, также увеличивали их скорость, и наоборот, одоранты, которые приводили антенны назад, имели тенденцию замедлять их.
Привлекательность запахов
Далее мы задались вопросом, связаны ли движения антенн медоносных пчел с их гедонистической оценкой запахов. Чтобы ответить на этот вопрос, мы разработали высокопроизводительный анализ для измерения привлекательности каждого одоранта и измерили движения около 800 пчел в темноте, каждая из которых сталкивалась с одним из наших стимулов. Установка состояла из отдельных стеклянных трубок диаметром 45 см, на одном конце которых находилась маленькая коробочка с пчелой, а на другом — маленькая коробочка с фильтровальной бумагой с определенным одорантом (или контролем) (рис. 4A). Вдоль трубки были расположены три равноудаленных друг от друга автоматических инфракрасных световых портала (Trikinetics, Walham, MA, США, см. методы). Движения пчелы через три портала отслеживались в течение 10 минут, и индекс ориентации (OI) рассчитывался по количеству проходов через мониторы:
OI =(M3-M1)/(M3+ M1)
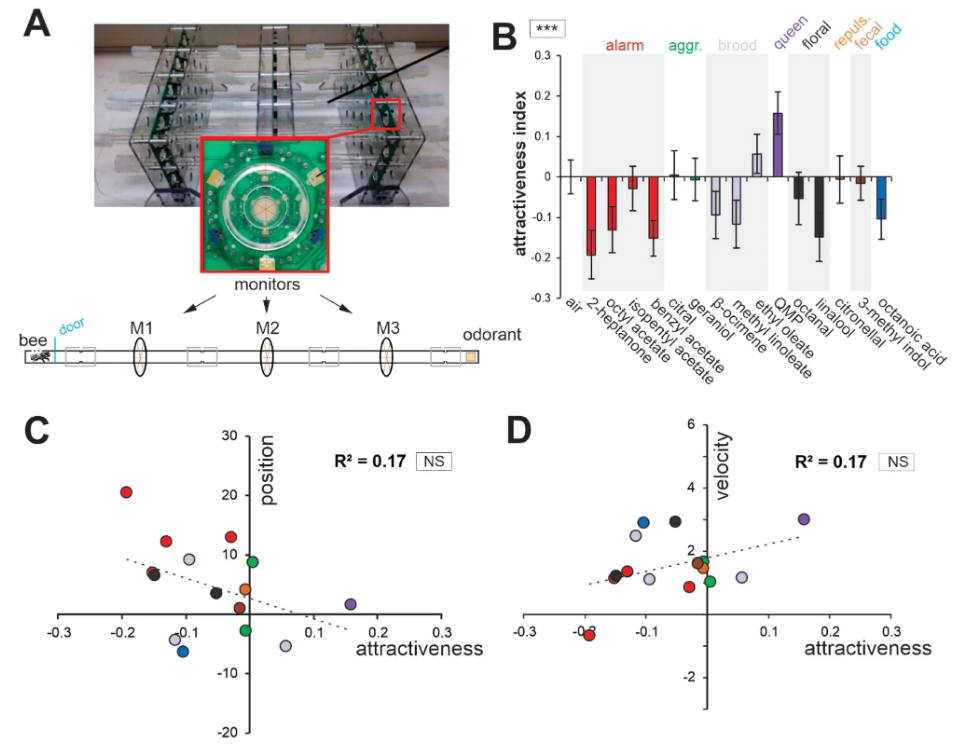
M1 — монитор, расположенный ближе к исходному положению пчелы, а M3 — монитор, расположенный ближе к коробке с запахом. Контрольной группе была представлена коробка без запаха. Чтобы измерить относительную привлекательность и отталкивание каждого одоранта, средний индекс ориентации пустой контрольной группы вычитался из индекса ориентации каждого одоранта. Таким образом, положительный индекс привлекательности (AI) указывал на привлекательный запах, а отрицательный индекс — на отталкивающий запах (рис. 4A). В соответствии с широко различающимися источниками и предполагаемой биологической ценностью наших одорантов (см. табл. 1), мы наблюдали значительную неоднородность в ИИ различных одорантов (рис. 4B: ANOVA; эффект стимула: F14, 600 = 2,71, p < 0,001). Только два запаха, выделяемые королевой и выводком, показали положительный индекс привлекательности: QMP и этил олеат. Агрегационное феромонное соединение гераниол вызывало лишь слабую привлекательность. Остальные одоранты были нейтральными или действовали отталкивающе.
Затем мы построили график двух переменных движений антенн, Δθ и ΔVθ, в зависимости от значений привлекательности (рис. 4C,D). Слабые тенденции, казалось, проявились: привлекательность одорантов способствовала более быстрым движениям антенн вперед. Однако, возможно, из-за ограниченного числа одорантов, мы не обнаружили значительной корреляции между AI и Δθ (рис. 4C, корреляция Пирсона, R2 = 0,17, p = 0,124) или между AI и ΔVθ (рис. 4D, R2 = 0,17, p = 0,126). Обратите внимание, что этот результат был таким же, когда использовался только набор данных по движению антенн первого года (Δθ vs AI: R2 = 0,15, p = 0,14; Δθ vs AI: R2 = 0,19, p = 0,10) или только набор данных по антеннам второго года (Δθ vs AI: R2 = 0,16, p = 0,14; Δθ vs AI: R2 = 0,07, p = 0,34). Мы пришли к выводу, что движения антенн медоносной пчелы на одоранты не могут быть напрямую предсказаны простой мерой привлекательности одоранта.
Влияние концентрации на антеннальные реакции
Далее мы задались вопросом, как количество одоранта влияет на антеннальные реакции и показатели привлекательности. Поскольку почти для всех стимулов использовался один и тот же объем чистого одоранта, абсолютная концентрация в воздушном потоке зависела от давления его паров, которое было разным у разных одорантов (рис. S2A). Действительно, мы обнаружили, что положение антенны (Δθ) значительно коррелирует с давлением паров одорантов, т.е. более летучие одоранты (с более высоким давлением паров и, соответственно, представленные в более высокой концентрации), как правило, вызывают движения антенны назад (Suppl. Fig. S2B, Δθ vs VPlog, корреляция Пирсона, R2 = 0,63, p < 0,01). Напротив, ни скорость движения антенны (Suppl. Fig. S2C, ΔVθ vs VPlog, R2 = 0,20, NS), ни привлекательность не коррелировали с давлением паров одорантов (Suppl. Fig. S2D, AI vs VPlog, R2 = 0,04, NS). Основываясь на этих наблюдениях, мы проверили, как концентрация одоранта может влиять на движения антенны. Мы выбрали три одоранта, которые вызывали заметные изменения в движениях антенн в предыдущих экспериментах: защитное соединение 2-гептанон, агрегационное соединение гераниол и одорант маточного молочка — октановая кислота (рис. 5). Они были представлены пчелам в восьми различных концентрациях от 10-7 до 100, в порядке возрастания.
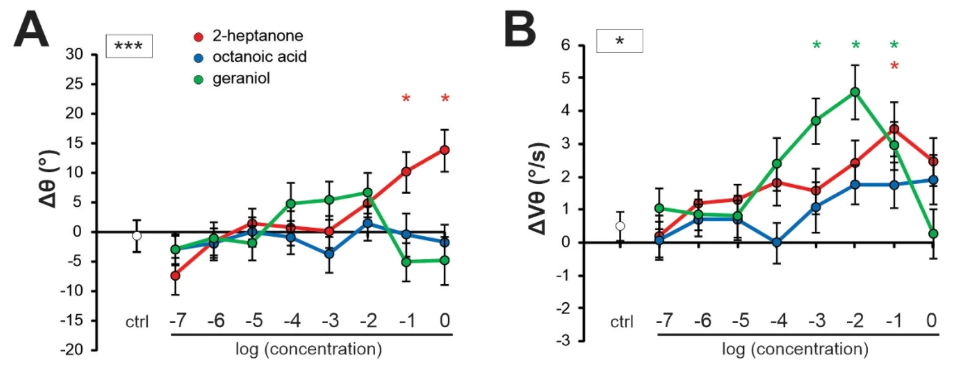
Мы наблюдали очень разные эволюции ответов антенн на три одоранта в зависимости от концентрации. Что касается положения антенны (Δθ), мы обнаружили значительный общий эффект стимула (RM-ANOVA, F2,82 = 3.45, p < 0.05), концентрации (F7,287 = 2.24, p < 0.05) и значительное взаимодействие между обеими переменными (F14, 574 = 3.25, p < 0.001). Аналогично, для скорости антенны наблюдался значительный эффект стимула (RM-ANOVA, F2, 82 = 5.46, p < 0.01), концентрации (F7,287 = 5.59, p < 0.001) и значительное взаимодействие (F14, 574 = 1.98, p < 0.05). Анализируя каждый одорант отдельно, мы обнаружили, что положение антенн значительно изменялось в зависимости от концентрации 2-гептанона (рис. 5A; эффект концентрации: F8, 336 = 5,26, p < 0,001), со значительными различиями с контролем при двух самых высоких концентрациях (тест Даннетта: 100 p < 0,01; 10-1 p < 0,05). Положение антенн также значительно изменялось в зависимости от концентрации гераниола (F8, 336 = 2,15, p < 0,05), но существенных различий по сравнению с контролем не было. Концентрация октановой кислоты не влияла на положение антенн (F8,336 = 0,31, NS). Антеннальная скорость значительно изменялась в зависимости от концентрации 2-гептанона (рис. 5B; эффект концентрации: F8,336 = 2,55, p < 0,05), со значительным отличием от контроля при концентрации 10-1 (тест Даннетта: p < 0,01). Антеннальная скорость также значительно изменялась в зависимости от концентрации гераниола (F8,336 = 5,86, p < 0,001), со значительными различиями с контролем при концентрациях 10-3 (p < 0,01) и 10-2 (p < 0,001) и тенденцией при 10-1 (p = 0,051). Влияние концентрации октановой кислоты на антеннальную скорость отсутствовало (F8,336 = 1.49, NS). Мы пришли к выводу, что концентрация одорантов влияет на движения антенн.
Антеннальные реакции у только что появившихся пчел
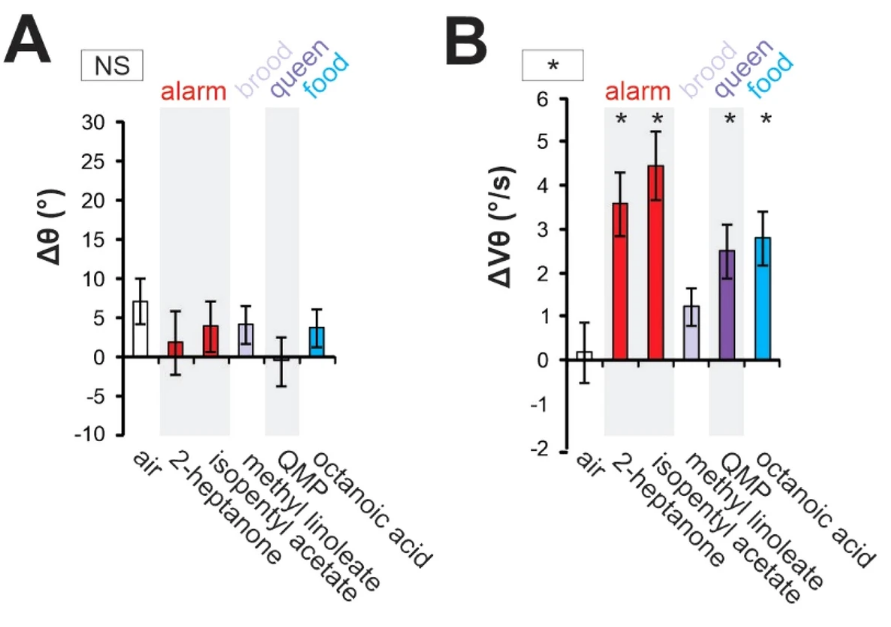
Для дальнейшей оценки возможности того, что антеннальные реакции на одоранты приобретаются в течение взрослой жизни пчел, мы проанализировали их у только что появившихся пчел. Пчел, вышедших из ячейки гребня в последние 24 часа, стимулировали, наряду с воздушным контролем, пятью обонятельными стимулами, которые в предыдущих экспериментах вызывали контрастные реакции у старых пчел: два феромона тревоги/обороны (2-гептанон, изопентилацетат), один феромон расплода (метил линолеат), феромон матки (QMP) и запах маточного молочка (октановая кислота). Изменения углового положения (Δθ) и скорости (ΔVθ), зарегистрированные во время стимуляции одорантами, представлены на рис. 6. Вновь появившиеся пчелы не ориентировали антенны в ответ на различные одоранты, поскольку для Δθ не было выявлено контраста между стимулами (эффект стимула: F5, 120 = 0,81, NS). Однако вновь появившиеся пчелы усиливали движения антенн при предъявлении одорантов, причем для ΔVθ наблюдалась значительная неоднородность среди стимулов (эффект стимула: F5, 120 = 7,54, p < 0,001). Почти все протестированные одоранты вызывали увеличение скорости (2-гептанон, изопентилацетат, октановая кислота, QMP; тесты Даннетта, p < 0,05; исключение метил линолеат, NS).
Обсуждение
В этом исследовании мы наблюдали специфические для запаха движения антенн на ряд феромонов и общих одорантов с различной биологической ценностью для медоносных пчел. Реакции пчел, зарегистрированные в двух колониях в два разных года, коррелировали между собой, показывая, что антеннальные реакции на одоранты воспроизводимы. В целом, вызванные одорантами изменения в положении антенн и скорости их движения коррелировали, так что чем больше антенны были выдвинуты вперед, тем быстрее они двигались. Создавая оригинальную установку для обонятельной ориентации, мы наблюдали четкие различия в привлекательности тестируемых одорантов для пчел. Однако привлекательность одорантов, измеренная в нашей установке, не коррелировала значимо ни с положением антенн, ни с показателями скорости. Наконец, мы показали, что антеннальные реакции недавно появившихся пчел ограничены по сравнению со старыми пчелами. Хотя испытанные одоранты вызывали ускорение движений антенн, как у старых пчел, они не приводили к изменению положения антенн.
Мы включили в наши эксперименты несколько одорантов, которые были протестированы в предыдущих записях движений антенн (50,51). В работе Erber et al. (1993) (50) движения антенн пчел регистрировались с помощью двух фотодиодов, каждый из которых располагался перед одной из антенн пчел (под углом примерно 45° в нашей системе координат, см. рис. 1B). Антеннальный ответ» в данном исследовании соответствовал повышенной частоте пассажей антенн на диоды во время презентации запаха. Пчелы «реагировали» на гераниол и цитраль (компоненты феромона агрегации) и на октановую кислоту (в дальнейшем называемую каприловой кислотой, основной летучий компонент маточного молочка), но не на изопентилацетат (феромон тревоги). В этой предыдущей работе, однако, не было возможности узнать, держат ли пчелы свои антенны более выдвинутыми вперед и/или увеличивают ли они скорость сканирования антенн во время ответа. Использование системы с камерой в нашем исследовании позволило разделить эти эффекты. В соответствии с данными Erber et al. (1993) (50), октаноиновая кислота, полученная в наших записях, ускоряла движения вперед. Цитраль и гераниол немного увеличивали скорость движения антенны (около 1°/с), даже если они вызывали контрастные изменения в положении антенны (рис. 3A,B). Наконец, изопентилацетат хотя и вызывал увеличение скорости движения антенн (рис. 3B), но сильно отводил антенны к задней части головы пчел (рис. 3A), что объясняет отсутствие реакции в работе Erber et al. (1993) (50). Мы признаем, что, как и ранее описанные системы (51,53,54), наши записи были сосредоточены на измерении движений антенн в поперечной плоскости головы пчелы, таким образом, в двух измерениях. Этот неизменный выбор в исследованиях движений антенн обусловлен тем, что большинство движений антенн пчел происходит в этой плоскости. Поэтому мы уверены, что изменения в движении антенн, наблюдаемые в настоящем исследовании, представляют собой заметную и значимую часть поведения антенн пчел во время сканирования запаха. Разработка стратегии трехмерной записи с использованием двух или более систем захвата движения, размещенных вокруг головы пчелы, и временной синхронизации их потоков данных возможна, и некоторые недавние усилия были предприняты в этом направлении (55).
Благодаря использованию широкого набора одорантов, мы показали, что одоранты вызывают различные антеннальные реакции, как с движениями вперед и назад, так и с увеличением и уменьшением скорости. Интересно, что изменения положения и скорости в ответ на одоранты коррелировали (рис. 3C), а антеннальные реакции пчел можно было разделить на две группы: быстрые движения вперед и медленные движения назад. Возможно, что наблюдаемая корреляция между положением и скоростью является чисто механической и связана со строением мышц антенн пчел. Если принять во внимание известную биологическую ценность этих одорантов для пчел, выявились интересные общие тенденции. В то время как медленные движения назад были в основном выражены в ответ на феромоны тревоги/обороны (см. красные точки на рис. 3C), особенно на 2-гептанон, быстрые движения вперед вызывали скорее запахи, связанные с пищей (октановая кислота, запах маточного молочка, синий, и октанал, серый), феромонные компоненты, связанные с сигнализацией о ценных ресурсах (гераниол, компонент феромона агрегации, зеленый), а также социальные сигналы, такие как феромоны расплода и королевы (светло- и темно-фиолетовый, рис. 3C). Из этих правил были некоторые исключения, например, зарегистрированная обратная реакция антенн на цитраль (компонент феромона агрегации) или β-оцимен (летучее соединение феромона выводка). Аналогично, некоторые одоранты с сильным предполагаемым биологическим значением, например, фекальное соединение 3-метил-индол (скатол), не вызывали сильных антеннальных реакций. При этом быстрые движения вперед на запахи, связанные с пищей, согласуются с результатами предыдущих исследований, показавших, что сахароза или запахи, ранее ассоциировавшиеся с сахарозой, вызывают движения антенны вперед (50,52,56,57,58). Такие антеннальные реакции являются частью связанных с пищей поведенческих процедур, наряду с выдвижением хобота. С другой стороны, медленные/направленные назад движения антенн на сигнальные/защитные соединения, по-видимому, соответствуют оборонительному контексту, где реакция на аппетитные стимулы имеет второстепенное значение, а защита важных органов чувств, таких как антенны, может быть более целесообразной. Кроме того, сильная обратная реакция на 2-гептанон каким-то образом согласуется с его использованием пчелами в качестве отпугивающего средства для маркировки истощенных цветов (59,60).
Очевидно, что количество одоранта влияет на реакцию антенн, поскольку положение антенн (но не скорость) изменялось в зависимости от давления паров одоранта. При тестировании трех одорантов в восьми различных концентрациях мы обнаружили, что и положение, и скорость менялись в зависимости от концентрации одоранта. Антеннальный ответ обычно начинался при концентрации 10-3, что соответствует концентрации, при которой в антенной доле наблюдается четкая нейронная активность, вызванная запахом, в экспериментах по оптической визуализации (61,62,63). Интересно, что антеннальные ответы не просто монотонно увеличивались с ростом концентрации. Примечательно, что антеннальный ответ пчел на гераниол был сильнее при средней концентрации, чем при высокой. Возможно, это связано с известным дозозависимым влиянием феромонов на поведение (64,65,66,67) и с тем, что в естественных ситуациях феромоны используются в определенном диапазоне концентраций. Поэтому возможно, что данные концентрации лучше всего вызывают феромональное значение одорантов для пчел и поэтому вызывают более сильные антеннальные реакции, чем более высокие концентрации. В любом случае, концентрация одоранта влияла на амплитуду ответа, но не на его направление. Мы не наблюдали противоположных реакций (вперед/назад или медленнее/быстрее) на один и тот же одорант при разных концентрациях.
Противоположное влияние феромонов с разной биологической ценностью на движения антенны, наблюдаемое в наших экспериментах, примечательно в контексте текущих дебатов о поведенческих побочных эффектах феромонов. Все чаще высказывается предположение, что феромоны, как у насекомых, так и у млекопитающих, могут действовать как модуляторы разнообразных поведенческих реакций, которые не являются основными — известными — целями их действия (68,69). У медоносных пчел некоторые компоненты феромона тревоги снижают реакцию пчел на аппетитную награду, такую как сахароза (69), и негативно влияют на показатели аппетитного обучения (67,70,71,72). И наоборот, компонент феромона агрегации, обычно ассоциирующийся с аппетитным поведением, как было показано, снижает реакцию на вредный стимул, такой как электрический шок (73) , и улучшает аппетитное обучение (72). Модель, разработанная на основе этих результатов, предполагает, что феромоны — или одоранты с сильно врожденной ценностью — модулируют внутреннее состояние пчел относительно двух основных модулей, аппетитного и аверсивного («оборонительные и аппетитные оценки » (73). Он классифицирует феромоны в четкие категории по общему гедонистическому измерению: феромоны тревоги имеют отрицательную («оборонительную») ценность, а феромоны агрегации (или цветочные одоранты) — положительную («аппетитную») ценность. Соответственно, феромоны тревоги снижают аппетитную оценку, а феромоны агрегации — оборонительную. Наблюдаемые нами контрастные реакции антенн могут быть поведенческими подсказками для существования таких противоположных значений одорантов. Мы попытались уловить такое гедонистическое измерение в наших одорантах, измеряя их привлекательность для пчел в установке обонятельной ориентации (рис. 4). Однако коэффициенты корреляции между индексами привлекательности и переменными движения антенны не были значительными (p = 0,12 для угла и скорости), даже если эти данные указывают на возможную тенденцию: привлекательные одоранты больше соответствуют быстрым и прямым движениям антенны. Возможно, включение большего количества одорантов в будущие исследования могло бы обеспечить большую статистическую мощность для демонстрации связи между обеими переменными. Заметим, однако, что реальная ситуация сложнее простой гедонистической модели, представленной выше, поскольку не все феромональные компоненты данного типа оказывают одинаковое влияние на поведенческие реакции. Например, 2-гептанон, но не изопентилацетат влияет на реакцию на сахарозу (69), тогда как изопентилацетат, но не 2-гептанон, влияет на реакцию на электрический шок (73). Аналогично, в наших данных феромон расплода β-оцимен приводил антенны назад, в то время как другие феромоны расплода (этил олеат и метил линолеат) приводили их вперед (рис. 3А). Таким образом, оценка пчелами одорантов может быть лучше всего описана более чем одним простым измерением, поскольку каждый из них передает различные сообщения, обычно представленные в определенном контексте.
Мы оценили воспроизводимость антеннальных реакций на одоранты, измерив их на пчелах из разных ульев в разные годы. Мы обнаружили четкую корреляцию между данными двух лет, как по положению антенн, так и по их скорости. Этот результат может указывать на то, что некоторые из этих реакций (в частности, на феромоны) являются врожденными. Однако наши наблюдения указывают на большую важность опыта пчел. В то время как некоторые одоранты вызывали очень похожие реакции в оба года, другие вызывали значительно отличающееся поведение. Октановая кислота, например, вызывала сильные движения вперед и ускоренные движения в первый год, но только слабые реакции во второй год. Это указывает на эффект опыта, который мы продемонстрировали в предыдущем исследовании, где одоранты, ассоциирующиеся с пищей, внезапно вызывали быстрые движения антенн вперед (52). На самом деле, обнаружение одинакового паттерна специфических ответов на запах в течение двух лет не является доказательством того, что антеннальные ответы являются врожденными, поскольку наблюдаемые паттерны могут быть просто результатом того, что наши одоранты были связаны с аналогичными контекстами и последствиями в течение жизни этих двух групп пчел. Чтобы понять онтогенез этих реакций, вызванных запахом, мы регистрировали движения антенн у только что появившихся пчел. Мы обнаружили довольно ограниченные реакции антенн в этом возрасте, особенно в отношении изменения углового положения. Это говорит о том, что специфические для запаха движения антенн приобретаются пчелами в течение их взрослой жизни. Это может быть связано с неполным созреванием их антеннальных двигательных способностей при появлении, но также может быть связано с их поведенческим развитием в контексте возрастного полиэтизма пчел. Интересно, что вновь появившиеся пчелы не демонстрировали специфических медленных движений назад на феромоны тревоги, характерных для старых пчел. Это согласуется с тем, что агрессивность пчел и их реакция на феромоны тревоги увеличивается с возрастом (74), параллельно онтогенезу оборонительного поведения (75,76). Такое развитие поведения сопровождается изменениями в титрах биогенных аминов и гормонов (77,78,79). Например, уровни ювенильного гормона и октопамина увеличиваются с возрастом (80,81,82). Роль биогенных аминов, в частности, подтверждается тем, что октопамин и серотонин оказывают противоположное влияние на движения антенн, увеличивая и уменьшая их соответственно (58). Таким образом, часть обнаруженного нами возрастного эффекта может быть связана с различиями в уровнях этих биогенных аминов. Таким образом, наше исследование дает некоторое представление о влиянии возраста на вызванные запахом движения антенн, но еще один аспект, который было бы чрезвычайно интересно изучить, — это влияние задач, выполняемых пчелами. Поскольку молодые особи выполняют задачи внутри колонии, в то время как старые особи занимаются делами за пределами улья, можно считать, что наши эксперименты описывают два конца спектра задач нормальной колонии. Однако будущие эксперименты должны разделить влияние возраста и задачи на реакцию антенн на запахи и феромоны, связанные с задачей.
Различные одоранты вызывают различные движения антенн в зависимости от их биологической ценности для пчел. Это, наряду с наблюдением, что движения антенн изменяются в результате ассоциативного обусловливания (52) , позволяет предположить, что движения антенн находятся под центральной нисходящей модуляцией. Движения антенн контролируются различными группами мышц, двигающими усики антенн (4 мышцы) и жгутик (2 мышцы). Моторные нейроны, контролирующие эту мышечную систему, берут начало в АМКЦ (антенный механосенсорный и моторный центр) (83,84,85,86). Реакция на тактильные стимулы, как полагают, использует короткий путь, поскольку механосенсорные нейроны проецируются непосредственно в АМК (83). Реакция антенн на обонятельные стимулы, напротив, должна идти более длинным путем. Запахи обнаруживаются обонятельными сенсорными нейронами в антенне, которые передают информацию о запахе в первичный обонятельный центр — антеннальную долю (АЛ), состоящую из гломерул, каждая из которых получает вход от OSNs (обонятельных сенсорных нейронов), выражающих один и тот же тип обонятельных рецепторов. АЛ обрабатывает обонятельную информацию, а нейроны второго порядка (проекционные) передают ее в мозговые центры более высокого порядка — грибовидные тела (МБ) и боковые рога (БР). Феромонные соединения медоносной пчелы (тревога, агрегация, расплод, королева и т.д.) вызывают комбинаторную активность многих гломерул в антеннальной доле рабочего (87,88). Это позволяет предположить, что их биологическая ценность извлекается в центрах более высокого порядка (89). Действительно, было показано, что проекции от AL к LH медоносной пчелы содержат комбинаторную информацию, позволяющую различать различные типы феромонов (90). ЛГ рассматривается как премоторный центр, опосредующий быстрые и врожденные реакции на биологически значимые стимулы, и может отвечать за врожденные движения антенн на запахи. Прямые связи между ЛГ и АМК пока не описаны у медоносных пчел, но они известны у плодовых мушек (91,92). Изменения в вызванных запахом антеннальных реакциях под влиянием опыта (как после ассоциативного обусловливания) вовлекают MB, центр обучения и памяти мозга насекомых. В MB клетки Кеньона (КК) обладают высокой специфичностью к запахам и активируются комбинаторным входом от многих различных PNs (93). Информация от КК считывается нейронами МВ-выхода, которые проецируются на различные части протоцеребрума, включая ЛГ. MB-выходные нейроны пластичны, и их ответы, вызванные запахом, изменяются под влиянием опыта (94,95,96,97). Некоторые из них, например, нейрон PE1, проецируются на LH (95,98) и могут быть ответственны за модуляцию движений антенны, вызванных запахом, через эту структуру. Насколько нам известно, прямых связей выходных нейронов МБ с АМК не описано (98) , но возможны непрямые пути, кроме как через ЛГ.
В заключение следует отметить, что медоносные пчелы демонстрируют целый ряд различных антеннальных реакций на запахи, которые варьируются в зависимости от биологической ценности запахов. Эти реакции воспроизводимы, что позволяет предположить, что они отчасти врожденные, но также формируются под влиянием опыта пчел и развиваются в течение их жизни. Необходимость нашего подхода, но, тем не менее, явное ограничение заключается в том, что ответы пчел регистрировались в экспериментальном контексте, совершенно отличном от естественных ситуаций. У других насекомых было показано, что социальный контекст, в частности, модулирует поведенческие реакции на обонятельные стимулы (99,100). Например, реакция антенн пчел на феромоны тревоги может быть совершенно иной, когда они охраняют вход в улей. Таким образом, следующим шагом должен стать анализ движений антенн в более естественных, ульевых, ситуациях.
STAR★методы
Материалы, использованные в данной статье, перечислены в таблице 2.
Контакт для обмена реагентами и ресурсами
Дополнительная информация и запросы на ресурсы, данные и реагенты должны быть направлены и будут выполнены ведущим контактным лицом, Жаном-Кристофом Сандозом (sandoz@egce.cnrs-gif.fr) и Ханной Шоле (hanna.chole@gmail.com).
Экспериментальная модель и данные об испытуемых
Эксперименты проводились на взрослых рабочих особях медоносных пчел (Apis mellifera), отловленных у входа в улей в кампусе CNRS в Жиф-сюр-Иветт (Франция) в апреле-мае 2015 и 2016 годов. Только что появившиеся пчелы, использованные в последнем эксперименте (рис. 6), были пойманы утром в день эксперимента при выходе из расплодного гребня, помещенного накануне в инкубатор (при температуре 35 °C). Пчел охлаждали на льду до тех пор, пока они не переставали двигаться, чтобы закрепить их по отдельности в пластиковых держателях, оставив свободными антенны и ротовые органы. Затем их кормили 5 мкл раствора сахарозы (50% масс.) за 4 ч до начала экспериментов. После кормления на кончики усиков пчел наносили каплю краски на водной основе (Posca PC-5 M, Mitsubishi Pencil Co.). Пчел помечали на верхней поверхности двух последних жгутиков, чтобы система захвата движения могла записать их координаты (см. ниже), не нарушая обонятельного восприятия (52). После установки, кормления и маркировки особей помещали во влажный, темный полистироловый ящик до начала экспериментов.
Детали метода
Аппарат для наблюдения за антенной
Аппарат для записи состоял из камеры, расположенной над держателем пчел (рис. 1А). Камера включала встроенную плату обработки, позволяющую адаптивное обнаружение (с помощью алгоритма предсказания движения) двух цветных точек с частотой до 120 Гц (BIPcam, Brain Vision Systems). Камера отслеживала и записывала координаты цветных точек на кончиках антенн в реальном времени с частотой 90 Гц. Для того чтобы оптимизировать обнаружение цветных точек, аппарат был помещен в комнату с низкой освещенностью (контролируемой и поддерживаемой постоянно). Вокруг объектива камеры было установлено кольцо для подсветки холодным светом, рассеивающее однородный белый свет на голову пчелы (Leica CLS 150XE, Leica, Jena, Германия). Интенсивность источника света была точно настроена и поддерживалась постоянной в течение всего эксперимента.
Аппарат для обонятельной стимуляции обеспечивал постоянный поток воздуха 52,5 мл/с. Этот поток, состоящий из основного потока воздуха 50 мл/с и вторичного потока 2,5 мл/с, направлялся к пчеле через стеклянную трубку (диаметром 0,5 см) на расстоянии 2 см. Вторичный поток воздуха мог быть направлен в один из двух подконтуров (один содержал источник одоранта, а другой — без одоранта) перед повторным впрыскиванием в основной поток воздуха. Большую часть времени воздух проходил через подконтур без запаха. Обонятельную стимуляцию проводили вручную, вызывая переключение вторичного потока на подконтур с запахом на 5 с. Подконтур с запахом включал пипетку Пастера с источником запаха (см. ниже). Другой контур включал идентичную пипетку Пастера без одоранта. Вытяжка воздуха, размещенная за пчелой, предотвращала накопление одоранта.
Анализ движения антенн
Перед началом записи каждую пчелу оставляли на 20 с для акклиматизации к аппарату. Каждая запись длилась 60 с. В каждый момент времени (90 раз в секунду) аппарат регистрировал расположение двух кончиков антенн каждой пчелы на матрице камеры (координаты пикселей). Сначала все записи от всех пчел были пересчитаны в одну и ту же систему координат (x,y), в которой гнездо правой антенны является началом координат (координаты 0,0), а гнездо левой антенны — единицей отсчета по оси x (координаты 1,0). Таким образом, каждая запись давала серию координат (x,y) для каждой антенны на каждом временном шаге (1/90 с). Это позволило сравнить движения антенн разных пчел.
Предыдущие исследования (51,52) показали, что движения антенн пчел лучше всего описываются с помощью круговых координат (r, θ), поскольку каждая антенна движется вокруг своего гнезда (рис. 1B). Таким образом, движения каждой антенны были описаны в собственной системе координат, с гнездом (основанием) антенны в качестве начала координат (0,0).
- Угловое положение (θ): оно определялось как угол между линией, соединяющей кончики антенн с их основанием (r), и передне-задней линией, проходящей через соответствующее основание антенны. Эта переменная указывает, расположена ли антенна спереди (0°), сбоку (90°) или сзади (180°). Обратите внимание, что измеренный угол симметричен для левой или правой антенны, так что 90° находится слева для левой антенны и справа для правой антенны.
- Расстояние до основания антенны (r): оно определяется как расстояние между основанием антенны и ее кончиком. Таким образом, эта переменная измеряет, находится ли антенна в вытянутом или втянутом положении.
- Угловая скорость (Vθ): она рассчитывалась как угол θ, пройденный каждой антенной за кадр (1/90 с). Она выражается в градусах в секунду.
Как объясняется в результатах, θ и Vθ оказались наиболее подходящими для измерения изменений, вызванных кондиционированием, и поэтому представлены на рисунках. Данные по r представлены в Дополнительном материале (Suppl. Fig S1). Ответ на каждый одорант рассчитывался как изменение между движениями антенн до и во время стимуляции одорантом. Таким образом, Δθ (или ΔVθ) рассчитывали как среднее значение θ (или ΔVθ) во время стимула минус среднее значение θ (или ΔVθ) до стимула (рис. 1С,D).
В большинстве экспериментов обе антенны пчел были помечены и записаны, а данные по углу и скорости усреднялись между антеннами перед любым анализом. В эксперименте с концентрацией (рис. 6) отслеживалась только одна антенна пчелы (сбалансированная между правой и левой), что позволило ускорить анализ данных. Поскольку в предыдущих исследованиях наблюдались различные поведенческие и/или нейрофизиологические эффекты в зависимости от стороны обонятельной стимуляции (через правую или левую антенну (116,117,118), мы статистически оценили, различаются ли движения антенн между сторонами. Мы не обнаружили влияния стороны антенны ни для Δθ (RM-ANOVA, F1,41 < 3.29, p > 0.077), ни для ΔVθ (RM-ANOVA, F1,41 < 0.31, p > 0.579).
Одоранты для анализа движения антенн
В экспериментах было протестировано до пятнадцати одорантов с различной биологической ценностью для пчел. Их подробное описание приведено в таблице 1. Для большинства стимулов 5 мкл раствора одоранта помещали на полоску фильтровальной бумаги, вставленную в пипетку Пастера. Одоранты использовались в чистом виде, за исключением 3-метил индола, который представлял собой порошок, разведенный в воде в концентрации 0,48 мг L-1119. Феромон королевы QMP был представлен в виде коммерческой палочки (BeeBoost ®, Pherotech, Delta, Канада), непосредственно вставленной в пипетку Пастера. За исключением последнего стимула, все одоранты были получены от Sigma-Aldrich (Дайзенхофен, Германия). В качестве контрольного стимула использовалась пипетка, содержащая чистый кусок фильтровальной бумаги. Порядок предъявления одорантов был рандомизирован между пчелами. В одном эксперименте три одоранта (гераниол, октановая кислота и 2-гептанон) были протестированы в восьми концентрациях от 10-7 до 100. Они были приготовлены в минеральном масле и были представлены в порядке возрастания концентрации, чтобы избежать адаптации (т.е. 10-7 концентрации трех одорантов были представлены пчеле перед переходом к 10-6 концентрации и т.д.). Контрольными стимулами служили пипетка с кусочком фильтровальной бумаги, пропитанной 5 мкл минерального масла, и пипетка с чистым кусочком фильтровальной бумаги. Оба стимула предъявлялись до и после концентрации одоранта. Интервал между предъявлениями запахов составлял ~ 60 с.
Оценка привлекательности одорантов
Для определения привлекательности каждого одоранта для пчел мы разработали высокопроизводительный анализ, позволяющий одновременно отслеживать движения 16 пчел, каждая из которых сталкивалась с различными стимулами (рис. 4A). Каждая из 16 линий установки была длиной 45 см, состояла из 3 соединенных стеклянных трубок (внутренний диаметр 12 мм), с двумя пластиковыми (3D-печатные) коробками, расположенными на каждом конце, одна из которых содержала пчелу, а другая — фильтровальную бумагу с 5 мкл чистого одоранта. Пчелиный ящик содержал раздвижную дверь, позволяющую контролировать, когда каждой пчеле разрешалось войти в стеклянную трубку. Три автоматических инфракрасных портала (Trikinetics, Walham, MA, США), расположенных на одинаковом расстоянии друг от друга, позволяли подсчитывать проходы каждой пчелы в трех местах вдоль трубки. Аппарат был помещен в темноту, чтобы убедиться, что движения пчел основаны на обонянии, и под вытяжной вентилятор для предотвращения накопления и загрязнения одорантов. Шестнадцать пчел тестировались одновременно, каждая с одним из 15 одорантов или с коробкой без запаха (контроль). Каждой пчеле разрешалось войти в свою трубку, открыв дверцу ящика. Затем в течение 10 мин наблюдали за ее перемещениями через три портала. Пчелиные ящики и стеклянная посуда тщательно мылись между опытами, а ящики с одорантами хранились отдельно в пластиковых пакетах и всегда содержали один и тот же одорант на протяжении всего эксперимента.
В итоге, индекс ориентации рассчитывался по количеству проходов через порталы по следующей формуле: (M3-M1)/(M3 + M1), где M1 — монитор, расположенный близко к начальной позиции пчелы, наиболее удаленный от коробки с одорантом, а M3 — монитор, расположенный ближе всего к коробке с одорантом. Каждая пчела использовалась в аппарате только один раз и только с одним запахом. Необработанный индекс позиции контрольной группы (ящик без запаха) вычитался из индекса позиции каждого одоранта, чтобы получить индекс привлекательности этого одоранта (AI). Таким образом, положительный ИИ (рис. 4) указывал на привлекательный запах, в то время как отрицательный ИИ указывал на отталкивающий запах.
Статистический анализ
Перед анализом нормальное распределение антеннальных данных и данных о привлекательности было подтверждено с помощью теста Шапиро-Уилкса. Для сравнения антеннальных ответов (изменения углового положения Δθ и скорости ΔVθ) на разные одоранты использовали повторный дисперсионный анализ (RM-ANOVA), при этом стимул (одоранты, включая контроль воздуха) был внутригрупповым фактором. В случае значимости, постхоккальные тесты Даннетта позволяли сравнить значение каждого одоранта с контролем. В эксперименте с концентрацией одорантов использовался RM-ANOVA со стимулом и концентрацией в качестве внутригрупповых факторов. Если он был значимым, за ним следовал индивидуальный RM-ANOVA для каждого одоранта, где только концентрация была внутригрупповым фактором. Если концентрация была значимой, отдельные концентрации сравнивали с общим контролем (среднее значение четырех стимулов воздух/минеральное масло), используя тест Даннетта. Чтобы убедиться в отсутствии различий между группами, помеченными правой или левой антенной, использовался RM-ANOVA со стороной антенны в качестве категориального фактора, для всех запахов и концентраций, а также для контроля отдельно. Что касается анализа привлекательности запахов, различия в индексе привлекательности сравнивались между стимулами с помощью ANOVA (обратите внимание, что с каждым запахом тестировались разные пчелы). Для оценки взаимосвязи между индексом привлекательности, давлением паров или концентрацией одорантов и переменными движения антенн Δθ и ΔVθ использовались тесты корреляции Пирсона. Все статистические анализы проводились с помощью программы Statistica® 7.0 (StatSoft, Inc. 2004).
Дополнительная информация
Скачать дополнительные материалы
Ссылки:
1.Alcock, J. Animal Behavior: An Evolutionary Approach (Sinauer Associates, Berlin, 1997). Google Scholar
2.Ressler, N. Rewards and punishments, goal-directed behavior and consciousness. Neurosci. Biobehav. Rev. 28, 27–39 (2004). Article PubMed Google Scholar
3.Mannella, F., Gurney, K. & Baldassarre, G. The nucleus accumbens as a nexus between values and goals in goal-directed behavior: A review and a new hypothesis. Front. Behav. Neurosci. 7, 135 (2013). Article PubMed PubMed Central Google Scholar
4.Roelofs, S., Boleij, H., Nordquist, R. E., Staay, V. D. & Josef, F. Making decisions under ambiguity: Judgment bias tasks for assessing emotional state in animals. Front. Behav. Neurosci. 10, 119 (2016). Article PubMed PubMed Central Google Scholar
5.Wierda, S. M., van Rijn, H., Taatgen, N. A. & Martens, S. Pupil dilation deconvolution reveals the dynamics of attention at high temporal resolution. PNAS 109, 8456–8460 (2012). Article ADS CAS PubMed PubMed Central Google Scholar
6.Descovich, K. A. et al. Facial expression: An under-utilized tool for the assessment of welfare in mammals. Altex 34, 409–429 (2017). PubMed Google Scholar
7.Reefmann, N., Bütikofer Kaszàs, F., Wechsler, B. & Gygax, L. Ear and tail postures as indicators of emotional valence in sheep. Appl. Anim. Behav. Sci. 118, 199–207 (2009). Article Google Scholar
8.Reefmann, N., Wechsler, B. & Gygax, L. Behavioural and physiological assessment of positive and negative emotion in sheep. Anim. Behav. 78, 651–659 (2009). Article Google Scholar
9.Vögeli, S., Lutz, J., Wolf, M., Wechsler, B. & Gygax, L. Valence of physical stimuli, not housing conditions, affects behaviour and frontal cortical brain activity in sheep. Behav. Brain Sci. 267, 144–155 (2014). Google Scholar
10.Lecorps, B. & Féron, C. Correlates between ear postures and emotional reactivity in a wild type mouse species. Behav. Process. 120, 25–29 (2015). Article Google Scholar
11.Lemaire, M. & Chase, R. Twitching and quivering of the tentacles during snail olfactory orientation. J. Comp. Physiol. A 182, 81–87 (1997). PDF opens in a new tabArticle Google Scholar
12.Peschel, M., Straub, V. & Teyke, T. Consequences of food-attraction conditioning in Helix: A behavioral and electrophysiological study. J. Comp. Physiol. A 178, 317–327 (1996).Article Google Scholar
13.Nikitin, E. S., Zakharov, I. S. & Balaban, P. M. Regulation of tentacle length in snails by odor concentration. Neurosci. Behav. Physiol. 36, 63–72 (2006). PDF opens in a new tabAr cle CAS PubMed Google Scholar
14.Lacher, V. & Schneider, D. Elektrophysiologischer Nachweis der Riechfunktion von Porenplatten (Sensilla Placodea) auf den Antennen der Drohne und der Arbeitsbiene Apis mellifica L.). Z. Vergl. Physiol. 47, 274–278 (1963). Article Google Scholar
15.Lacher, V. Elektrophysiologische Untersuchungen an einzelnen Rezeptoren für Geruch, Kohlendioxyd, Luftfeuchtigkeit und Tempratur auf den Antennen der Arbeitsbiene und der Drohne Apis mellifica L). Z. Vergl. Physiol. 48, 587–623 (1964). Article Google Scholar
16.Vareschi, E. Duftunterscheidung bei der Honigbiene—Einzelzell-Ableitungen und Verhaltensreaktionen. Z. vergl. Physiologie 75, 143–173 (1971). Article Google Scholar
17.Esslen, J. & Kaissling, K.-E. Zahl und Verteilung antennaler Sensillen bei der Honigbiene (Apis mellifera L.). Zoomorphologie 83, 227–251 (1976). Article Google Scholar
18.Whitehead, A. T. & Larsen, J. R. Ultrastructure of the contact chemoreceptors of Apis mellifera L. (Hymenoptera: Apidae). Int. J. Insect. Morphol. Embryol. 5, 301–315 (1976). Article Google Scholar
19.Dreller, C. & Kirchner, W. H. Hearing in honeybees: Localization of the auditory sense organ. J. Comp. Physiol. A 173, 275–279 (1993). Article Google Scholar
20.Martin, H. & Lindauer, M. Sinnesphysiologische Leistungen beim Wabenbau der Honigbiene. Z. Vergl. Physiol. 53, 372–404 (1966). Article Google Scholar
21.Winston, M. The biology of the honey bee. 281 (1987).
22.Nagari, M. & Bloch, G. The involvement of the antennae in mediating the brood influence on circadian rhythms in “nurse” honey bee (Apis mellifera) workers. J. Insect Physiol. 58, 1096–1103 (2012). Article CAS PubMed Google Scholar
23.Free, J. B. A study of the stimuli which release the food begging and offering responses of worker honeybees. Anim. Behav. 4, 94–101 (1956). Article Google Scholar
24.Montagner, H. & Pain, J. Étude préliminaire des communications entre ouvrières d’abeilles au cours de la trophallaxie. Insect. Soc. 18, 177–191 (1971). Article Google Scholar
25.Galliot, G. & Azœuf, P. Etude quantitative des transferts de nourriture entre ouvrieres d’age connu chez l’abeille domestique (Apis mellifica mellifica L.). Insect. Soc. 26, 39–49 (1979). Article Google Scholar
26.Galliot, G., Montagner, H. & Azœuf, P. Étude quantitative des transferts de nourriture entre ouvrières et males chez l’abeille domestique (Apis mellifica L.). Insect. Soc. 29, 268–279 (1982). Article Google Scholar
27.Korst, P. J. M. & Velthuis, H. H. W. The nature of trophallaxis in honeybees. Insect. Soc. 29, 209–221 (1982). Article Google Scholar
28.Crailsheim, K. Trophallactic interactions in the adult honeybee (Apis mellifera L.). Apidologie 29, 97–112 (1998). Article Google Scholar
29.von Frisch, K. The Dance Language and Orientation of Bees (Harvard University Press, 1967). Google Scholar
30.Cholé, H. et al. Social contact acts as appetitive reinforcement and supports associative learning in honeybees. Curr. Biol. 29, 1407-1413.e3 (2019). Article PubMed CAS Google Scholar
31.Kevan, P. G. & Lane, M. A. Flower petal microtexture is a tactile cue for bees. PNAS 82, 4750–4752 (1985). Article ADS CAS PubMed PubMed Central Google Scholar
32.Menzel, R. Neurobiology of Comparative Cognition 237–292 (Lawrence Erlbaum Associates Inc, Berlin, 1990). Google Scholar
33.Wright, G. A. & Schiestl, F. P. The evolution of floral scent: The influence of olfactory learning by insect pollinators on the honest signalling of floral rewards. Funct. Ecol. 23, 841–851 (2009). Article Google Scholar
34.Slessor, K. N., Winston, M. L. & Conte, Y. L. Pheromone communication in the honeybee (Apis mellifera L.). J. Chem. Ecol. 31, 2731–2745 (2005). PDF opens in a new tabArticle CAS PubMed Google Scholar
35.Wilson, E. O. The Insect Societies (Belknap Press of Harvard University Press, 1971). Google Scholar
36.Butler, C. G. The importance of perfume in the discovery of food by the worker honeybee (Apis mellifera L.). Proc. R. Soc. B 138, 403–413 (1951). ADS Google Scholar
37.Free, J. B. & Winder, M. E. Brood recognition by honeybee (Apis mellifera) workers. Anim. Behav. 31, 539–545 (1983). Article Google Scholar
38.Free, J. B., Ferguson, A. W. & Simpkins, J. R. The behaviour of queen honeybees and their attendants. Physiol. Entomol. 17, 43–55 (1992). Article Google Scholar
39.Maisonnasse, A. et al. New insights into honey bee (Apis mellifera) pheromone communication Is the queen mandibular pheromone alone in colony regulation?. Front. Zool. 7, 18 (2010). Article PubMed CAS PubMed Central Google Scholar
40.Free, J. B. Pheromones of Social Bees (Springer, 1987). Google Scholar
41.Free, J. B. The allocation of duties among worker honeybees. Anim. Behav. 12, 389–390 (1964). Article Google Scholar
42.Spivak, M., Masterman, R., Ross, R. & Mesce, K. A. Hygienic behavior in the honey bee (Apis mellifera L.) and the modulatory role of octopamine. J. Neurobiol. 55, 341–354 (2003). Article CAS PubMed Google Scholar
43.Cheruiyot, S. K., Lattorff, H. M. G., Kahuthia-Gathu, R., Mbugi, J. P. & Muli, E. Varroa-specific hygienic behavior of Apis mellifera scutellata in Kenya. Apidologie https://doi.org/10.1007/s13592-018-0570-6 (2018). PDF opens in a new tabArticle Google Scholar
44.Visscher, P. K. The honey bee way of death: Necrophoric behaviour in Apis mellifera colonies. Anim. Behav. 31, 1070–1076 (1983). Article Google Scholar
45.Maschwitz, U. W. Alarm substances and alarm behaviour in social hymenoptera. Nature 204, 324–327 (1964). PDF opens in a new tabArticle ADS Google Scholar
46.Boch, R. & Rothenbuhler, W. C. Defensive behaviour and production of alarm pheromone in honeybees. J. Apic. Res. 13, 217–221 (1974). Article CAS Google Scholar
47.Collins, A. M., Rinderer, T. E., Tucker, K. W., Sylvester, H. A. & Lackett, J. J. A model of honeybee defensive behaviour. J. Apic. Res. 19, 224–231 (1980). Article Google Scholar
48.Thom, C., Gilley, D. C., Hooper, J. & Esch, H. E. The scent of the waggle dance. PLoS Biol 5, e228 (2007). Article PubMed CAS PubMed Central Google Scholar
49.Menzel, R. Memory dynamics in the honeybee. J. Comp. Physiol. A 185, 323–340 (1999). PDF opens in a new tabArticle ADS Google Scholar
50.Erber, J., Pribbenow, B., Bauer, A. & Kloppenburg, P. Antennal reflexes in the honeybee: tools for studying the nervous system. Apidologie 24, 283–296 (1993). Article Google Scholar
51.Lambin, M., Déglise, P. & Gauthier, M. Antennal movements as indicators of odor detection by worker honeybees. Apidologie 36, 119–126 (2005). Article Google Scholar
52.Cholé, H., Junca, P. & Sandoz, J.-C. Appetitive but not aversive olfactory conditioning modifies antennal movements in honeybees. Learn. Mem. 22, 604–616 (2015). Article PubMed PubMed Central Google Scholar
53.Erber, J., Pribbenow, B., Grandy, K. & Kierzek, S. Tactile motor learning in the antennal system of the honeybee (Apis mellifera L.). J. Comp. Physiol. A 181, 355–365 (1997). PDF opens in a new tabArticle Google Scholar
54.Mujagić, S., Würth, S. M., Hellbach, S. & Dürr, V. Tactile conditioning and movement analysis of antennal sampling strategies in honey bees (Apis mellifera L.). JoVE 70, e50179 (2012). Google Scholar
55.Claverie, M. N., Buvat, P. & Casas, J. Active sensing in bees through antennal movements is independent of odor molecule. BioRxiv https://doi.org/10.1101/2021.09.13.460114 (2021). Article Google Scholar
56.Haupt, S. S. Antennal sucrose perception in the honey bee (Apis mellifera L.): Behaviour and electrophysiology. J. Comp. Physiol. A 190, 735–745 (2004). PDF opens in a new tabArticle CAS Google Scholar
57.Haupt, S. S. Central gustatory projections and side-specificity of operant antennal muscle conditioning in the honeybee. J. Comp. Physiol. A 193, 523–535 (2007). PDF opens in a new tabArticle Google Scholar
58.Pribbenow, B. & Erber, J. Modulation of antennal scanning in the honeybee by sucrose stimuli, serotonin, and octopamine: Behavior and electrophysiology. Neurobiol. Learn. Mem. 66, 109–120 (1996). Article CAS PubMed Google Scholar
59.Giurfa, M. & Núñez, J. A. Honeybees mark with scent and reject recently visited flowers. Oecologia 89, 113–117 (1992). Article ADS PubMed Google Scholar
60.Giurfa, M. The repellent scent-mark of the honeybee Apis mellifera tigustica and its role as communication cue during foraging. Insect. Soc. 40, 59–67 (1993). Article Google Scholar
61.Strauch, M., Ditzen, M. & Galizia, C. G. Keeping their distance? Odor response patterns along the concentration range. Front. Syst. Neurosci. 6 (2012).
62.Carcaud, J., Giurfa, M. & Sandoz, J.-C. Differential processing by two olfactory subsystems in the honeybee brain. Neuroscience 374, 33–48 (2018). Article CAS PubMed Google Scholar
63.Sachse, S. & Galizia, C. G. The coding of odour-intensity in the honeybee antennal lobe: local computation optimizes odour representation. Eur. J. Neurosci. 18, 2119–2132 (2003). Article PubMed Google Scholar
64.Charlton, R. E., Kanno, H., Collins, R. D. & Cardé, R. T. Influence of pheromone concentration and ambient temperature on flight of the gypsy moth, Lymantria dispar (L), in a sustained-flight wind tunnel. Physiol. Entomol. 18, 349–362 (1993). Article CAS Google Scholar
65.Kaminski, L.-A., Slessor, K. N., Winston, M. L., Hay, N. W. & Borden, J. H. Honeybee response to queen mandibular pheromone in laboratory bioassays. J. Chem. Ecol. 16, 841–850 (1990). Article CAS PubMed Google Scholar
66.Le Conte, Y., Sreng, L. & Trouiller, J. The recognition of larvae by worker honeybees. Naturwissenschaften 81, 462–465 (1994). Article ADS Google Scholar
67.Urlacher, E., Francés, B., Giurfa, M. & Devaud, J.-M. An alarm pheromone modulates appetitive olfactory learning in the honeybee (Apis mellifera). Front. Behav. Neurosci. 4, 157 (2010). PubMed PubMed Central Google Scholar
68.Bredy, T. W. & Barad, M. Social modulation of associative fear learning by pheromone communication. Learn. Mem. 16, 12–18 (2009). Article PubMed PubMed Central Google Scholar
69.Baracchi, D., Devaud, J.-M., d’Ettorre, P. & Giurfa, M. Pheromones modulate reward responsiveness and non-associative learning in honey bees. Sci. Rep. 7, 9875 (2017). PDF opens in a new tabArticle ADS PubMed PubMed Central Google Scholar
70.Urlacher, E., Devaud, J.-M. & Mercer, A. R. in Handbook of Behavioral Neuroscience (ed. Randolf Menzel and Paul R. Benjamin) 22, 442–449 (Elsevier, 2013).
71.Avalos, A. et al. Social signals and aversive learning in honey bee drones and workers. Biol. Open https://doi.org/10.1242/bio.021543 (2016). PDF opens in a new tabArticle PubMed Central Google Scholar
72.Baracchi, D. et al. Pheromone components affect motivation and induce persistent modulation of associative learning and memory in honey bees. Commun. Biol. 3, 1–9 (2020). PDF opens in a new tabArticle CAS Google Scholar
73.Rossi, N., D’Ettorre, P. & Giurfa, M. Pheromones modulate responsiveness to a noxious stimulus in honey bees. J. Exp. Biol. 221, jeb172270 (2018). PDF opens in a new tabArticle PubMed Google Scholar
74.Collins, A. M. Effect of age on the response to alarm pheromones by caged honey bees. Ann. Entomol. Soc. Am. 73, 307–309 (1980). PDF opens in a new tabArticle Google Scholar
75.Szabo, T. I. & Townsend, G. F. Behavioural studies on queen introduction in the honeybee 1. Effect of the age of workers (from a colony with a laying queen) on their behaviour towards an introduced virgin queen. J. Apic. Res. 13, 19–25 (1974). Article Google Scholar
76.Breed, M. D. Correlations between aggressiveness and corpora allata volume, social isolation, age and dietary protein in worker honeybees. Insect. Soc. 30, 482–495 (1983). Article Google Scholar
77.Schulz, D. J., Elekonich, M. M. & Robinson, G. E. Biogenic amines in the antennal lobes and the initiation and maintenance of foraging behavior in honey bees. J. Neurobiol. 54, 406–416 (2003). Article CAS PubMed Google Scholar
78.Schulz, D. J., Barron, A. B. & Robinson, G. E. A role for octopamine in honey bee division of labor. Brain Behav. Evol. 60, 350–359 (2002). PDF opens in a new tabArticle PubMed Google Scholar
79.Barron, A., Schulz, D. & Robinson, G. Octopamine modulates responsiveness to foraging-related stimuli in honey bees (Apis mellifera). J. Comp. Physiol. A 188, 603–610 (2002). PDF opens in a new tabArticle CAS Google Scholar
80.Robinson, G. E. Regulation of honey bee age polyethism by juvenile hormone. Behav. Ecol. Sociobiol. 20, 329–338 (1987). Article Google Scholar
81.Fluri, P., Lüscher, M., Wille, H. & Gerig, L. Changes in weight of the pharyngeal gland and haemolymph titres of juvenile hormone, protein and vitellogenin in worker honey bees. J. Insect Physiol. 28, 61–68 (1982). Article CAS Google Scholar
82.Harris, J. W. & Woodring, J. Effects of stress, age, season, and source colony on levels of octopamine, dopamine and serotonin in the honey bee (Apis mellifera L.) brain. J. Insect Physiol. 38, 29–35 (1992). Article CAS Google Scholar
83.Pareto, A. Die zentrale Verteilung der Fühlerafferenz bei Arbeiterinnen der Honigbiene, Apis mellifera L.. Z. Zellforsch 131, 109–140 (1972). Article CAS PubMed Google Scholar
84.Suzuki, H. Antennal movements induced by odour and central projection of the antennal neurones in the honey-bee. J. Insect Physiol. 21, 831–847 (1975). Article Google Scholar
85.Staudacher, E. M., Gebhardt, M. & Dürr, V. in Advances in Insect Physiology 32, 49–205 (Elsevier, 2005).
86.Erber, J., Pribbenow, B., Kisch, J. & Faensen, D. Operant conditioning of antennal muscle activity in the honey bee (Apis mellifera L.). J. Comp. Physiol. A 186, 557–565 (2000). PDF opens in a new tabArticle CAS PubMed Google Scholar
87.Galizia, C. G., Sachse, S., Rappert, A. & Menzel, R. The glomerular code for odor representation is species specific in the honeybee Apis mellifera. Nat. Neurosci. 2, 473–478 (1999). PDF opens in a new tabArticle CAS PubMed Google Scholar
88.Carcaud, J., Giurfa, M. & Sandoz, J.-C. Differential combinatorial coding of pheromones in two olfactory subsystems of the honey bee brain. J. Neurosci. 35, 4157–4167 (2015). Article CAS PubMed PubMed Central Google Scholar
89.Sandoz, J.-C. et al. Understanding the logics of pheromone processing in the honeybee brain: From labeled-lines to across-fi ber patterns. Front. Behav. Neurosci. 1, 5 (2007). Article PubMed CAS PubMed Central Google Scholar
90.Roussel, E., Carcaud, J., Combe, M., Giurfa, M. & Sandoz, J.-C. Olfactory coding in the honeybee lateral horn. Curr. Biol. 24, 561–567 (2014). Article CAS PubMed Google Scholar
91.Tanaka, N. K., Awasaki, T., Shimada, T. & Ito, K. Integration of chemosensory pathways in the drosophila second-order olfactory centers. Curr. Biol. 14, 449–457 (2004). Article CAS PubMed Google Scholar
92.Duistermars, B. J. & Frye, M. A. Multisensory integration for odor tracking by flying Drosophila. Commun. Integr. Biol. 3, 60–63 (2010). Article PubMed PubMed Central Google Scholar
93.Szyszka, P., Ditzen, M., Galkin, A., Galizia, C. G. & Menzel, R. Sparsening and temporal sharpening of olfactory representations in the honeybee mushroom bodies. J. Neurophysiol. 94, 3303–3313 (2005). Article PubMed Google Scholar
94.Mauelshagen, J. Neural correlates of olfactory learning paradigms in an identified neuron in the honeybee brain. J. Neurophysiol. 69, 609–625 (1993). Article CAS PubMed Google Scholar
95.Okada, R., Rybak, J., Manz, G. & Menzel, R. Learning-related plasticity in PE1 and other mushroom body-extrinsic neurons in the honeybee brain. J. Neurosci. 27, 11736–11747 (2007). Article CAS PubMed PubMed Central Google Scholar
96.Strube-Bloss, M. F., Nawrot, M. P. & Menzel, R. Mushroom body output neurons encode odor-reward associations. J. Neurosci. 31, 3129–3140 (2011). Article CAS PubMed PubMed Central Google Scholar
97.Strube-Bloss, M. F., Nawrot, M. P. & Menzel, R. Neural correlates of side-specific odour memory in mushroom body output neurons. Proc. R. Soc. B 283, 20161270 (2016). PDF opens in a new tabArticle PubMed PubMed Central Google Scholar
98.Rybak, J. & Menzel, R. Anatomy of the mushroom bodies in the honey bee brain: The neuronal connections of the alpha-lobe. J. Comp. Neurol. 334, 444–465 (1993). Article CAS PubMed Google Scholar
99.Wasserman, S. M. & Frye, M. A. Group behavior: Social context modulates behavioral responses to sensory stimuli. Curr. Biol. 25, R467–R469 (2015). Article CAS PubMed Google Scholar
100.Cullen, D. A., Sword, G. A., Dodgson, T. & Simpson, S. J. Behavioural phase change in the Australian plague locust, Chortoicetes terminifera, is triggered by tactile stimulation of the antennae. J. Insect Physiol. 56, 937–942 (2010). Article CAS PubMed Google Scholar
101.Collins, A. M. & Blum, M. S. Bioassay of compounds derived from the honeybee sting. J. Chem. Ecol. 8, 463–470 (1982). Article CAS PubMed Google Scholar
102.Boch, R., Shearer, D. A. & Stone, B. C. Identification of iso-amyl acetate as an active component in the sting pheromone of the honey bee. Nature 195, 1018–1020 (1962). PDF opens in a new tabArticle ADS CAS PubMed Google Scholar
103.Free, J. B., Ferguson, A. W. & Simpkins, J. R. Honeybee responses to chemical components from the worker sting apparatus and mandibular glands in field tests. J. Apic. Res. 28, 7–21 (1989). Article Google Scholar
104.Free, J. B., Ferguson, A. W. & Pickett, J. A. Effect of the components of the nasonov pheromone on its release by honeybees at the hive entrance. J. Apic. Res. 22, 155–157 (1983). Article CAS Google Scholar
105.Boch, R. & Shearer, D. A. Identification of geraniol as the active component in the nassanoff pheromone of the honey bee. Nature 194, 704–706 (1962). PDF opens in a new tabArticle ADS CAS Google Scholar
106.Maisonnasse, A., Lenoir, J.-C., Beslay, D., Crauser, D. & Le Conte, Y. E-β-ocimene, a volatile brood pheromone involved in social regulation in the honey bee colony (Apis mellifera). PLoS ONE 5, e13531 (2010). Article ADS PubMed CAS PubMed Central Google Scholar
107.Le Conte, Y., Arnold, G., Trouiller, J., Masson, C. & Chappe, B. Identification of a brood pheromone in honeybees. Naturwissenschaften 77, 334–336 (1990). Article ADS Google Scholar
108.Le Conte, Y., Sreng, L. & Poitout, S. H. Brood pheromone can modulate the feeding behavior of Apis mellifera workers (Hytnenoptera: Apidae). J. Econ. Entomol. 88, 798–804 (1995). PDF opens in a new tabArticle Google Scholar
109.Slessor, K. N., Kaminski, L.-A., King, G. G. S., Borden, J. H. & Winston, M. L. Semiochemical basis of the retinue response to queen honey bees. Nature 332, 354–356 (1988). PDF opens in a new tabArticle ADS CAS Google Scholar
110.Blum, M. S., Jones, T. H., Rinderer, T. E. & Sylvester, H. A. Oxygenated compounds in beeswax: Identification and possible significance. Comp. Biochem. Physiol. B 91, 581–583 (1988). Article CAS PubMed Google Scholar
111.Knudsen, J. T., Tollsten, L. & Bergström, L. G. Floral scents—A checklist of volatile compounds isolated by head-space techniques. Phytochemistry 33, 253–280 (1993). Article CAS Google Scholar
112.Nouvian, M., Hotier, L., Claudianos, C., Giurfa, M. & Reinhard, J. Appetitive floral odours prevent aggression in honeybees. Nat. Commun. 6, 10247 (2015). PDF opens in a new tabArticle ADS CAS PubMed Google Scholar
113.Malerbo-Souza, D. T. & Nogueira-Couto, R. H. Efficiency of n-octyl-acetate, 2-heptanone and citronellal in repelling bees from basil (Ocimum sellowii—Labiatae). Braz. Arch. Biol. Technol. 47, 121–125 (2004). Article CAS Google Scholar
114.Kühn, A. Über den Geruchsinn der Biene. Naturwissenschaften 8, 491–493 (1920). Article ADS Google Scholar
115.Boch, R., Shearer, D. A. & Shuel, R. W. Octanoic and other volatile acids in the mandibular glands of the honeybee and in royal jelly. J. Apic. Res. 18, 250–252 (1979). Article CAS Google Scholar
116.Letzkus, P. et al. Lateralization of olfaction in the honeybee Apis mellifera. Curr. Biol. 16, 1471–1476 (2006). Article CAS PubMed Google Scholar
117.Rogers, L. J. & Vallortigara, G. From antenna to antenna: Lateral shift of olfactory memory recall by honeybees. PLoS ONE 3, e2340 (2008). Article ADS PubMed CAS PubMed Central Google Scholar
118.Rigosi, E. et al. Asymmetric neural coding revealed by in vivo calcium imaging in the honey bee brain. Proc. Biol. Sci. 282, 20142571 (2015). PubMed PubMed Central Google Scholar
119.Beehler, J. W., Millar, J. G. & Mulla, M. S. Field evaluation of synthetic compounds mediating oviposition in Culex mosquitoes (Diptera: Culicidae). J. Chem. Ecol. 20, 281–291 (1994). Article CAS PubMed Google Scholar

Добавить комментарий