Простое резюме
Паразитические клещи, Varroa destructor, являются основной угрозой для колоний западных медоносных пчел, Apis mellifera, во всем мире. Тем не менее, некоторые популяции медоносных пчел могут пережить заражение этим клещом, вероятно, благодаря поведению, подавляющему размножение паразита. Однако возможные изменения в клещах, связанных с этими выжившими пчелами, и потенциальные вариации поведения пчел с течением времени плохо изучены. Здесь мы показываем, что клещи могут изменять свое размножение, когда связаны с выжившими хозяевами, и что поведение пчел, подавляющее размножение клещей, может меняться со временем. В полностью скрещенном полевом эксперименте на голландских выживших колониях (селекция Amsterdam Water Dunes (AWD)) исследовали укупорку рабочих расплодных ячеек и чувствительную к варроа гигиену (VSH), выполняемую пчелами, и репродуктивные параметры клещей. Ни укупорка, ни VSH не были значительно выражены, несмотря на то, что предыдущее исследование показало VSH у этих AWD-пчел. Большая доля клещей, которые коэволюционировали с выжившими пчелами AWD, размножались по сравнению с клещами в колониях, подвергавшихся обычной обработке, но имели более низкую плодовитость. В целом, наше исследование предполагает, что колонии медоносных пчел могут выживать при заражении этими клещами с помощью еще не изученных средств, и впервые показывает адаптивные изменения в размножении их коэволюционировавших клещей.
Аннотация
Коэволюция является основной движущей силой, определяющей результат взаимодействия хозяина и паразита во времени. После смены хозяина отсутствие коэволюции может оказать резкое влияние на новые популяции хозяев. Тем не менее, известно, что популяции западных медоносных пчел (Apis mellifera) могут справляться со сменой хозяина эктопаразитическими клещами (Varroa destructor) с помощью естественного отбора. Однако адаптивные фенотипические признаки паразитов и временные вариации в поведении хозяина по сопротивлению плохо изучены. Здесь мы показываем, что клещи вносят адаптивные изменения в репродуктивную стратегию, когда ассоциируются с устойчивыми хозяевами, и что черты устойчивости хозяина могут меняться со временем. В полностью скрещенном полевом эксперименте рабочие выводковые клетки местных адаптированных и неадаптированных (контрольных) колоний хозяев A. mellifera были заражены клещами, происходящими из обоих типов колоний хозяев. Затем исследовали размножение клещей, а также укупорку ячеек и удаление зараженного расплода (т.е. чувствительную гигиену Варроа, VSH) рабочими-хозяевами и сравнили с данными, полученными в тех же группах колоний-хозяев тремя годами ранее. Полученные данные свидетельствуют об адаптивных сдвигах в репродуктивных стратегиях клещей, поскольку клещи из адаптированных хозяев имеют более высокую вероятность размножения, но более низкую плодовитость при заражении ассоциированных хозяев, чем клещи в обработанных колониях. Полученные результаты подтверждают, что адаптированные хозяева могут снижать репродуктивный успех клещей. Однако ни укупорка клеток, ни VSH не были значительно выражены, хотя последний был значительно выражен в этой адаптированной популяции тремя годами ранее. Это говорит о временных различиях в выражении адаптивных признаков хозяина. Также представляется, что за снижение размножения клещей в адаптированных хозяевах отвечают не исследованные здесь механизмы. В заключение следует отметить, что для окончательного понимания механизмов выживания колоний хозяев медоносных пчел, зараженных V. destructor, необходимо использовать целостный подход, включающий адаптацию клещей и изучение одних и тех же популяций паразитов и хозяев в течение определенного времени.
1.Введение
Коэволюция — это динамический процесс, определяющий взаимодействие между паразитами и хозяевами [1,2,3]. Такая динамика может меняться в разных поколениях в зависимости от конкретных сценариев отбора [3]. Поскольку паразиты считаются одними из организмов с самым высоким эволюционным потенциалом, хозяевам придется быстро развивать эффективные адаптивные стратегии, чтобы выжить [4]. Удивительная приспособляемость паразитов включает склонность к переходу на новых хозяев, для которых отсутствие коэволюции может иметь катастрофические последствия [5]. Показательным примером этого является Varroa destructor, эктопаразитический клещ, который в настоящее время считается самой разрушительной угрозой для выживания своего нового хозяина — западной медоносной пчелы Apis mellifera [6]. V. destructor причиняет мало вреда своему первоначальному хозяину, восточной медоносной пчеле Apis cerana, поскольку эти виды имеют длительную коэволюционную историю, которая привела к развитию защитных механизмов [7,8,9,10]. Однако, когда V. destructor перешел на A. mellifera примерно в середине прошлого века, его первоначальная высокая вирулентность не была нейтрализована коэволюционными защитными механизмами хозяина, что привело к квазиистреблению популяций диких и одичавших медоносных пчел в Северном полушарии [11,12,13] и к большим потерям управляемых колоний [14].
С другой стороны, эволюция устойчивости к заражению клещами посредством естественного отбора была продемонстрирована в нескольких популяциях западных медоносных пчел, в которых не проводились химические обработки против клещей (обзор в [15]). Все популяции A. mellifera в Африке к югу от Сахары, а также африканизированные популяции в Америке выживают без обработки, в то время как популяции европейского происхождения в целом восприимчивы [10,15]. Тем не менее, сообщалось о выживших европейских популяциях A. mellifera и популяциях A. mellifera европейского происхождения в Северной Америке [15,16,17,18,19,20,21]. В этих колониях естественный отбор способствовал эволюции признаков, которые позволили им справиться с паразитом. Некоторые из этих адаптаций представляют собой специфическое поведение рабочих, которые нацеливаются на зараженные клещами выводковые клетки, тем самым снижая репродуктивный успех паразита [21]. Например, в четырех европейских выживших популяциях A. mellifera рабочие развили способность обнаруживать выводковые клетки, содержащие репродуктивных клещей, и, открывая и закрывая крышку клетки (т.е. повторное закрытие клетки), могут препятствовать размножению паразита ([22], но см. [23,24]). Устойчивые популяции могут также удалять все содержимое расплодных ячеек, зараженных репродуктивными клещами (т.е. варроа-чувствительная гигиена (ВЧГ) [25], как в случае амстердамской селекции Water Dunes, AWD, изученной Panziera et al. [20]). Эти результаты демонстрируют замечательную способность западных медоносных пчел быстро адаптироваться к новому паразиту. Однако возможность того, что паразит также может адаптироваться в ответ на селективное давление, оказываемое этими устойчивыми хозяевами, до сих пор привлекала мало внимания [26].
V. destructor размножается в закрытых выводковых клетках своих хозяев. Самка клеща-находки сначала откладывает гаплоидное яйцо, которое развивается в самца, затем три-четыре диплоидных яйца, которые развиваются в самок [27]. Самец спаривается со своими сестрами, и репродуктивный цикл заканчивается с появлением хозяина [6,10]. Из-за этой системы спаривания сибсов, а также первых находок клональных линий и высокого уровня инбридинга вследствие узких мест [28], V. destructor считался паразитом с низким эволюционным потенциалом [26]. Тем не менее, несколько исследований показали, что V. destructor обладает достаточной способностью адаптироваться в условиях высокого селективного давления, например, в нескольких популяциях клещей, обработанных синтетическими акарицидами, быстро развилась устойчивость [29,30,31,32]. Данные популяционной генетики также свидетельствуют об адаптивных изменениях в клещах, коэволюционирующих с выжившими хозяевами [33]. Однако фенотипические признаки V. destructor, позволяющие ему справляться с адаптированными хозяевами, изучены плохо. Установленная система коэволюции исходных хозяев — восточных медоносных пчел Apis cerana и клещей Varroa sp. [7,9,10] — может позволить предсказать адаптивные фенотипические признаки V. destructor к естественно выжившим новым хозяевам A. mellifera. В A. cerana клещи Varroa sp. размножаются, за редким исключением, только в сезонно появляющихся самцах (т.е. трутнях) расплода [9], возможно, чтобы избежать защитных механизмов взрослых рабочих пчел и/или расплода [8]. Если предположить, что селективное давление, оказываемое выжившими A. mellifera, аналогично давлению, оказываемому первоначальным хозяином A. cerana, то можно ожидать снижения вирулентности (смертности колонии, вызванной паразитами [19]), возможно, за счет адаптации к более низким темпам размножения материнских клещей (т.е. более низкой плодовитости). Поскольку более низкая плодовитость клещей может с меньшей вероятностью вызвать реакцию резистентности хозяина [34], более высокая плодовитость (т.е. вероятность размножения) в сочетании с более низкой плодовитостью, вероятно, в конечном итоге повышает приспособленность паразитов. Адаптации этих клещей были предложены ранее [19,35], но еще не были продемонстрированы эмпирически.
Пространственно-временные изменения признаков как хозяина, так и паразита являются ключевыми для нашего понимания коэволюции паразита-хозяина [1,2,3,36]. Поэтому необходимо учитывать временную перспективу при изучении механизмов резистентности, позволяющих хозяевам выжить, особенно в отношении недавно сменившихся паразитов [5,37]. К сожалению, для выживших западных медоносных пчел, зараженных варроа, данные о колебаниях в выражении признаков устойчивости от года к году скудны [38]. Поэтому представляется назревшей необходимость использовать преимущества целостного коэволюционного подхода, учитывающего ключевые адаптивные фенотипические признаки как хозяина, так и паразита [26], и одновременно оценить их изменения во временном масштабе [37]. Этого можно достичь, повторяя в разные моменты времени полностью скрещенные эксперименты с участием медоносных пчел и клещей, которые коэволюционировали при различных сценариях отбора. Здесь мы рассмотрели случай голландских пчел из селекции AWD [20,39,40,41]. Это популяция, отобранная для выживания в отсутствие акарицидных обработок в соответствии с дарвиновским протоколом пчеловодства «черный ящик» [42]. На сегодняшний день эта отобранная линия выживает без акарицидной обработки в течение 12 лет и широко используется в пчеловодстве (T. Blacquière, неопубликованное). Что касается паразита, мы исследовали общий репродуктивный успех как меру вирулентности, а также успешность начавшегося размножения как показатель способности паразита преодолевать защиту хозяина. Мы измерили эти параметры в клещах, заражающих медоносных пчел линии AWD, а также в клещах, заражающих регулярно обрабатываемые и неизбираемые местные контрольные колонии. Клещей каждого типа вводили как в отобранные, так и в неотборные колонии, которые происходили из одной популяции и, следовательно, имели одинаковый генетический фон. Поскольку исследования репродуктивной способности экспериментально интродуцированных клещей уже проводились в предыдущем исследовании на тех же отобранных и обработанных популяциях хозяев [20], можно было рассмотреть изменения в репродуктивном успехе и защитных механизмах хозяина с течением времени. Для изучения размножения клещей и механизмов резистентности пчел-хозяев мы использовали точно такие же протоколы для регистрации VSH [25], как и в работе Panziera et al. [20], а также включали повторную обработку ячеек расплода [22]. Затем мы сравнили выражение механизмов устойчивости с таковыми в тех же группах обработанных неизбранных и местных колоний, что и в работе Panziera et al. [20], чтобы изучить возможные изменения признаков хозяина с течением времени. В свете предыдущих исследований [20,22], мы ожидали, что пчелы из отобранной линии будут выражать рекапсуляцию расплодных ячеек и VSH более охотно, чем обработанные. Однако, учитывая, что исследуемые признаки могут изменяться со временем, они могут быть более или менее выражены в зависимости от давления отбора. Наконец, мы ожидали, что клещи из отобранных колоний хозяев будут иметь, по аналогии с исходным хозяином A. cerana, пониженную плодовитость (т.е. индивидуальную репродуктивную производительность), но при этом иметь более высокую вероятность размножения (т.е. плодовитость) по сравнению с клещами из обработанных колоний.
2.Материалы и методы
2.1. Экспериментальная установка
Летом 2018 года на экспериментальной пасеке в Вагенингене (Нидерланды) были созданы две группы колоний медоносных пчел, происходящих из тех же популяций, которые были протестированы в работе Panziera et al. [20], одна из которых была создана в соответствии с дарвиновским протоколом отбора «черный ящик» [42] и состояла из колоний из селекции AWD (N = 5, далее «отобранные»), а вторая — в соответствии с традиционным подходом местного пчеловодства (N = 6, далее «обработанные»). Примечательно, что исследование проводилось в тот же период года, что и в работе Panziera et al. [20]. Чтобы минимизировать влияние различных взаимодействий между генотипом и окружающей средой [43], обработанная группа была сформирована из местных восприимчивых колоний, которые регулярно обрабатывались против заражения V. destructor [44]. Наконец, начиная с трех недель до начала эксперимента, две дополнительные колонии из каждой группы были выбраны в качестве источников клещей [20]. Эти колонии управлялись таким образом, чтобы стимулировать производство клещей. В одной колонии из каждой пары все рамки с расплодными ячейками, которые должны были быть запечатаны в течение следующих шести-восьми часов (т.е. ячейки, содержащие зрелых личинок, готовящихся к окукливанию), были удалены и помещены в парную колонию. Параллельно из этой второй колонии извлекались гребни с появляющимися рабочими и переносились в первую. В результате в каждой паре одна колония содержала в основном клещей, заселяющих закрытые расплодные ячейки, а другая — клещей, обитающих на взрослых пчелах. Клещи, использованные для данного эксперимента, были отобраны из последней колонии с помощью метода сахарной глазури [45].
2.2. Экспериментальное заражение
Рамки с расплодом ненадолго извлекали из колоний, чтобы наметить ячейки рабочего расплода, готовые к закрытию прозрачным ацетатным листом, а затем возвращали в исходную колонию [20,45]. Параллельно взрослых самок клещей V. destructor собирали из исходных колоний методом сахарной глазури [45] и хранили в пластиковых контейнерах с влажной салфеткой до их внедрения в выводковые клетки.
Через шесть часов после маркировки ячеек из каждой колонии извлекали сопоставленные гребни и с помощью прозрачных листов идентифицировали свежие рабочие расплодные ячейки (N = 30 для каждой колонии). В этих ячейках проводили экспериментальное заражение, делая небольшой надрез на боковой стороне крышки каждой ячейки, вводя одного живого клеща тонкой кисточкой, а затем аккуратно закрывая надрез, сдвигая восковую крышку вниз [45]. Экспериментально зараженные ячейки были разделены на четыре группы обработки в зависимости от сочетания клещей и пчел-хозяев: клещи, заражающие выбранную линию хозяев, внесенные обратно в расплодные клетки этой линии (= selected-selected), клещи, заражающие обработанные колонии, внесенные в расплодные клетки выбранной линии (= treated-selected), клещи, заражающие выбранную линию хозяев, внесенные в расплодные клетки обработанных колоний (= selected-treated) и клещи, заражающие обработанные колонии, внесенные обратно в расплодные клетки обработанных колоний (= treated-treated).
2.3. Оценка восстановления клеток, гигиены, чувствительной к варроа, и размножения клещей
Рамки с расплодом были удалены из колоний через десять дней после экспериментального заражения — время, когда интродуцированные самки клещей должны были отложить все яйца, а мужское потомство должно быть зрелым и, следовательно, когда можно измерить репродуктивный успех [45]. Для анализа учитывались только те клетки, в которых на момент осмотра был обнаружен один материнский клещ. Это было сделано для того, чтобы учесть возможность того, что в течение нескольких часов, когда сопоставленные гребни возвращались в колонии для закрытия клеток, клетки могли быть естественным образом заражены клещами, присутствующими в колониях [45]. Для оценки скорости укупорки ячеек каждую ячейку открывали и осматривали нижнюю сторону укупорки [46]. Если блестящий слой шелкового кокона отсутствовал и была видна восковая пробка, ячейка считалась повторно укупоренной. Если же шелковый слой оставался неповрежденным, то ячейка считалась неперезакрытой. Кроме того, гигиену, чувствительную к варроа (VSH, [25]), определяли по скорости удаления расплода, полученной из числа экспериментально зараженных ячеек, которые были найдены пустыми в момент осмотра [20].
Из каждой ячейки тщательно извлекали куколок для анализа состава семейства клещей, а также репродуктивного успеха каждого заселенного клеща-найденыша [45,47]. Клещи-находки считались успешно репродуктивными, если они производили одного половозрелого самца и по крайней мере одну половозрелую дочь [45]. Если самец клеща отсутствовал, или если самец не сопровождался хотя бы одной половозрелой дочерью, или если потомство не производилось, клещи-находки считались нерепродуктивными. Наконец, для каждой репродуктивной самки клеща определяли плодовитость путем подсчета количества произведенных дочерей.
2.4. Статистический анализ
Данные были проанализированы с помощью статистического программного обеспечения R [48]. Для оценки вероятности повторного закрытия выводковых ячеек, удаления выводковых ячеек и успешного размножения клещей в четырех группах были реализованы модели логистической регрессии со смешанным эффектом с использованием пакета lme4 [49]. Каждая клетка рассматривалась как независимая единица выборки. Укупорка клеток, удаление выводковых ячеек и успешное размножение клещей рассматривались как факторы ответа с биномиальным распределением (1 в случае, если событие произошло, 0 в случае, если событие не произошло). Группа обработки рассматривалась как фиксированная объясняющая переменная, а идентичность колонии — как случайная. Кроме того, для возможности сравнения во времени (три года; сбор данных Panziera et al. [20]: 2015 г.; данный набор данных: 2018), расчетные вероятности размножения клещей и удаления расплодных ячеек, полученные для обработанных клещей, заражающих отобранных и обработанных пчел, сравнивались с данными, представленными в Panziera et al. [20]. Для этого были запущены модели логистической регрессии со смешанным эффектом, в которых размножение клещей или удаление расплода рассматривалось как переменная ответа, а год — как фиксированный эффект, а идентичность колонии — как случайный.
Для сравнения выбранных параметров между группами, рассматриваемыми в каждой модели, были рассчитаны скорректированные средние пропорции и парные сравнения (метод Tukey HSD) с использованием пакета emmeans [50]. Наконец, поскольку размер выборки не позволял идеально сходиться в полностью разработанной модели, среднее число дочерей, произведенных клещами-подкидышами (т.е. плодовитость) в четырех группах сравнивали с помощью тестов Крускалла-Уоллиса, а затем парных тестов Вилкоксона в сочетании с поправками Бонферрони для обеспечения коррекции после множественных сравнений.
Результаты
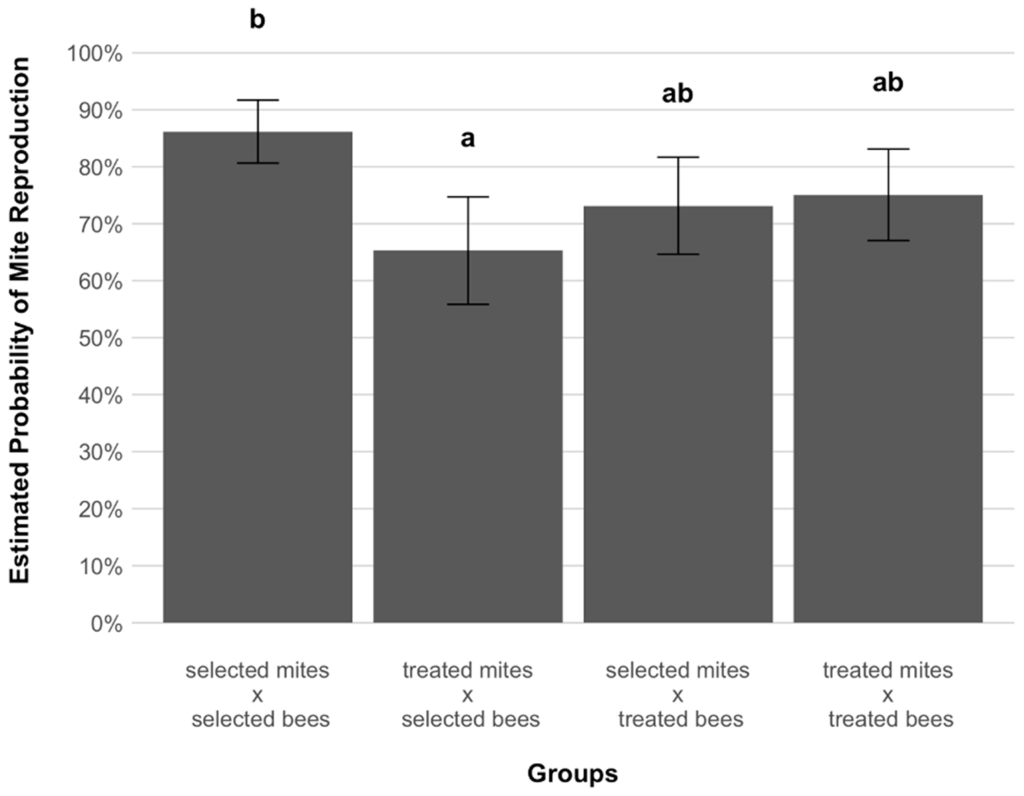
В общей сложности 507 ячеек были заселены живыми основательницами и использованы для анализа (табл. 1). После осмотра в ячейках, из которых расплод не был удален взрослыми рабочими, 302 находки (67,7%) оказались репродуктивными, а 113 (25,3%) — нерепродуктивными (табл. 2). Интересно, что самые высокие и самые низкие вероятности размножения были обнаружены, когда клещи заражали выводок выбранной линии (Рисунок 1): значительно более высокая вероятность размножения была обнаружена для клещей выбранной линии по сравнению с клещами из обработанных колоний (GLMM, p = 0,009, Рисунок 1). В отличие от этого, при заражении расплода обработанных колоний существенной разницы в вероятности размножения между двумя группами клещей не наблюдалось (GLMM, p = 0,98, рис. 1). Более того, когда расчетные вероятности размножения клещей, заражающих отобранные и обработанные колонии, сравнивались с данными, полученными в работе Panziera et al. [20], существенных различий обнаружено не было (Таблица S1, Рисунок 2).

| Группа | Ячейки | Ячейки | Ячейки | Ячейки |
| Всего | Повторное содержание | Удалено | Нетронутые | |
| № | % | % | % | |
| Отобранные клещи × отобранные медоносные пчелы | 115 | 29,6% | 17,4% | 53,0% |
| Обработанные клещи × отобранные медоносные пчелы | 135 | 23,0% | 25,2% | 51,9% |
| Выделенные клещи × обработанные пчелы | 133 | 18,0% | 19,5% | 62,4% |
| Обработанные клещи × обработанные пчелы | 124 | 32,3% | 9,7% | 58,1% |
| Всего | 507 | 25,4% | 18,1% | 56,4% |
| Группа | Всего | Репродуктивные клещи | Нерепродуктивные клещи |
| № | % | % | |
| Отобранные клещи × отобранные медоносные пчелы | 95 | 82,1% | 17,9% |
| Обработанные клещи × отобранные медоносные пчелы | 101 | 61,4% | 38,6% |
| Выделенные клещи × обработанные пчелы | 107 | 72,9% | 27,1% |
| Обработанные клещи × обработанные пчелы | 112 | 75,0% | 25,0% |
| Всего | 415 | 72,8% | 27,2% |
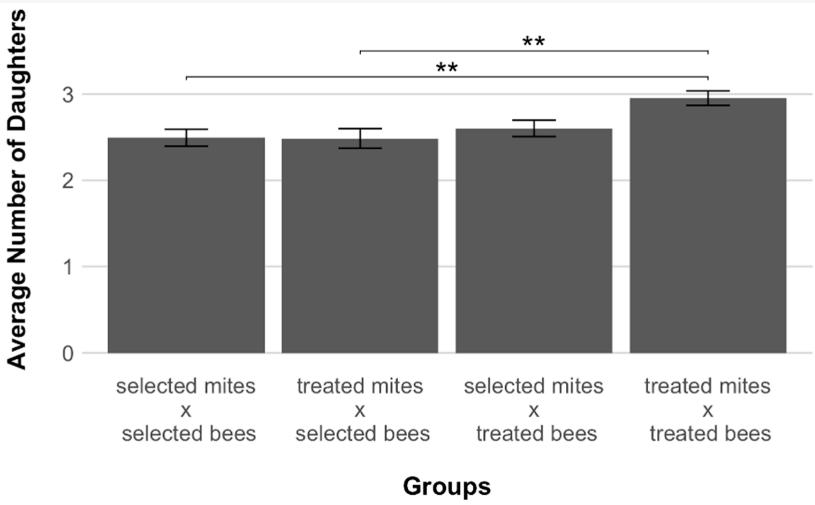
Среднее число дочерей, произведенных успешно размножившимися клещами-находками, варьировалось от минимального значения 2,48 (±0,11 SE) для обработанных клещей, заразивших расплодные ячейки отобранных пчел, до максимального значения 2,95 (±0,08 SE) для обработанных клещей, заразивших расплодные ячейки своего первоначального хозяина (Рисунок 3). При сравнении групп была обнаружена статистически значимая разница в плодовитости (тест Крускала-Уоллиса, p = 0,005, Рисунок 3). Две группы клещей, заражавших выбранную линию, произвели значительно меньше дочерей, чем группа обработанных клещей, заражавших исходного хозяина (с поправкой Бонферрони p = 0,006 и 0,009, Рисунок 3).
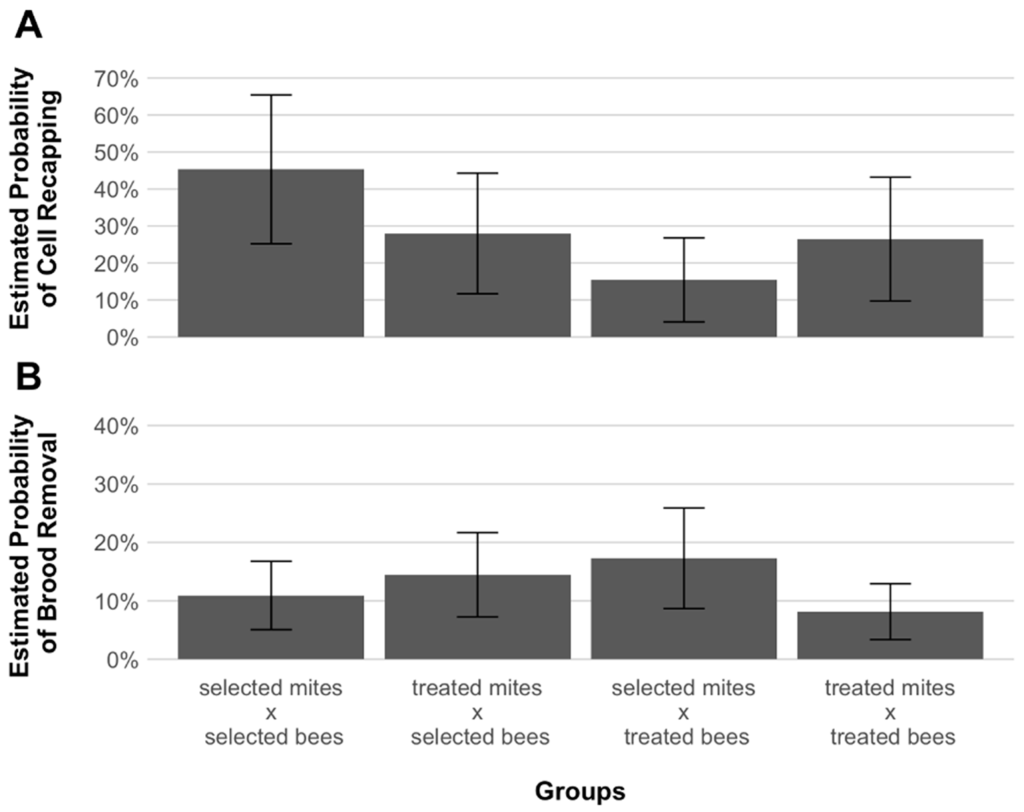
Среди зараженных ячеек расплода 129 (25,4%) были повторно закрыты, содержимое 92 (18,1%) было удалено, а 286 (56,4%) не подвергались манипуляциям со стороны взрослых пчел (Таблица 1). Расчетные вероятности повторного закрытия ячеек варьировали от максимальных 45,3% для клещей, заражающих клетки хозяев, до минимальных 15,4% для обработанных клещей, заражающих клетки выбранных хозяев (Рисунок 4). Значительных различий в оценках вероятности повторного захвата клеток между группами обнаружено не было (p = 0,072, Таблица S2). Аналогичным образом, не было обнаружено значительного влияния повторного заселения клеток на размножение клещей (p = 0,955, Таблица S3). Наконец, как самые высокие, так и самые низкие уровни вероятности удаления расплодных ячеек были обнаружены в ячейках обработанных пчел (17,3% для клещей, связанных с отбором, и до 8% для клещей, связанных с обработкой, рис. 4). Не было значительной разницы в оценках вероятности удаления расплода между различными группами (p = 0,123, Таблица S4, Рисунок 4).
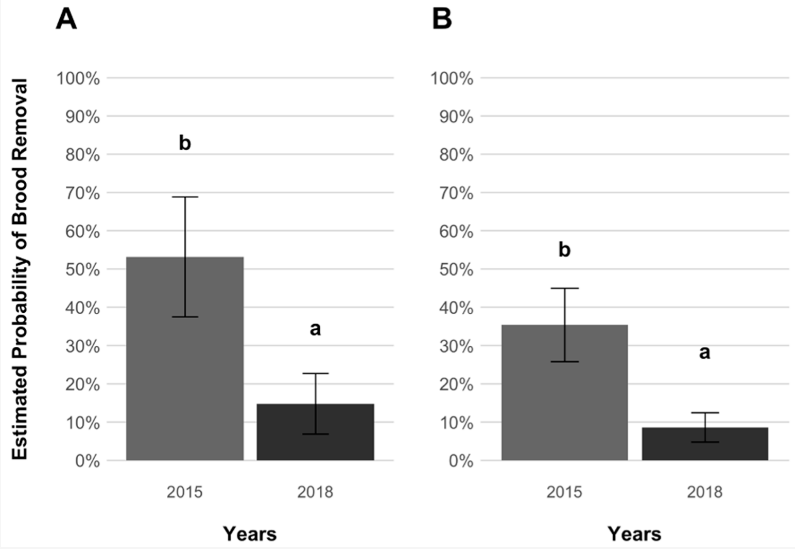
Наконец, при сравнении нынешних (2018) и более ранних (2015) вероятностей удаления расплода, полученных для ячеек, зараженных обработанными клещами, было обнаружено значительно более низкое выражение удаления расплода между нынешними данными и данными Panziera et al. [20] как для отобранных, так и для обработанных пчел в течение трех лет (GLMM, p = 0,035 и p = 0,006, Таблица S5, Рисунок 5).
4.Обсуждение
Полученные данные ясно свидетельствуют об адаптивном потенциале как хозяина, так и паразита, как предсказывает теория коэволюции [3]. Эктопаразитические клещи V. destructor, коэволюционировавшие с избранными хозяевами, представили другую репродуктивную стратегию по сравнению с некоэволюционировавшими. Более того, выжившие пчелы, очевидно, изменили свои механизмы сопротивления в течение трех лет. Клещи, коэволюционировавшие с отобранными пчелами, имели значительно более высокую вероятность успешного размножения в связанных с ними хозяевах по сравнению с клещами из обработанных колоний. Кроме того, среднее число дочерей, произведенных клещами-подкидышами из отборных пчел, заражающих своих хозяев, было значительно ниже, чем у клещей, связанных с обработанными хозяевами, на их хозяевах, что говорит о снижении вирулентности первых. Более того, клещи-подкидыши из обработанных хозяев производили значительно меньше дочерей на отборных пчелах AWD по сравнению с обработанными хозяевами, тем самым подтверждая, что отборная линия хозяев AWD эволюционировала, чтобы подавить размножение клещей. Однако ни чувствительное к варроа гигиеническое поведение, ни укупорка не могут объяснить это подавление, что позволяет предположить, что пчелы AWD снижают репродуктивный успех клещей с помощью еще неизвестных механизмов.
Предыдущие исследования выживших колоний селекции AWD использовали клещей только из обработанных колоний [20]. Для этой же группы клещей настоящие данные соответствуют ранее оцененным вероятностям успешного размножения (Таблица S1, Рисунок 2), что говорит о том, что никаких изменений в репродуктивных способностях обработанных клещей со времени предыдущего исследования не произошло. Это подтверждает идею о том, что клещам не приходится адаптироваться к хозяину из-за обработки колоний [51]. Такое сравнение недоступно для клещей, связанных с пчелами выбранной линии. Однако при рассмотрении двух групп клещей, заражавших пчел AWD в 2018 году, был обнаружен дифференциальный успех размножения, поскольку клещи, не коэволюционировавшие с пчелами AWD, имели значительно меньшую вероятность успешного размножения по сравнению с клещами, коэволюционировавшими с этим хозяином (65,3% против 86,2%, p = 0,009, рис. 1). Поскольку такой разницы в успехе не наблюдалось в двух группах клещей, заражавших обработанных хозяев (73,2% против 75,1%, p = 0,98, рис. 1), и учитывая, что такая высокая плодовитость сравнима с ожидаемой для клещей, заражавших неадаптированных хозяев [10], коэволюция могла способствовать развитию адаптивных репродуктивных стратегий у клещей, заражавших отобранные колонии, которые позволяют им успешно размножаться при заражении устойчивых хозяев.
Это увеличение вероятности размножения было связано с уменьшением числа дочерей, произведенных на одного клеща-найденыша (Рисунок 3), что согласуется с предсказанием, что варианты клещей с уменьшенным размножением будут отобраны через коэволюцию, ведущую к равновесию с новым хозяином [19]. Поскольку считается, что выживание V. destructor в исходном хозяине A. cerana связано с адаптацией репродуктивной стратегии [9], кажется правдоподобным, что снижение плодовитости в адаптированных рабочих выводковых клетках A. mellifera также может в конечном итоге повысить приспособленность клещей. Действительно, высокая плодовитость в сочетании с низкой плодовитостью, т.е. меньшим количеством потомства, оставит хозяйке больше ресурсов для инвестирования в последующие репродуктивные циклы. Поскольку меньшее количество потомства клещей, питающихся расплодом, с меньшей вероятностью вызовет реакцию хозяина, инвестирование меньшего количества яиц за репродуктивный цикл представляется адаптивным. Действительно ли клещи из колоний AWD обменивают немедленный результат на долгосрочное приспособление (производя меньше потомства за репродуктивный цикл, но проходя больше циклов в течение жизни), можно будет определить в будущих исследованиях, сравнивая пожизненный репродуктивный успех отдельных особей V. destructor при ассоциировании с отобранными и обработанными колониями хозяев A. mellifera. Наконец, учитывая, что клещи, связанные с отборными пчелами, также показали сниженную плодовитость в обработанных колониях, и что клещи, связанные с обработанными пчелами, также произвели значительно меньшее количество дочерей при заражении клеток отобранных пчел по сравнению с клетками связанного с ними хозяина (Рисунок 3), остается неясным, определяется ли плодовитость механизмами паразита или хозяина.
Многие исследования указывают на способность адаптированных к клещам медоносных пчел подавлять размножение клещей с помощью различных механизмов [21]. В последнее время среди этих механизмов в устойчивых популяциях постоянно обнаруживается повторное закрытие зараженных ячеек расплода [22,24,46]. Наши данные показывают, что вероятность размножения клещей существенно не различалась в зависимости от того, была ли ячейка запечатана или нет (Таблица S1). Более того, в колониях AWD пропорции повторной обработки были сопоставимы с пропорциями обработанных колоний (Рисунок 4). Таким образом, похоже, что колонии, отобранные для AWD, могут не полагаться на целенаправленное закрытие ячеек расплода для подавления размножения клещей, подобно другим выжившим популяциям медоносных пчел [23].
Когда рабочие медоносные пчелы проявляют чувствительное к варроа гигиеническое поведение, они откупоривают зараженные ячейки и удаляют содержащийся в них расплод [25]. Таким образом, размножение клеща неизбежно нарушается. Результаты настоящего исследования показывают, что отобранные и обработанные колонии не отличались по VSH при заражении обработанными клещами (рис. 4). Таким образом, можно сделать вывод, что подтвержденное снижение репродуктивного успеха клещей у пчел AWD также не может быть объяснено удалением зараженного расплода. Вместо этого, другие признаки устойчивости должны объяснить наблюдаемую картину заражения клещами, например, куколки трутней пчел AWD, по-видимому, препятствуют оогенезу клещей [39]. Сниженный оогенез клещей может также происходить в зараженном рабочем расплоде, так как наши данные показывают, что количество потомства, произведенного обеими группами клещей, заразивших отобранных пчел, было значительно ниже, чем у клещей, заразивших хозяев (рис. 3).
Более ранние данные [20] позволили предположить, что в 2015 году пчелы AWD полагались на чувствительную к варроа гигиену для подавления размножения клещей. Однако результаты настоящего исследования показывают, что пчелы AWD удалили значительно меньше зараженных расплодных ячеек в 2018 году по сравнению с 2015 годом. Поскольку не удаленные куколки в колониях VSH способны подавлять размножение клещей [52], а рабочие и трутневые куколки пчел AWD могут препятствовать оогенезу клещей ([39]; наши данные), предпочтение могло быть отдано менее затратным признакам устойчивости к расплоду [53,54]. Известно, что в популяциях медоносных пчел, в которых удаление зараженного расплода является основным признаком устойчивости, его выраженность зависит от сезонных условий и доступности ресурсов окружающей среды (например, нектара) [38,55], а также от доли зараженных ячеек расплода [56], что приводит к необходимости проведения многочисленных измерений для надежной оценки выраженности VSH [57]. Однако эти факторы вряд ли могут быть решающими, поскольку настоящее и предыдущее исследование [20] проводились в очень похожих экспериментальных условиях (т.е. в один и тот же сезон и в одном и том же месте с одинаковой доступностью нектара) и при эквивалентном уровне заражения клещами (Т. Блакьер, неопубликованные данные). Тем не менее, экологические факторы нельзя полностью исключить, поскольку уровень VSH в контрольных колониях, которые в меньшей степени подвергаются селективному давлению со стороны паразита, также снизился между 2015 и 2018 годами. Наконец, может быть задействована эпигенетика, то есть наследственные изменения в поведении пчел, которые не связаны с изменениями в последовательности ДНК [58]. Независимо от того, вызвано ли снижение VSH в отобранных колониях генетикой или факторами окружающей среды, произошло очевидное изменение в механизмах сопротивления, используемых против V. destructor.
Выводы
Доказательства способности клещей V. destructor адаптироваться к хозяевам A. mellifera отсутствовали. Результаты полностью скрещенного полевого эксперимента показывают, что клещи, связанные с выжившими пчелами AWD, адаптировали свою репродуктивную стратегию к этому хозяину, чтобы, возможно, противостоять еще не идентифицированным признакам устойчивости, препятствующим плодовитости клещей. Укупорка расплодных ячеек не оказала существенного влияния в настоящем исследовании, и в отобранных колониях реже наблюдалось удаление расплода по сравнению с тремя годами ранее, что говорит о важности других, пока еще не идентифицированных механизмов. Эти результаты также свидетельствуют о смене механизмов устойчивости хозяина в течение трехлетнего периода. Хотя механистические объяснения того, как клещи и пчелы адаптируются друг к другу, в настоящее время отсутствуют, эти результаты подтверждают динамическую природу коэволюции [3,37] и требуют целостного взгляда на эту конкретную систему хозяин-паразит, включая исследования признаков клещей и пчел в одних и тех же популяциях с течением времени. Такой подход необходим для того, чтобы, наконец, получить более полное механистическое понимание способности колоний A. mellifera выживать при заражении V. destructor посредством естественного отбора. Это также может открыть путь к более устойчивому пчеловодству с A. mellifera во всем мире.
Дополнительные материалы
Таблица S1: Модель логистической регрессии, использованная для оценки вероятности размножения самок клещей Varroa destructor, связанных с обработанными колониями, в экспериментально зараженных рабочих расплодных ячейках отобранных и обработанных колоний Apis mellifera из современных (2018) и более ранних данных (2015, [20]). Таблица S2: Фиксированные объясняющие переменные, использованные в модели логистической регрессии для оценки вероятности повторного заселения рабочих расплодных ячеек медоносной пчелы Apis mellifera в экспериментально зараженных ячейках четырех групп самок клещей Varroa destructor в полностью скрещенном эксперименте по заражению (selected-selected, treated-selected, selected-treated, treated-treated). Таблица S3: Фиксированные объясняющие переменные, использованные в модели логистической регрессии для оценки вероятности успешного размножения клещей Varroa destructor в экспериментально зараженных расплодных ячейках рабочих медоносных пчел Apis mellifera. Таблица S4: Модель логистической регрессии, использованная для оценки вероятности удаления расплода медоносных пчел, Apis mellifera, в экспериментально зараженных ячейках для четырех групп самок клещей (отобранные-выбранные, обработанные-обработанные, отобранные-обработанные, обработанные-обработанные). Таблица S5: Модели логистической регрессии, использованные для оценки вероятности гигиенического удаления расплода в экспериментально зараженных рабочих расплодных ячейках отобранных и обработанных колоний Apis mellifera из настоящего и предыдущего исследования [20].
Ссылки
1.Anderson, R.M.; May, R.M. Coevolution of hosts and parasites. Parasitology 1982, 85, 411–426. [Google Scholar] [CrossRef] [PubMed]
2.Thompson, J.N. The Coevolutionary Process; University of Chicago Press: Chicago, IL, USA, 1994. [Google Scholar]
3.Thompson, J.N. The Geographic Mosaic of Coevolution; University of Chicago Press: Chicago, IL, USA, 2005; ISBN 978-0-226-11869-7.
[Google Scholar]
4.Schmid-Hempel, P. Evolutionary Parasitology: The Integrated Study of Infections, Immunology, Ecology, and Genetics; Oxford University Press: Oxford, UK, 2011. [Google Scholar]
5.Woolhouse, M.E.J.; Haydon, D.T.; Antia, R. Emerging pathogens: The epidemiology and evolution of species jumps. Trends Ecol. Evol. 2005, 20, 238–244. [Google Scholar] [CrossRef] [PubMed]
6.Traynor, K.S.; Mondet, F.; de Miranda, J.R.; Techer, M.; Kowallik, V.; Oddie, M.A.Y.; Chantawannakul, P.; McAfee, A. Varroa destructor: A Complex Parasite, Crippling Honey Bees Worldwide. Trends Parasitol. 2020, 36, 592–606. [Google Scholar] [CrossRef]
7.Oldroyd, B.P. Coevolution while you wait: Varroa jacobsoni, a new parasite of western honeybees. Trends Ecol. Evol. 1999, 14, 312–315.
[Google Scholar] [CrossRef]
8.Page, P.; Lin, Z.; Buawangpong, N.; Zheng, H.; Hu, F.; Neumann, P.; Chantawannakul, P.; Dietemann, V. Social apoptosis in honey bee superorganisms. Sci. Rep. 2016, 6, 27210. [Google Scholar] [CrossRef][Green Version]
9.Rath, W. Co-adaptation of Apis cerana Fabr. and Varroa jacobsoni Oud. Apidologie 1999, 30, 97–110. [Google Scholar] [CrossRef][Green Version]
10.Rosenkranz, P.; Aumeier, P.; Ziegelmann, B. Biology and control of Varroa destructor. J. Invert. Pathol. 2010, 103, S96–S119.
[Google Scholar] [CrossRef]
11.Jaffé, R.; Dietemann, V.; Allsopp, M.H.; Costa, C.; Crewe, R.M.; Dall’Olio, R.; De La Rúa, P.; El-Niweiri, M.A.A.; Fries, I.; Kezic, N.; et al. Estimating the Density of Honeybee Colonies across Their Natural Range to Fill the Gap in Pollinator Decline Censuses. Conserv. Biol. 2010, 24, 583–593.
[Google Scholar] [CrossRef][Green Version]
12.Kraus, B.; Page, R.E. Effect of Varroa jacobsoni (Mesostigmata: Varroidae) on feral Apis mellifera (Hymenoptera: Apidae) in California. Environ. Entomol. 1995, 24, 1473–1480. [Google Scholar] [CrossRef]
13.Moritz, R.F.A.; Kraus, F.B.; Kryger, P.; Crewe, R.M. The size of wild honeybee populations (Apis mellifera) and its implications for the conservation of honeybees. J. Insect Conserv. 2007, 11, 391–397. [Google Scholar] [CrossRef][Green Version]
14.Neumann, P.; Carreck, N.L. Honey bee colony losses. J. Apic. Res. 2010, 49, 1–6. [Google Scholar] [CrossRef][Green Version]
15.Locke, B. Natural Varroa mite-surviving Apis mellifera honeybee populations. Apidologie 2016, 47, 467–482.
[Google Scholar] [CrossRef][Green Version]
16.Fries, I.; Imdorf, A.; Rosenkranz, P. Survival of mite infested (Varroa destructor) honey bee (Apis mellifera) colonies in a Nordic climate. Apidologie 2006, 37, 564–570. [Google Scholar] [CrossRef][Green Version]
17.Le Conte, Y.; de Vaublanc, G.; Crauser, D.; Jeanne, F.; Rousselle, J.-C.; Bécard, J.-M. Honey bee colonies that have survived Varroa destructor. Apidologie 2007, 38, 566–572. [Google Scholar] [CrossRef][Green Version]
18.Oddie, M.; Dahle, B.; Neumann, P. Norwegian honey bees surviving Varroa destructor mite infestations by means of natural selection. PeerJ 2017, 5, e3956. [Google Scholar] [CrossRef] [PubMed][Green Version]
19.Seeley, T.D. Honey bees of the Arnot Forest: A population of feral colonies persisting with Varroa destructor in the northeastern United States. Apidologie 2007, 38, 19–29. [Google Scholar] [CrossRef]
20.Panziera, D.; van Langevelde, F.; Blacquière, T. Varroa sensitive hygiene contributes to naturally selected varroa resistance in honey bees. J. Apic. Res. 2017, 56, 635–642. [Google Scholar] [CrossRef][Green Version]
21.Mondet, F.; Beaurepaire, A.; McAfee, A.; Locke, B.; Alaux, C.; Blanchard, S.; Danka, B.; Le Conte, Y. Honey bee survival mechanisms against the parasite Varroa destructor: A systematic review of phenotypic and genomic research efforts. Int. J. Parasitol. 2020, 50, 433–447.
[Google Scholar] [CrossRef]
22.Oddie, M.; Büchler, R.; Dahle, B.; Kovacic, M.; Le Conte, Y.; Locke, B.; de Miranda, J.R.; Mondet, F.; Neumann, P. Rapid parallel evolution overcomes global honey bee parasite. Sci. Rep. 2018, 8, 7704. [Google Scholar] [CrossRef][Green Version]
23.Beaurepaire, A.; Sann, C.; Arredondo, D.; Mondet, F.; Le Conte, Y. Behavioral Genetics of the Interactions between Apis mellifera and Varroa destructor. Insects 2019, 10, 299. [Google Scholar] [CrossRef][Green Version]
24.Martin, S.J.; Hawkins, G.P.; Brettell, L.E.; Reece, N.; Correia-Oliveira, M.E.; Allsopp, M.H. Varroa destructor reproduction and cell re-capping in mite-resistant Apis mellifera populations. Apidologie 2019. [Google Scholar] [CrossRef][Green Version]
25.Harris, J.W. Bees with Varroa Sensitive Hygiene preferentially remove mite infested pupae aged ≤ five days post capping. J. Apic. Res. 2007, 46, 134–139. [Google Scholar] [CrossRef]
26.Eliash, N.; Mikheyev, A. Varroa mite evolution: A neglected aspect of worldwide bee collapses? Curr. Opin. Insect Sci. 2020, 39, 21–26.
[Google Scholar] [CrossRef] [PubMed]
27.Garrido, C.; Rosenkranz, P. The reproductive program of female Varroa destructor mites is triggered by its host, Apis mellifera. Exp. Appl. Acarol. 2003, 31, 269–273. [Google Scholar] [CrossRef] [PubMed]
28.Solignac, M.; Cornuet, J.; Vautrin, D.; Le Conte, Y.; Anderson, D.; Evans, J.; Cros-Arteil, S.; Navajas, M. The invasive Korea and Japan types of Varroa destructor, ectoparasitic mites of the Western honeybee (Apis mellifera), are two partly isolated clones. Proc. R. Soc. B 2005, 272, 411–419.
[Google Scholar] [CrossRef][Green Version]
29.González-Cabrera, J.; Rodríguez-Vargas, S.; Davies, T.G.E.; Field, L.M.; Ellis, J.D.; Krieger, K.; Williamson, M.S. Novel Mutations in the Voltage-Gated Sodium Channel of Pyrethroid-Resistant Varroa destructor Populations from the Southeastern USA. PLoS ONE 2016, 11, e0155332.
[Google Scholar] [CrossRef][Green Version]
30.Martin, S.J. Acaricide (pyrethroid) resistance in Varroa destructor. Bee World 2004, 85, 67–69. [Google Scholar] [CrossRef]
31.Milani, N. The resistance of Varroa jacobsoni Oud. to acaricides. Apidologie 1999, 30, 229–234. [Google Scholar] [CrossRef]
32.Spreafico, M.; Eördegh, F.R.; Bernardinelli, I.; Colombo, M. First detection of strains of Varroa destructor resistant to coumaphos. Results of laboratory tests and field trials. Apidologie 2001, 32, 49–55. [Google Scholar] [CrossRef][Green Version]
33.Beaurepaire, A.L.; Moro, A.; Mondet, F.; Le Conte, Y.; Neumann, P.; Locke, B. Population genetics of ectoparasitic mites suggest arms race with honeybee hosts. Sci. Rep. 2019, 9, 11355. [Google Scholar] [CrossRef]
34.Aumeier, P.; Rosenkranz, P. Scent or movement of Varroa destructor mites does not elicit hygienic behaviour by Africanized and Carniolan honey bees. Apidologie 2001, 32, 253–263. [Google Scholar] [CrossRef][Green Version]
35.Fries, I.; Bommarco, R. Possible host-parasite adaptations in honey bees infested by Varroa destructor mites. Apidologie 2007, 38, 525–533. [Google Scholar] [CrossRef]
36.Woolhouse, M.E.J.; Webster, J.P.; Domingo, E.; Charlesworth, B.; Levin, B.R. Biological and biomedical implications of the co-evolution of pathogens and their hosts. Nature Genet. 2002, 32, 569–577. [Google Scholar] [CrossRef] [PubMed][Green Version]
37.Penczykowski, R.M.; Laine, A.-L.; Koskella, B. Understanding the ecology and evolution of host-parasite interactions across scales. Evol. Appl. 2016, 9, 37–52. [Google Scholar] [CrossRef]
38.Spivak, M.; Gilliam, M. Hygienic behaviour of honey bees and its application for control of brood diseases and varroa: Part II. Studies on hygienic behaviour since the Rothenbuhler era. Bee World 1998, 79, 169–186. [Google Scholar] [CrossRef]
39.Broeckx, B.J.G.; De Smet, L.; Blacquière, T.; Maebe, K.; Khalenkow, M.; Van Poucke, M.; Dahle, B.; Neumann, P.; Bach Nguyen, K.; Smagghe, G.; et al. Honey bee predisposition of resistance to ubiquitous mite infestations. Sci. Rep. 2019, 9, 7794. [Google Scholar] [CrossRef][Green Version]
40.Kruitwagen, A.; van Langevelde, F.; van Dooremalen, C.; Blacquière, T. Naturally selected honey bee ( Apis mellifera) colonies resistant to Varroa destructor do not groom more intensively. J. Apic. Res. 2017, 56, 354–365. [Google Scholar] [CrossRef][Green Version]
41.Remnant, E.J.; Shi, M.; Buchmann, G.; Blacquière, T.; Holmes, E.C.; Beekman, M.; Ashe, A. A Diverse Range of Novel RNA Viruses in Geographically Distinct Honey Bee Populations. J. Virol. 2017, 91, e00158-17. [Google Scholar] [CrossRef][Green Version]
42.Blacquière, T.; Boot, W.; Calis, J.; Moro, A.; Neumann, P.; Panziera, D. Darwinian black box selection for resistance to settled invasive Varroa destructor parasites in honey bees. Biol. Invasions 2019, 21, 2519–2528. [Google Scholar] [CrossRef][Green Version]
43.Büchler, R.; Costa, C.; Hatjina, F.; Andonov, S.; Meixner, M.D.; Conte, Y.L.; Uzunov, A.; Berg, S.; Bienkowska, M.; Bouga, M.; et al. The influence of genetic origin and its interaction with environmental effects on the survival of Apis mellifera L. colonies in Europe. J. Apic. Res. 2014, 53, 205–214. [Google Scholar] [CrossRef][Green Version]
44.Gregorc, A.; Planinc, I. Acaricidal effect of oxalic acid in honeybee (Apis mellifera) colonies. Apidologie 2001, 32, 333–340.
[Google Scholar] [CrossRef][Green Version]
45.Dietemann, V.; Nazzi, F.; Martin, S.J.; Anderson, D.L.; Locke, B.; Delaplane, K.S.; Wauquiez, Q.; Tannahill, C.; Frey, E.; Ziegelmann, B.; et al. Standard methods for varroa research. J. Apic. Res. 2013, 52, 1–54. [Google Scholar] [CrossRef][Green Version]
46.Harris, J.W.; Danka, R.G.; Villa, J.D. Changes in Infestation, Cell Cap Condition, and Reproductive Status of Varroa destructor (Mesostigmata: Varroidae) in Brood Exposed to Honey Bees With Varroa Sensitive Hygiene. Ann. Entom. Soc. Amer. 2012, 105, 512–518. [Google Scholar] [CrossRef]
47.Martin, S.J. Ontogenesis of the mite Varroa jacobsoni Oud. in worker brood of the honeybee Apis mellifera L. under natural conditions. Exp. Appl. Acarol. 1994, 18, 87–100. [Google Scholar] [CrossRef]
48.R Core Team. R: A Language and Environment for Statistical Computing 2018. Available online: https://www.R-project.org (accessed on 29 November 2020).
49.Bates, D.; Mächler, M.; Bolker, B.; Walker, S. Fitting Linear Mixed-Effects Models Using lme4. J. Stat. Softw. 2015, 67, 1–48.
[Google Scholar] [CrossRef]
50.Lenth, R. Emmeans: Estimated Marginal Means, aka Least-Squares Means. 2020. Available online: https://cran.opencpu.org/web/packages/emmeans/emmeans.pdf (accessed on 29 November 2020).
51.Neumann, P.; Blacquière, T. The Darwin cure for apiculture? Natural selection and managed honeybee health. Evol. Appl. 2017, 10, 226–230. [Google Scholar] [CrossRef]
52.Ibrahim, A.; Spivak, M. The relationship between hygienic behavior and suppression of mite reproduction as honey bee (Apis mellifera) mechanisms of resistance to Varroa destructor. Apidologie 2006, 37, 31–40. [Google Scholar] [CrossRef][Green Version]
53.Spivak, M.; Danka, R.G. Perspectives on hygienic behavior in Apis mellifera and other social insects. Apidologie 2020. [Google Scholar] [CrossRef]
54.Vandame, R.; Morand, S.; Colin, M.-E.; Belzunces, L.P. Parasitism in the social bee Apis mellifera: Quantifying costs and benefits of behavioral resistance to Varroa destructor mites. Apidologie 2002, 33, 433–445. [Google Scholar] [CrossRef]
55.Uzunov, A.; Costa, C.; Panasiuk, B.; Meixner, M.; Kryger, P.; Hatjina, F.; Bouga, M.; Andonov, S.; Bienkowska, M.; Conte, Y.L.; et al. Swarming, defensive and hygienic behaviour in honey bee colonies of different genetic origin in a pan-European experiment. J. Apic. Res. 2014, 53, 248–260. [Google Scholar] [CrossRef][Green Version]
56.Vandame, R.; Colin, M.-E.; Morand, S.; Otero-Colina, G. Levels of compatibility in a new host-parasite association: Apis mellifera/Varroa jacobsoni. Can. J. Zool. 2000, 78, 2037–2044. [Google Scholar] [CrossRef]
57.Villa, J.D.; Danka, R.G.; Harris, J.W. Repeatability of measurements of removal of mite-infested brood to assess Varroa Sensitive Hygiene. J. Apic. Res. 2017, 56, 631–634. [Google Scholar] [CrossRef]
58.Herb, B.R.; Wolschin, F.; Hansen, K.D.; Aryee, M.J.; Langmead, B.; Irizarry, R.; Amdam, G.V.; Feinberg, A.P. Reversible switching between epigenetic states in honeybee behavioral subcastes. Nat. Neurosci. 2012, 15, 1371–1373. [Google Scholar] [CrossRef] [PubMed][Green Version]

Добавить комментарий