Аннотация
Хотя нектар потребляется, главным образом в качестве дополнительного корма, широким кругом насекомых, охватывающим по меньшей мере пять порядков, его переработкой и хранением занимается лишь небольшое число видов, большинство из которых — пчелы и осы из надсемейства Apoidea. В этой группе Apis mellifera выработал замечательные адаптации, облегчающие переработку и хранение нектара; при этом этот вид использует конечный продукт — мед — для выполнения различных функций, аналогов которым практически нет у других насекомых-фитофагов. Мед и его фитохимические компоненты, некоторые из которых, вероятно, происходят из прополиса, имеют функциональное значение в защите медоносных пчел от микробных патогенов, токсинов и холодового стресса, а также в регулировании развития и продолжительности жизни взрослых особей. Отличительные свойства меда A. mellifera возникли многими путями, включая модификацию генома, партнерство с микробными симбионтами и эволюцию специализированного поведения, включая добычу других веществ, помимо нектара. Тот факт, что при производстве меда у A. mellifera используются не только нектар, но и эндогенные продукты, такие как антимикробные пептиды и маточное молочко, говорит о том, что рассматривать мед как источник углеводов для пчел — это концепция, нуждающаяся в пересмотре.
ВВЕДЕНИЕ
Среди 200 000 видов животных, выполняющих роль опылителей (101), лишь небольшая часть питается исключительно цветочными ресурсами на протяжении всего жизненного цикла из-за экологических и физиологических проблем, связанных с потреблением этой пищи. Специализация на потреблении цветочной пищи, особенно нектара, достигла вершины у Apis mellifera, западной медоносной пчелы, достигнув набора необычных адаптаций, включающих как переработку, так и хранение пищи. Биологически активные компоненты меда, помимо сахаров, вносят существенный вклад в здоровье пчел в различных контекстах, которые, в силу уникальной природы многолетней эусоциальности и связанной с ней переработки и хранения пищи, не имеют аналогов у обычных травоядных или даже у других флоровидных (питающихся цветами) перепончатокрылых. Однако вопрос о том, как эволюционировал этот набор адаптаций, остается открытым.
ФИЗИОЛОГИЧЕСКИЕ И ЭКОЛОГИЧЕСКИЕ ПРОБЛЕМЫ НЕКТАРОЯДЕНИЯ
Нектар — это ткань растения, у которой нет никакой известной функции, кроме вознаграждения мутуалистов; поэтому в литературе он долгое время считался химически безвредным, привлекательным для самого широкого круга потребителей среди цветочных вознаграждений (60). Не обладая значительным количеством белка, цветочный нектар не может служить полноценным источником питания для мутуалистов, и не существует известных животных, питающихся нектаром, которые в течение своего жизненного цикла не потребляли бы и другие богатые белком или липидами материалы. Пыльца часто является основным источником белка для нектароядных, но альтернативными источниками белка являются ткани растений, грибы, другие членистоногие (особенно на личиночных стадиях) и кровь позвоночных на взрослых стадиях.
Помимо питания, основной проблемой для организмов, зависящих от нектара, является то, что как источник пищи он непредсказуем — временной эфемерен, пространственно изменчив и фитохимически идиосинкразичен (1, 108). Фитохимические вещества опосредуют взаимодействие растений с другими организмами; что касается нектара и пыльцы, фитохимические вещества влияют на взаимодействие как с мутуалистами (например, опылителями), так и с антагонистами (например, похитителями нектара). В сравнительном анализе фитохимических веществ нектара и пыльцы Палмер-Янг и др. (115) обнаружили, что оба типа тканей часто содержат флавоноиды (с преобладанием гликозидов кверцетина и каемпферола), фенольные вещества (особенно фенилпропаноиды), терпеноиды и алкалоиды. Химический состав нектара и пыльцы различается как качественно, так и количественно: в пыльце содержание химических веществ на 63% выше, чем в нектаре, а в пыльце — от 24-кратного до 235-кратного. Химический состав нектара демонстрировал большую изменчивость в пределах участка и сорта, чем химический состав пыльцы.
Будучи легкоусвояемым источником углеводной энергии, нектар уязвим для кражи неуместными цветочными посетителями, которые потребляют нектар, не оказывая услуг по опылению, или микробами, которые упреждают его использование опылителями, ухудшая его качество. Медоносные пчелы, например, избегают нектара, содержащего определенные бактериальные сообщества (61, 74). Многие фитохимические вещества нектара, особенно фенольные и алкалоиды, являются антимикробными (1, 108) и могут защищать от микробного изменения качества. Кроме того, алкалоиды, фенольные и другие фитохимические вещества могут защищать нектар от нежелательных посетителей-животных, действуя как сдерживающие факторы (143). Помимо отпугивания нектарных воров или грабителей, ограничение размера пищи даже эффективных опылителей может в некоторых случаях принести пользу растению, побуждая их покинуть растение и возобновить кормежку на других цветках-конспецификах, увеличивая возможности перекрестного оплодотворения (105).
РЕШЕНИЯ МЕДОНОСНОЙ ПЧЕЛЫ ДЛЯ ПОТРЕБЛЕНИЯ НЕКТАРА
Создание меда A. mellifera в качестве формы хранения нектара позволяет обойти или свести к минимуму проблемы непредсказуемости, эфемерности, подверженности микробному загрязнению и фитохимической изменчивости. В процессе эволюции возникло несколько характерных форм поведения, некоторые из которых могут быть уникальными для видов Apis, которые облегчают превращение нектара (и других богатых углеводами продуктов) в мед. Будучи эусоциальным видом, A. mellifera использует рабочую силу из высокомобильных взрослых особей для сбора нектара по мере его поступления в ландшафт, используя сложную коммуникацию для информирования сородичей о местонахождении и качестве источников нектара (35). Обычно особи начинают добывать корм через две-три недели после всходов, в основном пыльцу и нектар. Нектар, обычно представляющий собой разбавленный раствор сахаров, является основным сырьевым ингредиентом меда, хотя собираются и используются и другие богатые углеводами продукты, включая медовую росу гомоптеринов и, в последнее время, конфеты, газировку и другие продукты питания человека (121). Возвращающиеся фуражиры переносят нектар с поля в свой урожай (медовый желудок), в это время начинается ферментативная переработка (107, 147), и, возвращаясь в улей, они выбрасывают содержимое ожидающим сородичам. Группа гнездовых рабочих (пчелы, принимающие нектар или хранящие пищу) продолжает переработку нектара, способствуя удалению воды: каждая особь всасывает и срыгивает нектар на свой хоботок, тем самым увеличивая площадь его поверхности и ускоряя испарение. Другие рабочие еще больше способствуют испарению, размахивая крыльями для усиления циркуляции внутри улья (35).
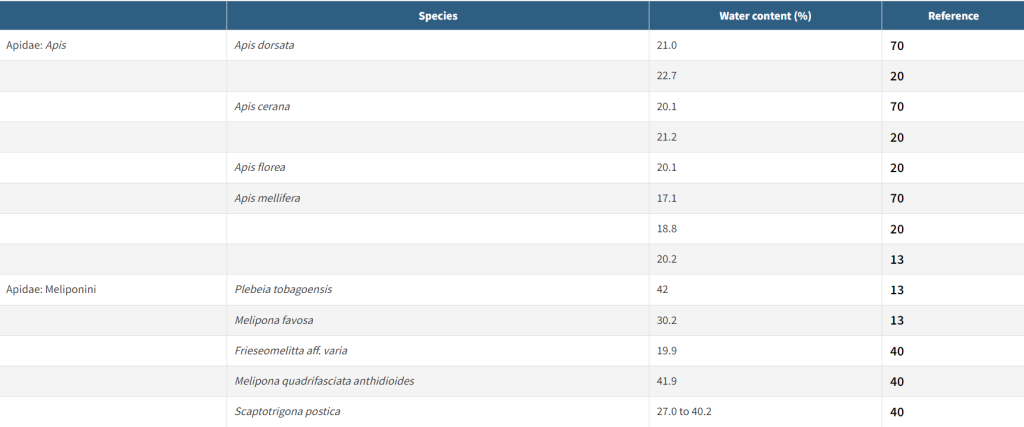
Активное испарение снижает содержание воды в нектаре примерно с 80-90% до 50-60%; затем этот более концентрированный раствор помещается в ячейки и периодически перемещается, пассивно обезвоживаясь до достижения конечной концентрации 18-25%, после чего ячейка укупоривается. Высокая концентрация сахара делает зрелый мед гигроскопичным, а в виде перенасыщенного раствора сахара он неблагоприятен для роста микроорганизмов (39). Среди видов Apis средняя влажность меда у A. mellifera несколько ниже, чем у ее сородичей. Аналогично, мед безжалостных пчел (Meliponini) обычно имеет более высокое содержание влаги, чем мед, произведенный симпатрическими видами A. mellifera (Таблица 1).
Помимо поведения, в биохимической переработке нектара в мед участвует особый набор ферментов. По мере концентрации нектара пчелы добавляют ферменты для метаболизма компонентов нектара. Активность сукразы — расщепление дисахарида сахарозы на составляющие его моносахариды глюкозу и фруктозу — позволяет пчелам получить перенасыщенный раствор, увеличивая количество растворителей в объеме жидкости. Это, в свою очередь, повышает осмолярность меда и его микробную токсичность; микробы, которые не являются осмотолерантными, могут погибнуть в результате плазмолиза и экзосмоса. Также в переработке нектара в мед участвует глюкозооксидаза (GOX), которая, окисляя глюкозу с образованием глюконовой кислоты и перекиси водорода, защищает мед от микробной деградации, понижая pH и стерилизуя среду путем образования свободных гидроксильных радикалов и последующего окисления бактериальной ДНК, мембранных липидов и белков (85).
Поскольку нектары, а значит и мед, могут содержать значительное количество потенциально токсичных фитохимических веществ, опосредованная ферментами детоксикация фитохимических веществ является необходимым условием для использования продуктов питания на основе нектара. У A. mellifera основными ферментами первой фазы детоксикации ксенобиотиков являются монооксигеназы цитохрома P450 (P450) (11). Однако некоторая детоксикация может происходить пассивно. По мере созревания меда в улье он подвергается воздействию температуры в улье, поддерживаемой в диапазоне 35°C; содержание фенолов в нектаре Aloe littoralis значительно снижается с 0,65% до 0,49% после воздействия этих температур в улье Apis cerana в течение 24 часов (86), что позволяет предположить, что виды Apis могут обладать определенной способностью готовить мед, чтобы сделать его менее химически опасным.
Вода и растительные смолы также участвуют в производстве и использовании меда. Некоторая часть фуражиров собирает воду и временно хранит ее для различных целей, включая не только испарительное охлаждение (113), но и разбавление меда; из-за высокой вязкости мед обычно должен быть разбавлен пчелами-кормилицами для кормления личинок и взрослых особей, особенно зимой. Что касается смол, то некоторые кормилицы собирают их для переработки в прополис — антимикробную смесь, которая в диких колониях покрывает практически все внутренние поверхности гнезда (образуя прополисную оболочку) (141). Хотя источники растительной смолы широко варьируются, медоносные пчелы проявляют явные предпочтения к определенным видам растений (и даже хемотипам внутри вида) (44). Прополис долгое время считался структурным агентом, обеспечивающим прочность клеточных стенок, а также противомикробным средством (125), но химическая избирательность сборщиков смолы предполагает, что пчелы различают источники смолы по их биологической активности (44).
Среди основных фитохимических веществ, обнаруженных в меде в северных широтах — пинобанксин, пиноцембрин, кверцетин, хризин и галангин (72) — лишь немногие встречаются в цветочных нектарах, но все они широко распространены в прополисе. Смолы, похоже, не потребляются напрямую [Simone-Finstrom et al. (138, p. 8) утверждают: «Насколько нам известно, медоносные пчелы не потребляют прополис в естественных условиях… способ действия терапевтического эффекта прополиса на патогены колонии, вероятно, через летучие соединения… или прямой контакт»], но фитохимические вещества смолы могут быть доступны для потребления благодаря способности меда, особенно на ранних стадиях созревания в ячейках, пока он еще разбавлен, поглощать их. Водные экстракты прополиса обычно содержат много фенольных кислот, включая производные коричной кислоты (159), которые широко встречаются в меде.
Обработка пищи перед хранением с целью продления срока годности является исключительно необычным явлением среди животных. Человек, возможно, уникален тем, что участвует в различных видах переработки пищи, которые повышают ее пригодность и консистенцию для потребления, обеспечивают ее доступность в периоды дефицита, удаляют токсины, облегчают транспортировку и распределение, а также деактивируют портящиеся микробы (67). Все эти функции в той или иной степени имеют параллели в жизни пчел, делающих мед. Хотя мед имеет огромное пищевое значение как основной источник энергии для полета, терморегуляции и производства воска, его фитохимические вещества с их разнообразными биологическими свойствами, включая антимикробную активность, но не ограничиваясь ею, делают его вполне пригодным для использования в качестве функциональной пищи.
МЕД КАК ФУНКЦИОНАЛЬНАЯ ПИЩА
То, что производство меда A. mellifera включает в себя множество других материалов, помимо нектара из окружающей среды и внутренних источников, не согласуется с давним убеждением, что мед служит для пчел не более чем источником углеводов (10, 136). Как заметили Эрлер и Мориц (47, с. 391), «именно способность запасать огромное разнообразие кормовых антимикробных веществ дает колонии медоносных пчел огромное преимущество не только среди пчел-опылителей, но и перед многими другими социальными насекомыми, требующими в своем рационе животного белка. Способность запасать пищу дает медоносным пчелам возможность избирательного выбора среди разнообразия запасаемых продуктов в адаптивной зависимости от состояния здоровья их самих или колонии.» Медоносные пчелы, однако, делают больше, чем просто хранят пищу — пчелы тщательно перерабатывают нектар и пыльцу, прежде чем запастись ими.
Функциональные продукты питания определяются как продукты, которые «содержат основные питательные вещества, часто превышающие количество, необходимое для нормального поддержания, роста и развития, и/или другие биологически активные компоненты, приносящие пользу здоровью или желательные физиологические эффекты» (148, с. 52). Эта концепция, введенная в литературу по питанию человека более 30 лет назад, редко применяется к нечеловеческим видам, но, учитывая «исключительную способность колонии медоносной пчелы хранить кормовые растительные продукты в течение длительных периодов времени» (47, стр. 391), он обеспечивает теоретическую основу для понимания влияния меда на здоровье пчел, которое нелегко объяснить его питательностью, подобно тому, как термины самолечение, фармакофагия и фармакофория по-разному использовались для описания лекарственного использования непищевого растительного материала в ответ на паразитарную инфекцию или другие заболевания (47, 52). Как функциональный продукт питания, мед отличается от растительного сырья, потребляемого только в ответ на специфические стрессы, тем, что он является обычным продуктом питания, способствующим укреплению здоровья благодаря содержанию нутрицевтиков — термин, введенный в 1989 году для описания «продуктов питания или их частей, которые обеспечивают медицинские или оздоровительные преимущества, включая профилактику и лечение заболеваний» (22). Нутрицевтики рассматриваются как «набор инструментов для профилактики заболеваний» (37, стр. 876) или как «[пищевые] продукты, которые следует принимать как часть обычной диеты, чтобы получить полезные эффекты, выходящие за рамки основных питательных функций» (29, стр. 4).
Как ни странно, Сато и Мията (134) признали мед функциональным продуктом питания и источником нутрицевтиков для человека задолго до того, как возникли подозрения о его многогранной роли в здоровье медоносных пчел. Многие из тех же функциональных свойств меда, которые действуют на человека (3), вполне могли развиться в контексте укрепления здоровья пчел.
ЭВОЛЮЦИОННОЕ ПРОИСХОЖДЕНИЕ ПРОИЗВОДСТВА МЕДА У ПЧЕЛ
Адаптивная ценность переработки и хранения пищи, вероятно, оказала давление отбора на геном медоносных пчел, как и у человека (155) — резкие смены рациона могут перестроить семейства генов для более специализированных функций (например, 59). Среди адаптаций к переработке меда — кодируемая геномом активность ферментов, поэтому сравнительная геномика (71) может помочь не только восстановить эволюционную историю производства меда, но и определить, получены ли предполагаемые полезные для здоровья свойства меда из кормовых источников окружающей среды, в результате кодируемого геномом биосинтеза или от симбиотических микробных партнеров.
Медоносные пчелы относятся к надсемейству Apoidea, которое включает апоидных ос и монофилетическую линию Anthophila, насчитывающую 20 000 видов пчел (131). Апоидные осы в первую очередь являются хищниками насекомых, хотя во многих линиях встречается кормление пыльцой, а по крайней мере одна сфецида (Krombeinictus sp.) снабжает личинок пыльцой и нектаром (153). Однако, за редким исключением, все пчелы являются специализированными потребителями пыльцы и нектара, как личинки, так и взрослые особи, и хранят эти продукты в той или иной форме для будущего использования личинками (131).
Хотя примерно 85% видов пчел являются одиночными, остальные 15% демонстрируют уровни группового образа жизни от общинного гнездования до сложных эусоциальных обществ с десятками тысяч особей. Хранение нектарной пищи развивалось одновременно с хранением пыльцы. У одиночных пчел смешивание пыльцы и нектара повышает эффективность транспортировки в поле и улучшает хранение в гнезде; вместе с железистыми выделениями нектар способствует образованию связных масс пыльцевых зерен, различающихся по текстуре и размеру (106). Таким образом, хранение пыльцы обязательно предполагает хранение нектара. Почти половину провизии одиночной люцерновой пчелы Megachile rotundata составляют сахара, получаемые из нектара (25), а поскольку 20% воды в провизии поступает из нектара, рацион личинок фактически составляет 2:1 нектар:пыльца. Хранение пыльцы с нектаром может также повысить ее усвояемость; пыльцевые зерна могут активно высвобождать большинство белков и свободных аминокислот почти сразу после инкубации в растворах сахара (55). Почти полное отсутствие сахарозы в провианте пчел, срезающих листья люцерны (несмотря на ее присутствие в нектаре люцерны), позволяет предположить, что в приготовлении провианта может участвовать инвертаза или сукраза, но личность и источник фермента (ферментов), ответственного за это превращение, неизвестны.
Переход к хранению нектара независимо от хранения пыльцы потребовал дополнительных ключевых инноваций, в частности, умения конструировать контейнеры для хранения. Поскольку вода способствует росту микроорганизмов, уменьшение содержания воды и/или защита емкостей антимикробными веществами повышает перспективы долгосрочного хранения жидких или полужидких материалов. Выстилание емкостей водонепроницаемыми материалами обеспечивает механизм хранения жидкости, снижая риски утечки и сопутствующей порчи, способствуя высокой влажности в среде гнезда.
Поведение, связанное со сбором смолы, которое встречается во многих линиях как социальных, так и одиночных пчел, также могло повысить эффективность хранения пыльцы, как за счет гидроизоляции, так и за счет предотвращения микробной колонизации провианта. Смоляные пчелы из рода Megachile (Megachilidae) — это одиночные виды, которые собирают растительные смолы для облицовки входов в гнезда и камер личинок; некоторые виды, гнездящиеся в полых стеблях, также используют смолы для строительства перегородок между ячейками и закрытия полости гнезда, как и несколько одиночных видов Hylaeus (Colletidae). Сбор смолы для гидроизоляции (или, возможно, дезинфекции) может быть преадаптацией к строительству контейнеров для хранения жидкостей у социальных видов.
Производство меда или медоподобных продуктов для хранения нектара ограничено эусоциальными видами. Cardinal & Danforth (26) определили, что «эусоциальность развилась однажды у общего предка корбикулятных Apidae, продвинутая эусоциальность развилась независимо у медоносных и безжальных пчел, и… эусоциальность была утрачена у орхидных пчел». Таким образом, эта филогения предполагает, что хранение значительных количеств нектара в виде меда могло развиваться независимо у медоносных и беззубых пчел. Действительно, хотя орхидные пчелы собирают нектар и пыльцу (например, 15, 120), известно, что они не делают мед и не хранят пищу вообще. Виды Bombus имеют годовой жизненный цикл и поэтому не перерабатывают и не хранят пищу для зимовки, хотя они строят восковые медовые горшочки для кратковременного хранения пищи. У шмелей, запасающих пыльцу, рабочие особи хранят пыльцу и нектар в отдельных восковых горшочках и кормят личинок срыгиваемой смесью этих продуктов (34). Хотя жидкость в нектарниках может быть очень густой, представляет ли она собой мед, неясно. Поведенческая переработка нектара минимальна; возвращающиеся фуражиры откладывают нектар непосредственно в горшки, а не передают его птенцам для активного испарения (118), и загустевшая жидкость в горшках с медом может быть просто результатом пассивного испарения.
Апины и мелипонины демонстрируют сходство в переработке нектара для длительного хранения — например, апины хранят переработанный нектар в восковых ячейках, часто выложенных прополисом, а мелипонины хранят переработанный нектар в горшочках из пчелиного воска в сочетании с растительными смолами. Мелипониновый мед биологически активен, обладает значительными антиоксидантными и антимикробными свойствами; как и в меде A. mellifera, антиоксидантная способность мелипонинового меда коррелирует с содержанием фенолов (158). Кроме того, в гипофарингеальных железах по крайней мере одного вида мелипонинового меда была обнаружена активность сукразы (33). Однако более высокое содержание воды и более низкое содержание сахара в мелипониновом меде делает его более подверженным быстрой порче, чем мед A. mellifera, в частности, зарастанию нитчатыми грибками (9). Таким образом, они менее пригодны в качестве источника кормовых запасов для поддержания здоровья колоний. Тем не менее, переработке и хранению пищи 500 или более видов медоносов уделялось значительно меньше внимания, чем переработке и хранению пищи A. mellifera (единственной среди семи видов Apis), и кажущаяся уникальность меда A. mellifera может просто отражать пробел в знаниях, который будет трудно устранить с логистической точки зрения.
ЭНДОГЕННЫЕ ФЕРМЕНТЫ И ПЕРЕРАБОТКА НЕКТАРА У APIS MELLIFERA
Гены детоксикации в геномах пчел
Потребление пыльцы, нектара и фитохимических веществ смолы требует биохимических возможностей для переработки фитохимических веществ, содержащихся во всех этих материалах. Пыльцевые зерна содержат флавоноиды, особенно кверцетин и каемпферол, растительные сигнальные вещества, которые опосредуют прорастание пыльцы и оплодотворение (98). Многие нектары содержат эти флавонолы, и как пыльца, так и нектар могут вносить свой вклад в содержание флавонолов в меде. Нектар розмарина, Rosmarinus officinalis, например, является основным источником каемпферола в меде пчел (54). Что касается прополиса, то, хотя источники смолы отличаются по химическому составу, флавоноиды, фенольные кислоты и фенольные альдегиды встречаются часто и в большом количестве; реже встречаются кумарины, стилбены и лигнаны (133). Сырой прополис может содержать до 17% флавоноидов. В то время как прополис из умеренной зоны, в основном из тополей и их родственников, содержит большое количество флаванонов и флавонов, прополис из тропических районов, как правило, имеет другой профиль, включая пренилированные флавоноиды, пренилированные производные p-кумаровой кислоты, производные кофеоилхиновой кислоты и лигнаны.
Среди генов P450 в геноме A. mellifera, кодируемых 46 генами в геноме медоносной пчелы, гены семейств CYP6 и CYP9 участвуют в детоксикации фитохимических веществ (11). Как установлено с помощью биопробы и/или молекулярного моделирования и докинга in silico, ферменты CYP6AS метаболизируют флавонолы, включая кверцетин, который повсеместно входит в состав нектара, меда, пыльцы, пчелиного хлеба, растительных смол и прополиса (90). Размер подсемейства CYP6AS варьирует у разных видов пчел, различающихся по степени социальности: Внутрисемейное разнообразие увеличивается со степенью социальности, варьируя от 7 у одиночной юго-восточной черничной пчелы Habropoda laboriosa и факультативно эусоциальной Lasioglossum albipes до 16 у видов Apis и 17 у многолетней эусоциальной Melipona quadrifasciatus (68). Эта закономерность отражает переход от краткосрочного хранения эфемерных низкокачественных продуктов к долгосрочному хранению концентрированной переработанной пищи. Диверсификация пищевых источников флавоноидов в более концентрированной форме в течение эволюционного времени могла привести к расширению подсемейства и возможной субфункционализации для обеспечения более специализированной фитохимической детоксикации.
Глюкозооксидаза/глюкозодегидрогеназа в геномах пчел
В нектаре и пыльце превращение глюкозы в глюконовую кислоту и перекись водорода препятствует росту микроорганизмов двумя способами — снижением pH и выделением перекиси водорода. GOXs (EC 1.1.3.4) — это оксидоредуктазные ферменты, которые действуют на первую гидроксильную группу молекул глюкозы. Эти ферменты тесно связаны и практически идентичны по структуре с глюкозодегидрогеназами (ГДГ), которые также являются оксидоредуктазными ферментами, действующими на первые гидроксильные группы молекул глюкозы и других сахаров. Однако, в отличие от ГДГ, GOXs уникальны тем, что используют кислород в качестве акцептора электронов, тогда как ГДГ используют широкий спектр акцепторов электронов в качестве кофакторов, включая NAD, FAD и пирролохинолинхинон (PQQ), но не кислород (48). Таким образом, GOXs отвечают за производство H2O2
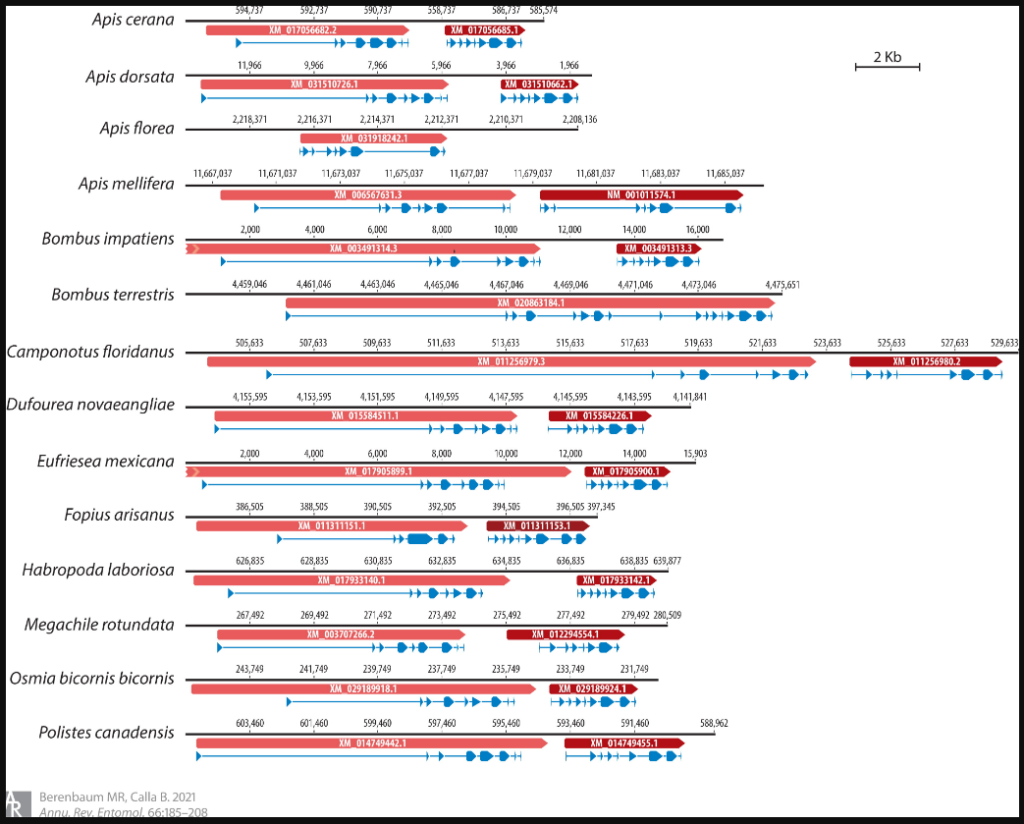
Первоначально обнаруженный в грибах, GOX был впервые найден в животном источнике в гипофарингеальных железах A. mellifera (51). Позже этот фермент был связан с антибактериальной активностью меда через производство H2O2 и D-глюконовой кислоты из глюкозы (152). Бургетт (24) сообщил об активности GOX у девяти видов социальных перепончатокрылых из трех надсемейств — Formicoidea, Vespoidea и Apoidea, предположив, что этот фермент может присутствовать у большинства социальных насекомых, хранящих мед. Геном A. mellifera содержит один функционально признанный ген GOX (GB44549 в Amel_HAv3.1), который был выделен и охарактеризован (111) и расположен непосредственно рядом с GB44548, геном, предсказуемо аннотированным как GDH. Возможно, GOX произошел от предковой оксидоредуктазы, которая производила тандем из двух GDH, один из которых в дальнейшем изменился и функционализировался в GOX (79).
Анализ геномов 14 репрезентативных видов Hymenoptera, включая двух ос, двух муравьев и четырех пчел, показывает, что тандем из двух генов оксидоредуктазы, вероятно, существовал со времен последнего общего предка этих видов, причем эти два гена всегда находились в одном и том же геномном контексте (рис. 1). Однако, за исключением генов A. mellifera, оба тандемных гена из каждого генома прогностически аннотированы как GDHs с помощью автоматического конвейера аннотаций Национального центра биотехнологической информации, и ни у одного из других видов Hymenoptera не предсказаны GOXs. Дерево максимального правдоподобия аминокислотных последовательностей этих ферментов из 14 видов, однако, четко разделяет нисходящие и восходящие последовательности во всех геномах с высокой достоверностью, группируя все нисходящие последовательности с A. mellifera GOX и все восходящие последовательности с GDH, предполагая, что GOX может присутствовать во всех этих геномах (рис. 2). Это предположение согласуется с предсказанием (24), что функция GOX присуща большинству, если не всем, насекомым, собирающим пищу и нектар. Фактически, Sommeijer и др. (140) обнаружили H2O2 в провианте добывающей пчелы Colletes halophilus, олиголектического одиночного вида; отсутствие H2O2 в пищевой пыльце позволило этим авторам предположить, что GOX производится пчелами и добавляется в провиант личинок в качестве консерванта, необходимого из-за их полужидкой природы. A. cerana и Bombus terrestris — единственные два вида с одним геном в этой области, и оба их гена относятся к линии GOX. Это расхождение может быть связано либо с пропуском стоп-кодона при предсказании гена (особенно у B. terrestris, где ген необычно длинный), либо с потерей гена GDH (возможный сценарий для A. cerana).

Выработка GOX медоносными пчелами, по-видимому, ограничена гипофарингеальными железами рабочих и высоко экспрессируется на разных стадиях развития. Экспрессия мРНК GOX прогрессивно увеличивается с возрастом, начиная с двух дней после расплода (чистильщики и медсестры) и достигая наивысшего уровня у переработчиков нектара и фуражиров. GOX очень сильно экспрессируется в гипофарингеальных железах случайно отобранных ульевых пчел, но экспрессия этого фермента не была обнаружена в нижнечелюстных железах, головных слюнных железах или слюнных железах грудной клетки (21), также GOX не экспрессируется в жировом теле медсестер через три или восемь дней после вылупления (30), в средней кишке (137) или во всем пищеварительном тракте у медсестер и фуражиров. В отличие от предыдущих результатов (79), эти исследования показали, что экспрессия GOX и соседних с ним транскриптов GDH несопоставима.
Другая точка зрения на производство глюконовой кислоты в меде (128) заключается в том, что бактерии, продуцирующие глюконовую кислоту, напрямую вносят глюконовую кислоту в мед; на сегодняшний день нет исследований, оценивающих относительный вклад эндогенных и экзогенных источников в уровень глюконовой кислоты в меде.
Инвертаза
Среди ферментов, добавляемых в нектар при его переработке в мед рабочими особями, есть сукразы, которые метаболизируют сахарозу во фруктозу и глюкозу. Поскольку сахароза является основным сахаром в большинстве нектаров, это превращение имеет решающее значение как для производства меда, так и для его функциональных свойств. Превращение сахарозы во фруктозу и глюкозу увеличивает осмотический потенциал меда, что повышает его антимикробные свойства и защищает его от порчи (тем самым продлевая срок его хранения). Сукроза отличается от других дисахаридов наличием α1-β2-гликозидной связи между двумя мономерами сахара, что делает ее одновременно α-D-глюкозидом и β-D-фруктофуранозидом, вследствие чего она является субстратом как α-глюкозидазы (ЕС 3.2.1.20, также известной как мальтаза или α-глюкозидаза), так и β-фруктозидазы (ЕС 3.2.1.26, также известной как инвертаза). Основное механистическое различие между этими двумя типами ферментов заключается в том, что дисахарид расщепляется по разные стороны от гликозидного атома кислорода (43). Из-за этого тонкого различия оба названия ферментов (т.е. инвертаза и α-глюкозидаза) используются как взаимозаменяемые для обозначения активности сукразы в секрете желез медоносной пчелы.
α-глюкозидазы (EC 3.2.1.20) широко распространены среди организмов, включая растения, грибы, бактерии, млекопитающих и насекомых. У насекомых α-глюкозидазы повсеместно присутствуют в средней кишке (145). У зрелых медоносных пчел-кормилиц гипофарингеальные железы занимают большую часть головы. Когда они превращаются в фуражиров, железы уменьшаются (154), и в уменьшенных гипофарингеальных железах была обнаружена активность сукразы (18). Кубо и др. (76) выделили приблизительно 70-килограммовый белок, избирательно синтезируемый в гипофарингеальных железах старых рабочих особей, и идентифицировали его как α-глюкозидазу; они использовали клонирование, секвенирование и RT-PCR, чтобы установить, что этот белок кодируется геном медоносной пчелы (GB43247), экспрессируемым специально в железах фуражиров и имеющим гомологию с возможной мальтазой из Aedes aegypti и Drosophila melanogaster (112). Три типа α-глюкозидазы были позже очищены из A. mellifera и из спелого меда (тип I, тип II и тип III), а иммуноблоттинг на тканях выявил α-глюкозидазу типа I в желудочке, α-глюкозидазу типа II в желудочке и гемолимфе, а α-глюкозидазу типа III только в гипофарингеальных железах и в меде. Эти три типа также имеют различные субстратные предпочтения, причем α-глюкозидаза типа III была единственной с кинетическим профилем, соответствующим деградации сахарозы (77). Мутационный анализ α-глюкозидазы A. mellifera типа III с использованием построенной in silico модели белка показал ее предпочтение сахарозы и мутации, необходимые для изменения этого предпочтения на мальтозу (99). Активная α-глюкозидаза также была очищена и охарактеризована из A. cerana indica (27).
Несмотря на широкое использование термина «инвертаза» в литературе по медоносной пчеле (например, 139), в отличие от α-глюкозидаз, в геноме A. mellifera или ее родственников нет доказательств наличия гена, кодирующего инвертазу (45). Также нет сообщений о кинетических параметрах активности сукразы во время созревания меда, которая отличается между инвертазами и α-глюкозидазами. Инвертазы (EC 3.2.1.26), также называемые β-фруктофуранозидазами, долгое время считались исключительно микроорганизмами и растениями. Это представление было опровергнуто после обнаружения генов инвертаз в геноме шелковой моли Bombyx mori (36), а затем и других видов Lepidoptera (64, 119). У B. mori этот ген, вероятно, был перенесен горизонтально от микроорганизма и обходит токсичность алкалоидных ингибиторов глюкозидазы из листьев Morus alba, имитирующих сахар, которые действуют на α-глюкозидазы средней кишки, но не на инвертазы (36). Позднее гены инвертазы были обнаружены еще у двух видов, оба из которых относятся к отряду Coleoptera: горного соснового жука (Dendoctronus ponderosa) (73) и изумрудного ясеневого жука (Agrilus planipennis) (160). То, что гены инвертазы у насекомых обычно не имеют интронов и не присутствуют у всех филогенетически близких видов, поддерживает теорию горизонтального переноса генов, хотя определенный эукариотический источник инвертазы насекомых был выявлен у Manduca sexta (119) путем демонстрации того, что последовательности генов инвертазы насекомых имеют 3′ нетранслируемую область и поли-А хвосты.
Поскольку инвертаза содержится в пчелином хлебе (75) и в протеомных анализах меда (14), существует возможность того, что созреванию меда способствует микробиом желез фуражира в рамках взаимовыгодного взаимодействия, которое может повысить эффективность переработки нектара. Харпел и др. (64) идентифицировали инвертазу в протеомном исследовании слюны другой питающейся нектаром бабочки Heliconius melpomene. Кроме того, как α-глюкозидазы широко распространены в природе, так и их ингибиторы, которые включают не только алкалоиды, но и флавоноиды растений, дрожжей и прополиса (78, 83, 122).
Помимо GOX и α-глюкозидазы, в меде регулярно обнаруживаются и другие ферменты. Давно известно о наличии амилазы (111), а также протеазы, ингибиторов сериновых протеаз и изоформ глюкозодегидрогеназы (82).
ФЕРМЕНТЫ РАСТИТЕЛЬНОГО ПРОИСХОЖДЕНИЯ: КИСЛАЯ ФОСФАТАЗА И КАТАЛАЗА
Каталаза (EC 1.11.1.6), присутствующая почти во всех живых организмах, метаболизирует перекись водорода (H2O2) до воды и молекулярного кислорода. Совместное действие каталазы с другими ферментами, поглощающими H2O2, такими как пероксидазы и супероксиддисмутаза, имеет решающее значение для защиты клеток от окислительного повреждения, вызванного повышенным уровнем H2O2. Активность каталазы в меде была задокументирована более 100 лет назад (8, 56, 62), и ее присутствие было связано с пыльцой в меде и дрожжами, связанными с медом во время созревания (56). Предполагается, что активность каталазы в различных сортах меда (16, 66, 135) позволяет поддерживать уровень H2O2, образующегося в результате деятельности GOX, на уровне ниже токсичных концентраций. Таким образом, активность H2O2 в меде напрямую связана с уровнем GOX по сравнению с уровнем каталазы. Считается, что непероксидные фитохимические компоненты вносят вклад в антимикробную активность многих медов, в первую очередь мануки (Leptospermum scoparium: Myrtaceae), которая якобы обязана своей очень высокой антимикробной активностью преобразованию дигидроксиацетона нектара в метилглиоксаль в процессе переработки (95). Вестон (149), однако, предположил, что антимикробная активность мануки обусловлена избытком H2O2 в результате низкого содержания каталазы в пыльце мануки.
Первая сборка генома A. mellifera идентифицировала белок каталазы (GB11518, AAN76688.1), но предсказанный фермент не имеет обнаруживаемого секреторного сигнала (32). Однако каталаза A. mellifera, предсказанная в последней сборке генома A. mellifera, имеет длину 597 аминокислот и содержит потенциальный секреторный сигнал, предсказанный инструментом EMBOSS 6.5.7 sigcleave. Эта особенность, однако, не является окончательным доказательством того, что фермент секретируется, поскольку предсказания расщепления сигнала с помощью этого инструмента лишь на 75-80% точны для сигнальных пептидов эукариот.
Кислые фосфатазы (EC 3.1.3.2) представляют собой семейство повсеместно распространенных гидролазных ферментов, катализирующих гидролиз моноэфиров ортофосфата в кислых условиях (23). Активность кислой фосфатазы была обнаружена в меде несколько десятилетий назад (57); хотя анализ активности в пыльце, нектаре, настоящем меде и искусственном меде позволяет предположить, что активность обусловлена ферментами растительного происхождения (5, 151), для однозначного определения происхождения кислой фосфатазы меда недостаточно информации. Ни одно исследование еще не выделило и не охарактеризовало этот фермент на уровне аминокислот. Более того, Flanjak и др. (49) не обнаружили существенных различий в средней активности кислой фосфатазы между медом черной саранчи, каштана и медовой росы, последний из которых не получают ни из нектара, ни из пыльцы. Активность диастазы и GOX, известных как пчелиные производные, также не различалась между двумя монофлорными медами и медовой росой. Исследования по разделению и идентификации белков не дали четких доказательств наличия кислых фосфатаз, которые могли бы послужить основой для их характеристики (16, 17, 42).
В геноме A. mellifera имеется по меньшей мере семь кислых фосфатаз с более чем 24 предсказанными изоформами. Как и у человека, эти кислые фосфатазы имеют разное хромосомное происхождение и обладают различной аминокислотной гомологией. У медоносных пчел можно выделить четыре группы кислых фосфатаз: ядовитая кислая фосфатаза, ядовитая кислая фосфатаза-подобная, лизосомальная кислая фосфатаза и гомолог кислой фосфатазы типа 7. Как кислотные фосфатазы в меде соотносятся с этими категориями, пока не определено.
ПРОИСХОЖДЕНИЕ АНТИОКСИДАНТОВ МЕДА И УВЕЛИЧЕНИЕ ПРОДОЛЖИТЕЛЬНОСТИ ЖИЗНИ
Фитохимический состав меда может способствовать увеличению продолжительности жизни благодаря своей антиоксидантной активности. Среди теорий старения социальных насекомых, в частности A. mellifera (7, 41), наиболее релевантной для дифференцированного долголетия рабочих особей является теория старения на основе окислительного стресса, которая утверждает, что необратимое накопление окислительных повреждений приводит к старению. В то время как различия в продолжительности жизни маток по сравнению с рабочими не зависят от экспрессии антиоксидантных генов (31), дифференциальная продолжительность жизни рабочих соответствует постулатам гипотезы окислительного стресса. Зимние пчелы живут до 24 недель во взрослом состоянии, тогда как продолжительность жизни летних фуражиров составляет три-четыре недели (7). У летних рабочих переход от работы в улье к добыче корма является центральной переменной старения медоносной пчелы, хотя хронологический возраст, независимо от поведенческого состояния, также вносит свой вклад в старение (127). С увеличением продолжительности жизни связано уменьшение количества перекисных (полиненасыщенных) жирных кислот и, соответственно, уменьшение окислительного повреждения (63).
Влияние компонентов меда на продолжительность жизни происходит через регуляцию генов, связанных с продолжительностью жизни. В нескольких исследованиях (81, 93) было показано, что потребление п-кумаровой кислоты личинками медоносных пчел повышает регуляцию вилочковой головки (FOXO) в 2,38 раза; FOXO был связан с долголетием пчел, поскольку его гомолог в Caenorhabditis elegans понижает регуляцию генов, сокращающих жизнь, и повышает регуляцию антиоксидантных ферментов (каталаза, супероксиддисмутаза) в Culex pipiens. Кроме того, FOXO у D. melanogaster при сверхэкспрессии в жировом теле увеличивает продолжительность жизни самок (53). Хризин, содержащийся как в меде, так и в прополисе (88), добавленный в рацион взрослых D. melanogaster, увеличивал среднюю продолжительность жизни самок на 12% и максимальную продолжительность жизни на 22%, но не оказывал эффекта увеличения продолжительности жизни на самцов (80). У самок мух, потреблявших рацион, в который был добавлен хризин, уровень экспрессии Hsp70 был снижен на 82% по сравнению с мухами, питавшимися без добавок. Хотя считается, что Hsp70 обладает геропротекторными свойствами, снижение уровня экспрессии Hsp70 после потребления хризина может быть биомаркером более молодого биологического возраста, учитывая, что мухи с более низким уровнем Hsp70 живут дольше, чем мухи с более высоким уровнем.
Компоненты меда могут также увеличивать продолжительность жизни непосредственно за счет своей антиоксидантной активности. Многие антиоксидантные фенолики в меде могут быть способны нейтрализовать реактивные формы кислорода, которые повреждают белки, ДНК и жирные кислоты, что приводит к гибели клеток. Антиоксидантная способность меда зависит от источника нектара; в первом исследовании, изучавшем эту взаимосвязь, Френкель и др. (50) обнаружили 20-кратные различия в антиоксидантной способности 14 монофлорных медов. Интерес к меду как к функциональному продукту питания для человека заметно возрос с признанием его антиоксидантного содержания; поиск в основной коллекции Web of Science (3 марта 2020 года) дал около 400 статей с названиями, включающими слова «антиоксидант» и «мед». Однако только 38 из них включали в качестве темы «Apis mellifera»; преобладающее число работ посвящено здоровью и питанию человека (например, 2), а значение антиоксидантной активности меда для продолжительности жизни медоносной пчелы (или каких-либо других преимуществ для здоровья) не очень хорошо известно.
Любопытно, что исследования, изучающие, может ли сам мед, а не его отдельные компоненты, увеличить продолжительность жизни, чаще проводятся на паразитоидных осах, чем на медоносных пчелах, которые его производят; большинство таких исследований направлено на улучшение массового разведения паразитоидов для биологического контроля. Харви и др. (65) сравнили признаки жизненной истории Gelis agilis (Ichneumonidae), выращенных на меде, имитаторе медового сахара или глюкозе. Самки G. agilis, потреблявшие мед, произвели в два раза больше потомства, чем те, которые выращивались на других диетах; продолжительность жизни самок сократилась только на диете, имитирующей мед с сахаром, что позволяет предположить вклад компонентов меда, помимо сахаров, в увеличение продолжительности жизни и размножения.
Влияние отдельных компонентов меда с высокой антиоксидантной способностью на продолжительность жизни взрослых пчел оценивалось чаще, чем влияние неповрежденного меда. Ляо и др. (84) провели серию анализов продолжительности жизни пчел на сахаро-казеиновой белковой диете с добавлением п-кумаровой кислоты, кверцетина и этих двух фитохимических веществ вместе. Диета с п-кумаровой кислотой увеличила продолжительность жизни на 17,6%, а диета с кверцетином — на 6,2%; однако пчелы, потреблявшие эти два фитохимиката вместе, не испытывали увеличения продолжительности жизни. Аналогичные эффекты были отмечены Вонгом и др. (156) с теми же фитохимическими веществами; пчелы, потреблявшие п-кумаровую кислоту, жили дольше, чем пчелы, потреблявшие контрольный рацион, хотя у пчел, потреблявших рацион, содержащий как п-кумаровую кислоту, так и кверцетин, продолжительность жизни сократилась. Бернклау и др. (12) продемонстрировали, что четыре фитохимических вещества — кофеин, галловая кислота, каемпферол и п-кумаровая кислота — увеличивают продолжительность жизни взрослых пчел в экологически приемлемых концентрациях. Хотя все эти фитохимические вещества встречаются в меде, кофеин распространен менее широко и известен в основном из нектара цитрусовых и кофейного дерева (157). Существует мало исследований о влиянии содержания антиоксидантов в меде на продолжительность жизни рабочих или здоровье колонии на уровне колонии.
НЕПЕРОКСИДНАЯ АНТИМИКРОБНАЯ АКТИВНОСТЬ МЕДА
В контексте здоровья человека мед давно ассоциируется с антибактериальной активностью, и его активность против патогенов человека хорошо документирована. Ингибирующий эффект был задокументирован в отношении планктонных бактерий, а мед (особенно мед манука) также может нарушать кворумное зондирование бактерий и повреждать как одновидовые, так и многовидовые биопленки (110). В течение десятилетий антимикробная активность меда объяснялась содержанием в нем H2O2. Однако за последние 30 лет были выявлены компоненты меда, полученные из фитохимических веществ, собранных в кормах, и из эндогенных секреций, которые наделяют мед антимикробными свойствами, помимо тех, которые связаны с H2O2. Среди пчелиных компонентов — пять основных белков маточного молочка (82), антимикробный пептид (AMP) гименоптаецин (46) и AMP дефенсин-1 (42). Дефенсин-1, вырабатываемый гипофарингеальными железами пчел-кормилиц, активен против Bacillus subtilis, Staphylococcus aureus и Paenibacillus larvae (американская плодожорка) (144). Белки маточного молочка, также вырабатываемые гипофарингеальной железой, составляют большинство белков, содержащихся в меде (42, 126). Самый многочисленный из них, MRJP1, производит три джеллина, AMP, которые вызывают лизис клеточной стенки и гибель бактерий и, таким образом, вероятно, ответственны за большую часть бактерицидной активности меда (19).
Что касается здоровья пчел, то анализы антимикробной активности меда против экологически значимых патогенов пчел немногочисленны. Erler & Moritz (47), например, продемонстрировали ингибирование полифлорным медом бактериальных штаммов американского фульбруса (P. larvae) и европейского фульбруса (Melissococcus plutonius), а также специфическое ингибирование штаммов подсолнечником и медом черной саранчи. Nafea и др. (100) протестировали четыре монофлорных меда [Citrus spp., клевер (Trifolium alexandrium), хлопок (Gossypin [sic] barbadens) и камфора] против американской плодожорки и обнаружили различия в эффективности, при этом клевер и хлопок показали самую высокую ингибирующую активность.
Антимикробная активность фитохимических веществ меда исторически была задокументирована в анализах с человеческими патогенами (144), поэтому ее экологическое значение для здоровья медоносных пчел не всегда ясно. Среди фитохимических веществ, связанных с антимикробной активностью, есть фенольные кислоты, флавонолы, флаваноны, флавоны и изофлавоны (110). Что касается активности фитохимических веществ меда против патогенов пчел, Бернклау и др. (12) исследовали влияние кофеина, галловой кислоты, каемпферола и п-кумаровой кислоты на взрослых пчел, зараженных микроспоридией Nosema ceranae, и сообщили, что, за исключением галловой кислоты, все они уменьшили количество спор по сравнению с контролем, особенно при низких концентрациях.
Поскольку в течение сезона пчелы производят и хранят мед из широкого спектра нектара, существует возможность того, что пчелы самостоятельно выбирают оптимальные типы меда для борьбы с микробными проблемами. Пчелы-кормилицы, зараженные микроспоридийным паразитом N. ceranae, которым был предоставлен выбор меда из одного источника (липа, черная саранча, роса, подсолнечник), избирательно потребляли подсолнечный мед, который обладал самой высокой антимикробной активностью и который, если потреблялся исключительно в пищу, снижал распространенность паразита уже через шесть дней (52). Хотя конкретные компоненты, ответственные за противогрибковые свойства, не были идентифицированы, Герман и др. (52, с. 1782) исключили сахарный профиль и вязкость и предположили, что «вполне возможно, что именно разнообразие медовых запасов способствует иммунитету колонии на уровне колонии против всего спектра патогенов, которым она подвергается». Среди флавоноидов, обнаруженных в подсолнечном меде, — пиноцембрин, пинобанксин, хризин, галангин, кверцетин и, в меньших количествах, тектохризин и каемпферол (129). Некоторые из этих соединений, по отдельности и в комбинации, проявляют выраженную противогрибковую и антибактериальную активность (132) и могут способствовать эффективности этого меда против инфекции Nosema.
В целом, противогрибковая активность меда связана с фитохимическими веществами, которые, вероятно, происходят из прополиса. Из основных фитохимических веществ, обнаруженных в меде в северных широтах — пинобанксин, пиноцембрин, кверцетин, хризин и галангин (72) — лишь немногие встречаются в цветочных нектарах. Однако все они широко распространены в прополисе (130). Основные фенольные соединения, обнаруженные в меде, являются флавоноидами и включают флавонолы (кверцетин, каемпферол, галангин), флаваноны (пиноцембрин, пинобанксин) и флавоны (хризин, лютеолин) (72, 123). Эти соединения характерны для прополиса умеренной зоны и связаны с фунгистатическими свойствами (133). Прополис из тропических регионов отличается по составу и содержит в основном пренилированные производные п-кумаровой кислоты и флавоноиды, а также производные кофеоилхиновой кислоты, также связанные с фунгистатическими свойствами (87).
Хотя известно, что прополис сам по себе не употребляется в пищу (138), тот факт, что общие компоненты прополиса встречаются в широком разнообразии медов в разных географических регионах (146), позволяет предположить, что употребление меда в пищу может представлять собой основной путь потребления пчелами соединений, получаемых из прополиса. Многие из наиболее распространенных компонентов прополиса, входящих в состав меда, растворимы в воде; кроме того, хотя прополис сам по себе отпугивает пчел, при добавлении экстракта в сахарную конфету вкусовые качества заметно повышаются, и он «охотно потребляется» (38).
ПОВЫШАЮЩАЯ ИММУНИТЕТ АКТИВНОСТЬ КОМПОНЕНТОВ МЕДА
Центральное место в гуморальном иммунитете насекомых занимают АМП, регулируемые IMD и Toll путями, которые защищают от разнообразных патогенов, включая вирусы, бактерии, грибки и простейшие (96, 116). Некоторые компоненты меда повышают уровень нескольких AMP; например, p-кумаровая кислота повышает уровень апидаецина у взрослых пчел (92) и пяти дополнительных AMP у трехдневных личинок пчел в 25 раз (93). Среди других генов иммунитета, повышаемых p-кумаровой кислотой, были LYZ, индуцированный в 1,75 раза; белок распознавания b-1,3-глюкана, повышенный в 1,68 раза; и белок распознавания пептидогликана S2, повышенный в 1,87 раза.
Палмер-Янг и др. (116) аналогичным образом показали, что шесть фитохимических веществ — амигдалин (цианогенный гликозид), анабазин, никотин (алкалоид), аукубин, каталпол (иридоидный гликозид) и тимол (терпен) — увеличивали экспрессию генов AMP от 12,9 до 61 раза у старых пчел через неделю после их употребления, причем больше всего увеличивалась экспрессия гименоптацина. Функциональное значение этой регуляции иллюстрируется снижением до 99,8% вируса деформации крыльев менее чем через сутки после употребления фитохимикатов.
Абсцизовая кислота, растительный гормон, содержится во многих видах меда. Вересковый мед (Erica spp.) содержит два изомера, цис,транс-абсцизовую кислоту и транс,транс-абсцизовую кислоту, с общей концентрацией от 2,5 до 16,6 мг/100 г меда. Оба изомера в изобилии содержатся в цветках эрики (102). Потребление абсцизовой кислоты способствует здоровью колонии несколькими способами, в том числе путем повышения эндогенного уровня ABA в организме пчел, стимулирования реакции гемоцитов на распознавание несамостоятельности, улучшения заживления ран и активации гранулоцитов и плазмоцитов, а также повышения устойчивости к пестицидам.
СОСТАВЛЯЮЩИЕ МЕДА И УСТОЙЧИВОСТЬ К ТОКСИНАМ
Было доказано, что потребление меда пчелами повышает толерантность к попадающим в организм природным и синтетическим токсинам. По сравнению с потреблением кукурузного сиропа с высоким содержанием фруктозы или сахарозы, потребление меда повышает выживаемость взрослых пчел в присутствии афлатоксина B1, микотоксина, производимого Aspergillus (109). Потребление экстрактов меда, пыльцы или прополиса повышает уровень генов CYP6AS, кодирующих ферменты, которые метаболизируют кверцетин (69, 90), и генов CYP9Q, кодирующих ферменты, которые метаболизируют кверцетин, акарициды кумафос и бифентрин (91), а также неоникотиноидные инсектициды (89).
Специфические компоненты экстракта меда, которые индуцируют экспрессию CYP9Q3 (92), включают три фенольные кислоты (кофейную, коричную и п-кумаровую), флавон (хризин), флавонол (галангин) и два флаванона (нарингенин, пиноцембрин). Фенольная кислота p-кумаровая кислота известна не только из различных видов меда, часто в качестве основного компонента [например, гречишного (117)], но и из прополиса (4). Анализ РНК-секвенирования (RNA-Seq) взрослых рабочих (92) и личинок (93) показал, что p-кумаровая кислота повышает уровень ряда генов детоксикации, включая многочисленные гены CYP6 и CYP9 у личинок и взрослых, а также гены эстераз, трансфераз и транспортеров у взрослых. В средней кишке медсестры гены CYP6AS были повышены в 1,90-3,11 раза под действием п-кумаровой кислоты, а CYP9Q3 — в 2,55 раза; в трехдневных личинках шесть генов CYP6AS были повышены в 1,9-45 раз, а шесть генов CYP9 — в 1,46-3,12 раз. В отдельном исследовании (94), RNA-Seq анализ экспрессии генов у личинок, выращиваемых в течение трех дней на диете с низким и высоким уровнем кверцетина, показал, что среди 28 генов P450 в клане CYP3 (к которому принадлежат основные детоксицирующие P450), семь были повышены обоими уровнями кверцетина, два (CYP6AS17 и CYP9R1) были повышены низким уровнем кверцетина, а четыре (CYP6AS1, CYP9Q1, CYP9Q2 и CYP9Q3) были повышены высоким уровнем кверцетина.
То, что фитохимическая регуляция этих P450 имеет функциональное значение для усиления метаболизма пестицидов, было установлено в нескольких исследованиях. Потребление п-кумаровой кислоты в диете на основе сахарозы увеличило метаболизм кумафоса в средней кишке примерно на 60% (91). Ляо и др. (84) показали увеличение продолжительности жизни взрослых пчел, потребляющих два пиретроидных пестицида в сочетании с п-кумаровой кислотой или кверцетином, а Вонг и др. (156) продемонстрировали, что оба соединения увеличивают продолжительность жизни взрослых пчел, потребляющих имидаклоприд, хотя реакция была двухфазной, с отрицательным эффектом при более высоких концентрациях. Миттон и др. (97) добавляли в рацион пчел п-кумаровую кислоту и индол-3-уксусную кислоту, чтобы определить влияние этих кислот на выживаемость взрослых пчел и их способность переносить тау-флувалинат. Добавление любого из этих соединений привело к увеличению выживаемости пчел, подвергшихся воздействию тау-флувалината, примерно на 20%, причем п-кумаровая кислота повысила активность цитохрома P450s и глутатионредуктазы у обработанных и контрольных пчел.
Помимо регуляции генов иммунитета, абсцизовая кислота (ABA) может повысить толерантность взрослых пчел к карвакролу, монотерпеноидному фенолу, используемому некоторыми пчеловодами в качестве антибактериального средства, и щавелевой кислоте, используемой пчеловодами в качестве акарицида (103). Потребление ABA только что появившимися и трехдневными пчелами-кормилицами повышало значения LC50 для щавелевой кислоты от двухкратного до 10-кратного. Поскольку добавление ABA увеличило активность каталазы на 40%, Негри и др. (103, 104) предположили, что ABA действует для снижения токсичности через усиление активности каталазы, которая может противодействовать реактивным видам кислорода, генерируемым токсинами.
КОМПОНЕНТЫ МЕДА КАК РЕГУЛЯТОРЫ РАЗВИТИЯ
Определение касты у медоносных пчел зависит от рациона питания; в то время как личинки самок, предназначенные для королевы, не получают никакой другой пищи, кроме маточного молочка (смеси железистых выделений) от пчел-кормилиц, личинки, предназначенные для рабочих, в течение первых трех дней жизни питаются желе, а затем получают желе, смешанное с медом и пчелиным хлебом. Таким образом, фитохимические вещества в этих растительных кормах способны влиять на пути развития. Добавление п-кумаровой кислоты в рацион маточного молочка во время выращивания личинок in vitro приводит к получению взрослых самок с неполным развитием яичников (93). Это торможение развития яичников может быть результатом изменения экспрессии генов под действием п-кумаровой кислоты. В сигнальном пути hippo, который участвует в регуляции размера органов, более половины из 46 генов пути были дифференциально отрегулированы у личинок, потребляющих п-кумаровую кислоту, причем 7 из 21 гена были повышены более чем в 2 раза. Также от 1,3 до 2,7 раз были повышены 14 генов, участвующих в дифференциации касты рабочих и королев; основные белки маточного молочка были понижены при потреблении р-кумаровой кислоты по сравнению с контрольной диетой (с понижением гена MRJP1, или роялактина, до 6,6 раз).
Помимо п-кумаровой кислоты, полученной из растений, в меде также содержатся растительные микроРНК (58). Чжу и др. (161) сообщили, что потребление растительных микроРНК личинками снижает скорость развития, размер яичников и размер тела и тем самым способствует развитию в рабочих особей, а не в королев, используя форму кастрации RNAi. Хотя основным источником пищевых микроРНК, по-видимому, является пыльца в пчелином хлебе, не исключен определенный вклад в регуляцию развития микроРНК, присутствующих в меде, входящем в состав пчелиного хлеба.
СОСТАВЛЯЮЩИЕ МЕДА И ВЫЖИВАНИЕ ПРИ ЗИМОВКЕ
Хранящийся мед необходим для выживания зимующих медоносных пчел в умеренном климате, и есть некоторые доказательства того, что составляющие меда, помимо углеводов, способствуют устойчивости к холоду. Дополнительный ABA повышает как врожденный иммунный ответ, так и выживаемость колоний медоносных пчел при низких температурах (25° C), которые в противном случае снижают выживаемость почти наполовину по сравнению со стандартными температурами (34° C) (102). Дополнительный ABA также ускоряет развитие личинок, испытывающих холодовой стресс, возможно, за счет повышения транскрипции Hex7b, а также вителлогенина (vg) и белка теплового шока 70 (hsp70), которые реагируют на холодовой стресс (124). Негри и др. (103) предположили, что ABA координирует стрессовые реакции, включая воздействие холода и ранение, через путь Toll.
ВЫВОДЫ И ВОЗМОЖНОСТИ БУДУЩИХ ИССЛЕДОВАНИЙ
Судя по характеру производимого ими меда, медоносные пчелы являются уникальными среди животных в своей способности перерабатывать нектар и упаковывать его для длительного хранения. Тем не менее, выявление геномных особенностей производства меда остается труднодостижимой целью, как и понимание эволюции характерного поведения и физиологических адаптаций, связанных с этим процессом. Более того, большая часть общепринятых представлений о меде не подтверждается большим количеством литературы. Оценка геномов пчел показывает, что активность, исторически приписываемая инвертазе при изготовлении меда, на самом деле может производиться α-глюкозидазой, а активность кислой фосфатазы и каталазы в некоторой степени может быть обусловлена эндогенными, а не экзогенными ферментами. Более того, хотя компоненты меда могут оказывать поразительное воздействие на поведение отдельных пчел, включая обучение и память (114), влияние таких поведенческих эффектов на уровне колонии оценивается редко, а механизмы, лежащие в основе краткосрочных поведенческих реакций, нелегко выяснить с помощью геномных инструментов.
Ограничение литературы по химии меда заключается в том, что в ней преобладают усилия по выявлению уникальных компонентов для аутентификации цветочного происхождения и попытки охарактеризовать отдельные компоненты, ответственные за определенный тип биологической активности. Таким образом, мало внимания уделяется взаимодействию между сотнями уже идентифицированных компонентов меда и потенциальным синергическим или антагонистическим эффектам между компонентами, которые могут происходить не только от цветов, но и от самих пчел, от смол растительного происхождения в прополисе и, возможно, от микробиомов, связанных с пчелами. Разнообразие биологической активности меда зависит не только от разнообразия фитохимических веществ, которые пчелы собирают из окружающей среды, но и от взаимодействия между этими фитохимическими веществами и химическими веществами нерастительного происхождения, и практически ни одно исследование не проверяло взаимодействие между этими сотнями совместно встречающихся веществ.
Понимание того, как фитохимическое разнообразие влияет на благотворное воздействие меда на здоровье как отдельных пчел, так и колонии в целом, имеет значение для будущего пчеловодства. Из-за интенсификации сельскохозяйственных монокультур, урбанизации и других форм деградации среды обитания медоносные пчелы часто не могут найти достаточное количество растительных ресурсов для процветания и, в случае необходимости, собирают и потребляют различные произведенные человеком вещества, которые резко отличаются по составу от их естественной пищи (28, 121). Более того, практика пчеловодства, которая заменяет мед сахарозой или кукурузным сиропом с высоким содержанием фруктозы во времена нехватки нектара, может повлиять на здоровье пчел, изменяя экспрессию множества генов, участвующих в метаболизме белков и снижении окисления по сравнению с медом (150). Даже если содержание сахаров в натуральной и человеческой пище одинаково, отсутствие фитохимического профиля меда может иметь последствия для поддержания иммунитета, детоксикации и терморегуляции. Поскольку сбор смолы ограничен более узким кругом растительных источников, чем нектар, отсутствие подходящих источников также может привести к потенциально дезадаптивному поведению, включая сбор асфальта для включения в прополис (6); влияние присутствия компонентов асфальта и отсутствия компонентов смолы, которые обычно включаются в мед, еще не было оценено.
В целом, мед интегрирован практически во все аспекты жизни медоносных пчел; что еще более важно, его состав способен повлиять или смягчить самые постоянные проблемы, которые поразили современное пчеловодство за последние три десятилетия — а именно, пестициды, патогены, паразиты и плохое питание. Понимание того, как медоносные пчелы используют мед в качестве функциональной пищи, может принести значительные дивиденды в улучшении здоровья медоносных пчел и дать новое понимание важности хранения пищи в социальной эволюции.
Ссылки:
1.Adler LS. 2000. The ecological significance of toxic nectar. Oikos 91:409–20
Article Locations:More AR articles citing this reference2. Ahmed S, Sulaiman SA, Baig AA, Ibrahim M, Liaqat S, et al. 2018. Honey as a potential natural antioxidant medicine: an insight into its molecular mechanisms of action. Oxid. Med. Cell. Longev. 2018:8367846
Article Location3. Ajibola A, Chamunorwa JP, Erlwanger KH. 2012. Nutraceutical values of natural honey and its contribution to human health and wealth. Nutr. Metab. 9:61
Article Location4. Aliyazıcıoglu R, Sahin H, Erturk O, Ulusoy E, Kolayli S. 2013. Properties of phenolic composition and biological activity of propolis from turkey. Int. J. Food Prop. 16:277–87
Article Location5. Alonso-Torre SR, Cavia MM, Fernández-Muiño MA, Moreno G, Huidobro JF, Sancho MT. 2006. Evolution of acid phosphatase activity of honeys from different climates. Food Chem. 97:750–55
Article Location6. Alqarni AS, Rushdi AI, Owayss AA, Raweh HS, El-Mubarak AH, Simoneit BRT. 2015. Organic tracers from asphalt in propolis produced by urban honey bees, Apis mellifera Linn. PLOS ONE 10(6):e0128311
Article Location7. Amdam GV, Omholt SW. 2002. The regulatory anatomy of honeybee lifespan. J. Theor. Biol. 216:209–28
Article Locations:More AR articles citing this reference8. Auzinger A. 1910. Über Fermente im Honig und den Wert ihres Nachweises für die Honigbeurteilung. Z. Unters. Nahr. Genußm. Gebrauchsgegenstände 19:65–83
Article Location9. Avila S, Beux MR, Ribani RH, Zambizi RC. 2018. Stingless bee honey: quality parameters, bioactive compounds, health-promotion properties and modification detection strategies. Trends Food Sci. Technol. 81:37–50
Article Location10. Azzous-Olden F, Hunt A, DeGrandi-Hoffman G. 2018. Transcriptional response of honey bee (Apis mellifera) to differential nutritional status and Nosema infection. BMC Genom. 19:628
Article Location11. Berenbaum MR, Johnson RM. 2015. Xenobiotic metabolism in honey bees. Curr. Opin. Insect Sci. 10:51–58
Article Locations:More AR articles citing this reference12. Bernklau E, Bjostad L, Hogeboom A, Carlisle A, Arathi HS. 2019. Dietary phytochemicals, honey bee longevity and pathogen tolerance. Insects 10:14–26
Article Locations:13. Bijlsma L, De Bruijn LLM, Martens EP, Sommeijer MJ. 2006. Water content of stingless bee honeys (Apidae, Meliponini): interspecfic variation and comparison with honey of Apis mellifera. Apidologie 37:480–86
14. Bocian A, Buczkowicz J, Jaromin M, Hus KK, Legáth J. 2019. An effective method of isolating honey proteins. Molecules 24:2399
Article Location15. Borrell BJ. 2007. Scaling of nectar foraging in orchid bees. Am. Nat. 169:569–80
Article Location16. Borutinskaite V, Treigyte G, Čeksteryte V, Kurtinaitiene B, Navakauskiene R. 2018. Proteomic identification and enzymatic activity of buckwheat (Fagopyrum esculentum) honey based on different assays. J. Food Nutr. Res. 57:57–69
Article Locations:17. Borutinskaitė V, Treigytė G, Matuzevičius D, Zaikova I, Čeksterytė V, et al. 2017. Proteomic analysis of pollen and blossom honey from rape seed Brassica napus L. J. Apic. Sci. 61:73–92
Article Location18. Brouwers EVM. 1982. Measurement of hypopharyngeal gland activity in the honeybee. J. Apic. Res. 21:193–98
Article Location19. Brudzynski K, Sjaarda C. 2015. Honey glycoproteins containing antimicrobial peptides, jelleins of the major royal jelly protein 1, are responsible for the cell wall lytic and bactericidal activities of honey. PLOS ONE 10:e0120238
Article Location20. Buawangpong N, Burgett M. 2019. Capped honey moisture content from four honey bee species; Apis dorsata F., Apis florea F., Apis cerana F., and Apis mellifera L. (Hymenoptera: Apidae) in northern Thailand. J. Apic. 34:157–60
21. Bucekova M, Valachova I, Kohutova L, Prochazka E, Klaudiny J, Majtan J. 2014. Honeybee glucose oxidase—its expression in honeybee workers and comparative analyses of its content and H2O2-mediated antibacterial activity in natural honeys. Naturwissenschaften 101:661–70
Article LocationMore AR articles citing this reference22. Bull E, Rapport L, Lockwood B. 2000. What is a nutraceutical? The Pharmaceutical Journal, Jul. 8. https://www.pharmaceutical-journal.com/1-what-is-a-nutraceutical/20002095.article?firstPass=false#Ref1
Article Location23. Bull H, Murray PG, Thomas D, Fraser AM, Nelson PN. 2002. Acid phosphatases. Mol. Pathol. 55:65–72
Article LocationMore AR articles citing this reference24. Burgett DM. 1974. Glucose oxidase: a food protective mechanism in social Hymenoptera. Ann. Entomol. Soc. Am. 67:545–46
Article Locations:25. Cane J, Harrison PA. 2011. Nectar and pollen sugars constituting larval provisions of the alfalfa leaf-cutting bee (Megachile rotundata) (Hymenoptera: Apiformes: Megachilidae). Apidologie 42:401–8
Article Location26. Cardinal S, Danforth BN. 2013. Bees diversified in the age of eudicots. Proc. R. Soc. B 280:20122686
Article LocationMore AR articles citing this reference27. Chanchao S, Pilalam CS, Sangvanich P. 2008. Purification and characterization of α-glucosidase in Apis cerana indica. Insect Sci. 15:217–24
Article Location28. Chandrasekaran S, Nagendran A, Krishnankutty N, Pandiaraja D, Saravanan S, Balasubramanian K. 2011. Disposed paper cups and declining bees. Curr. Sci. 101:1262
Article Location29. Chauhan B, Kumar G, Kalam N, Ansari SH. 2013. Current concepts and prospects of herbal nutraceutical: a review. J. Adv. Pharm. Technol. Res. 4:4–8
Article Location30. Corby-Harris V, Jones BM, Walton A, Schwan MR, Anderson KE. 2014. Transcriptional markers of sub-optimal nutrition in developing Apis mellifera nurse workers. BMC Genom. 15:134
Article Location31. Corona M, Hughes KA, Weaver DB, Robinson GE. 2005. Gene expression patterns associated with queen honey bee longevity. Mech. Ageing Dev. 126:1230–38
Article LocationMore AR articles citing this reference32. Corona M, Robinson GE. 2006. Genes of the antioxidant system of the honey bee: annotation and phylogeny. Insect Mol. Biol. 15:687–701
Article Location33. Costa RAC, Cruz-Landim C. 2002. Enzymes in the hypopharyngeal gland extracts from workers of Scaptotrigona postica (Hymenoptera, Apinae, Meliponini) related to food storing in the colony. Sociobiology 40:413–20
Article Location34. Couvillon MJ, Dornhaus A. 2009. Location, location, location: Larvae position inside the nest is correlated with adult body size in worker bumble-bees (Bombus impatiens). Proc. R. Soc. B 276:2411–18
Article Location35. Crane E, ed. 1975. Honey: A Comprehensive Survey. London: Heinemann
Article Locations:36. Daimon T, Taguchi T, Meng Y, Katsuma S, Mita K, Shimada T. 2008. β-fructofuranosidase genes of the silkworm, Bombyx mori: Insights into enzymatic adaptation of Β. mori to toxic alkaloids in mulberry latex. J. Biol. Chem. 283:15271–9
Article Locations:More AR articles citing this reference37. Daliu P, Santini A, Novellino E. 2018. A decade of nutraceutical patents: where are we now in 2018? Expert Opin. Ther. Patents 28:875–82
Article Location38. Damiani N, Porrini MP, Lancia P, Alvarez E, Garrido PM, et al. 2017. Effect of propolis oral intake on physiological condition of young worker honey bees, Apis mellifera L. J. Apic. Sci. 61:193–202
Article Location39. De-Melo AAM, Almeida-Muradian LB, Sancho MT, Pascual-Maté A. 2018. Composition and properties of Apis mellifera honey: a review. J. Apic. Res. 57:5–37
Article Location40. de Sousa JMB, de Souza EL, Marques G, de Toledo Benassi M, Gullón B, et al. 2016. Sugar profile, physicochemical and sensory aspects of monofloral honeys produced by different stingless bee species in Brazilian semi-arid region. LWT Food Sci. Technol. 65:645–51
41. de Verges J, Nehring V. 2016. A critical look at proximate causes of social insect senescence: damage accumulation or hyperfunction? Curr. Opin. Insect Sci. 16:69–75
Article Location42. Di Girolamo F, D’Amato A, Righetti PG. 2012. Assessment of the floral origin of honey via proteomic tools. J. Proteom. 75:3688–93
Article Locations:43. Donaldson IA, Jørgensen JH. 1988. Barley powdery mildew “invertase” is an alpha-glucosidase. Carlsberg Res. Commun. 53:421
Article Location44. Drescher N, Klein AM, Schmitt T, Leonhard SD. 2018. A clue on bee glue: new insight into the sources and factors driving resin intake in honeybees (Apis mellifera). PLOS ONE 14:e0210594
Article Locations:45. Elsik CG, Worley KC, Bennett AK, Beye M, Camara F, et al. 2014. Finding the missing honey bee genes: lessons learned from a genome upgrade. BMC Genom. 15:86–108
Article LocationMore AR articles citing this reference46. Erban T, Shcherbachenko E, Talacko P, Harant K. 2019. The unique protein composition of honey revealed by comprehensive proteomic analysis: allergens, venom-like proteins, antibacterial properties, royal jelly proteins, serine proteases, and their inhibitors. J. Nat. Prod. 82:1217–26
Article Location47. Erler S, Moritz RFA. 2016. Pharmacophagy and pharmacophory: mechanisms of self-medication and disease prevention in the honeybee colony (Apis mellifera). Apidologie 47:389–411
Article Locations:48. Ferri S, Kojima K, Sode K. 2011. Review of glucose oxidases and glucose dehydrogenases: a bird’s eye view of glucose sensing enzymes. J. Diabetes Sci. Technol. 5:1068–76
Article Location49. Flanjak I, Strelec I, Kenjerić D, Primorac L. 2016. Croatian produced unifloral honey characterized according to the protein and proline content and enzyme activities. J. Apic. Sci. 60:39–48
Article Location50. Frankel S, Robinson GE, Berenbaum MR. 1998. Antioxidant capacity and correlated characteristics of 14 unifloral honeys. J. Apic. Res. 37:27–31
Article Location51. Gauhe A. 1940. Über ein glukoseoxydierendes Enzym in der Pharynxdrüse der Honigbiene. Z. Vgl. Physiol. 28:211–53
Article Location52. Gherman BI, Denner A, Bobiş O, Dezmirean DS, Mărghitaş LA, et al. 2014. Pathogen-associated self-medication in the honeybee Apis mellifera. Behav. Ecol. Sociobiol. 68:1777–84
Article Locations:53. Giannakou ME, Goss M, Jünger MA, Hafen E, Leevers SJ, Partridge L. 2004. Long-lived Drosophila with overexpressed dFOXO in adult fat body. Science 305:361
Article LocationMore AR articles citing this reference54. Gil MI, Ferreres F, Ortiz A, Subra E, Tomas-Barberan FA. 1995. Plant phenolic metabolites and floral origin of rosemary honey. J. Agric. Food Chem. 34:2833–38
Article Location55. Gilbert LE. 1972. Pollen feeding and reproductive biology of Heliconius butterflies. PNAS 69:1403–7
Article LocationMore AR articles citing this reference56. Gillette CC. 1931. Honey catalase. J. Econ. Entomol. 24:605–6
Article Locations:57. Giri K. 1938. The chemical composition and enzyme content of Indian honey. Madras Agric. J. 26:68–72
Article Location58. Gismondi A, Di Marco G, Canini A. 2017. Detection of plant microRNAs in honey. PLOS ONE 12(2):e0172981
Article Location59. Gloss AD, Abbot P, Whiteman NK. 2019. How interactions with plant chemicals shape insect genomes. Curr. Opin. Insect Sci. 36:149–56
Article Location60. González-Teuber M, Heil M. 2009. Nectar chemistry is tailored for both attraction of mutualists and protection from exploiters. Plant Signal. Behav. 4:809–13
Article LocationMore AR articles citing this reference61. Good AP, Gauthier M-PL, Vannette RL, Fukami T. 2014. Honey bees avoid nectar colonized by three bacterial species, but not by a yeast species, isolated from the bee gut. PLOS ONE 9:e86494
Article LocationMore AR articles citing this reference62. Gothe F. 1914. Die fermente des honigs. Z. Unters. Nahr. Genußm. Gebrauchsgegenstände 28:273–86
Article Location63. Haddad LS, Kelbert L, Hulbert AJ. 2007. Extended longevity of queen honey bees compared to workers is associated with peroxidation-resistant membranes. Exp. Gerontol. 42:601–9
Article Location64. Harpel D, Cullen DA, Ott SR, Jiggins CD, Walters JR. 2015. Pollen feeding proteomics: salivary proteins of the passion flower butterfly, Heliconius melpomene. Insect Biochem. Mol. Biol. 63:7–13
Article Locations:65. Harvey JA, Cloutier J, Visser B, Ellers J, Wäckers F, Gols R. 2012. The effect of different dietary sugars and honey on longevity and fecundity in two hyperparasitoid wasps. J. Insect Physiol. 58:816–23
Article Location66. Huidobro JF, Sánchez MP, Muniategui S, Sancho MT. 2019. Precise method for the measurement of catalase activity in honey. J. AOAC Int. 88:800–4
Article Location67. Jamaluddin MD. 2015. Advances in Food Processing and Preservation. New Delhi: Anmol Publ.
Article Location68. Johnson RM, Harpur BA, Dogantzis KA, Zayed A, Berenbaum MR. 2018. Genomic footprint of evolution of eusociality in bees: floral food use and CYPome “blooms.” Insectes Soc. 65:445–54
Article Location69. Johnson RM, Mao W, Pollock HS, Niu G, Schuler MA, Berenbaum MR. 2012. Ecologically appropriate xenobiotics induce cytochrome P450s in Apis mellifera. PLOS ONE 7(2):e31051
Article LocationMore AR articles citing this reference70. Joshi SR, Pechhacker H, William A, Von Der Ohe W. 2000. Physico-chemical characteristics of Apis dorsata, A. cerana and A. mellifera honey from Chitwan district, central Nepal. Apidologie 31:367–75
71. Kapheim KM, Pan H, Li C, Salzberg SL, Puiu D, et al. 2015. Genomic signatures of evolutionary transitions from solitary to group living. Science 348:1139–43
Article LocationMore AR articles citing this reference72. Kaškonienė V, Venskutonis PR. 2010. Floral markers in honey of various botanical and geographic origins: a review. Compr. Rev. Food Sci. Saf. 9:620–34
Article Locations:73. Keeling CI, Yuen MM, Liao NY, Docking TR, Chan SK, et al. 2013. Draft genome of the mountain pine beetle, Dendroctonus ponderosae Hopkins, a major forest pest. Genome Biol. 14:R27
Article LocationMore AR articles citing this reference74. Kevan PG, Eisikowitch D, Fowle S, Thomas K. 1988. Yeast-contaminated nectar and its effects on bee foraging. J. Apic. Res. 27:26–29
Article Location75. Khalifa SAM, Elashal M, Kielszek M, Ghazala NE, Farag MA, et al. 2020. Recent insights into chemical and pharmacological studies of bee bread. Trends Food Sci. Technol. 97:300–16
Article Location76. Kubo T, Sasaki M, Nakamura J, Sasagawa H, Ohashi K, et al. 1996. Change in the expression of hypopharyngeal-gland proteins of the worker honeybees (Apis mellifera) with age and/or role. J. Biochem. 119:291–95
Article Location77. Kubota M, Tsuji M, Nishimoto M, Wongchawalit J, Okuyama M, et al. 2004. Localization of α-glucosidases I, II, and III in organs of European honeybees, Apis mellifera L., and the origin of α-glucosidase in honey. Biosci. Biotechnol. Biochem. 68:2346–52
Article Location78. Kumar S, Narwal S, Kumar V, Prakash O. 2011. α-Glucosidase inhibitors from plants: a natural approach to treat diabetes. Pharmacogn. Rev. 5:19–29
Article Location79. Kunieda T, Fujiyuki T, Kucharski R, Foret S, Ament SA, et al. 2006. Carbohydrate metabolism genes and pathways in insects: insights from the honey bee genome. Insect Mol. Biol. 15:563–76
Article Locations:More AR articles citing this reference80. Lashmanova E, Zemskaya N, Proshkina E, Kudryavtseva A, Volosnikova M, et al. 2017. The evaluation of geroprotective effects of selected flavonoids in Drosophila melanogaster and Caenorhabditis elegans. Front. Pharmacol. 8:884
Article Location81. Leonov A, Arlia-Ciommo A, Piano A, Svistkova V, Lutchman V, et al. 2015. Longevity extension by phytochemicals. Molecules 20:6544–72
Article LocationMore AR articles citing this reference82. Lewkowski O, Mureşan CI, Dobritzsch D, Fuszard M, Erler S. 2019. The effect of diet on the composition and stability of proteins secreted by honey bees in honey. Insects 10:282–92
Article Locations:83. Li K, Yao F, Xue Q, Fan H, Yang L, et al. 2018. Inhibitory effects against α-glucosidase and α-amylase of the flavonoids-rich extract from Scutellaria baicalensis shoots and interpretation of structure–activity relationship of its eight flavonoids by a refined assign-score method. Chem. Cent. J. 12:82
Article Location84. Liao LH, Wu WY, Berenbaum MR. 2017. Impacts of dietary phytochemicals in the presence and absence of pesticides on longevity of honey bees (Apis mellifera). Insects 8:22–35
Article Locations:85. Linley E, Denyer SP, McDonnell G, Simons C, Maillard J-Y. 2012. Use of hydrogen peroxide as a biocide: new consideration of its mechanisms of biocidal action. J. Antimicrob. Chemother. 67:1589–96
Article Location86. Liu F, He J, Fu W. 2005. Highly controlled nest homeostasis of honey bees helps deactivate phenolics in nectar. Naturwissenschaften 92:297–99
Article Location87. Ma J-N, Ma C-M. 2015. Antifungal inhibitory activities of caffeic and quinic acid derivatives. In Coffee in Health and Disease Prevention, ed. VR Preedy, pp. 635–41. Amsterdam: Elsevier
Article Location88. Mani R, Natesan V. 2018. Chrysin: sources, beneficial pharmacological activities and molecular mechanisms of action. Phytochemistry 143:187–96
Article Location89. Manjon C, Troczka BJ, Zaworra M, Beadle K, Randall E, et al. 2018. Unravelling the molecular determinants of bee sensitivity to neonicotinoid insecticides. Curr. Biol. 28:1137–43.e5
Article LocationMore AR articles citing this reference90. Mao W, Rupasinghe SG, Johnson RM, Zangerl AR, Schuler MA, Berenbaum MR. 2009. Quercetin-metabolizing CYP6AS enzymes of the pollinator Apis mellifera (Hymenoptera: Apidae). Comp. Biochem. Physiol. B 154:427–34
Article Locations:More AR articles citing this reference91. Mao W, Schuler MA, Berenbaum MR. 2011. CYP9Q-mediated detoxification of acaricides in the honey bee (Apis mellifera). PNAS 31:12657–62
Article Locations:More AR articles citing this reference92. Mao W, Schuler MA, Berenbaum MR. 2013. Honey constituents upregulate detoxification and immunity genes in the western honey bee Apis mellifera. PNAS 110:8842–46
Article Locations:More AR articles citing this reference93. Mao W, Schuler MA, Berenbaum MR. 2015. A dietary phytochemical alters caste-associated gene expression in honey bees. Sci. Adv. 1:e1500795
Article Locations:94. Mao W, Schuler MA, Berenbaum MR. 2017. Disruption of quercetin metabolism by fungicide affects energy production in honey bees (Apis mellifera). PNAS 114:2538–43
Article Location95. Mavric E, Wittmann S, Barth G, Henle T. 2008. Identification and quantification of methylglyoxal as the dominant antibacterial constituent of Manuka (Leptospermum scoparium) honeys from New Zealand. Mol. Nutr. Food Res. 52:483–89
Article LocationMore AR articles citing this reference96. McMenamin AJ, Brutscher LM, Glenny W, Flenniken ML. 2016. Abiotic and biotic factors affecting the replication and pathogenicity of bee viruses. Curr. Opin. Insect Sci. 16:14–21
Article LocationMore AR articles citing this reference97. Mitton GA, Szawarski N, Mitton FM, Iglesias A, Eguaras MJ, et al. 2020. Impacts of dietary supplementation with p-coumaric acid and indole-3-acetic acid on survival and biochemical response of honey bees treated with tau-fluvalinate. Ecotox. Environ. Saf. 189:109917
Article Location98. Mo Y, Nagel C, Taylor LP. 1992. Biochemical complementation of chalcone synthase mutants defines a role for flavonols in functional pollen. PNAS 89:7213–17
Article LocationMore AR articles citing this reference99. Na Ayutthaya PP, Chanchao C, Chunsrivirot S. 2018. Insight into the substrate specificity change caused by the Y227H mutation of α-glucosidase III from the European honeybee (Apis mellifera) through molecular dynamics simulations. PLOS ONE 13:e0198484
Article Location100. Nafea EA, Nehad MG, Enas ND, Hajar AS. 2014. Physiochemical and antimicrobial properties of four Egyptian honeys with references to American foul Brood disease. Life Sci. J. 11(10s):40–46
Article Location101. Natl. Acad. Sci. 2007. Status of Pollinators in North America. Washington, DC: Natl. Acad. Sci.
Article Location102. Negri P, Maggi MD, Ramirez L, de Feudis L, Szawarski N, et al. 2015. Abscisic acid enhances the immune response in Apis mellifera and contributes to the colony fitness. Apidologie 46:542–57
Article Locations:103. Negri P, Ramirez L, Quintana S, Szawarski N, Maggi M, et al. 2020. Immune-related gene expression of Apis mellifera larvae in response to cold stress and abscisic acid (ABA) dietary supplementation. J. Apic. Res. 59:669–76
Article Locations:104. Negri P, Villalobos E, Szawarski N, Damiani N, Gende L, et al. 2019. Towards precision nutrition: a novel concept linking phytochemicals, immune response and honey bee health. Insects 10:401–30
Article Location105. Nepi M, Grasso DA, Mancuso S. 2018. Nectar in plant-insect mutualistic relationships: from food reward to partner manipulation. Front. Plant Sci. 9:1063–79
Article Location106. Nicolson SW. 2011. Bee food: the chemistry and nutritional value of nectar, pollen and mixtures of the two. Afr. Zool. 46:197–204
Article LocationMore AR articles citing this reference107. Nicolson SW, Human H. 2008. Bees get a head start on honey production. Biol. Lett. 4:299–301
Article LocationMore AR articles citing this reference108. Nicolson SW, Thornburg RW. 2007. Nectar chemistry. In Nectaries and Nectar, ed. S Nicolson, M Nepi, E Pacini, pp. 215–63. Berlin: Springer
Article Locations:More AR articles citing this reference109. Niu G, Johnson RM, Berenbaum MR. 2011. Toxicity of mycotoxins to honeybees and its amelioration by propolis. Apidologie 42:79–87
Article LocationMore AR articles citing this reference110. Nolan VC, Harrison J, Cox AGC. 2019. Dissecting the antimicrobial composition of honey. Antibiotics 8:251
Article Locations:111. Ohashi K, Natori S, Kubo T. 1999. Expression of amylase and glucose oxidase in the hypopharyngeal gland with an age-dependent role change of the worker honeybee (Apis mellifera L.). Eur. J. Biochem. 265:127–33
Article Locations:112. Ohashi K, Sawata M, Takeuchi H, Natori S, Kubo T. 1996. Molecular cloning of cDNA and analysis of expression of the gene for α-glucosidase from the hypopharyngeal gland of the honeybee Apis mellifera L. Biochem. Biophys. Res. Commun. 221:380–85
Article Location113. Ostwald MM, Smith ML, Seeley TD. 2016. The behavioral regulation of thirst, water collection and water storage in honey bee colonies. J. Exp. Biol. 219:2156–65
Article LocationMore AR articles citing this reference114. Othman Z, Zakaria R, Hussain NHN, Hassan A, Shafin N, et al. 2015. Potential role of honey in learning and memory. Med. Sci. 3:3–15
Article Location115. Palmer-Young EC, Farrell IW, Adler LS, Milano NJ, Egan PA, et al. 2019. Chemistry of floral rewards: intra- and interspecific variability of nectar and pollen secondary metabolites across taxa. Ecol. Monogr. 89:e01335
Article LocationMore AR articles citing this reference116. Palmer-Young EC, Tozkar CÖ, Schwarz RS, Chen Y, Irwin RE, et al. 2017. Nectar and pollen phytochemicals stimulate honey bee (Hymenoptera: Apidae) immunity to viral infection. J. Econ. Entomol. 110:1959–72
Article Locations:More AR articles citing this reference117. Pasini F, Gardini S, Marcazzan GL, Caboni MF. 2013. Buckwheat honeys: screening of composition and properties. Food Chem. 141:2802–11
Article Location118. Pattrick JG, Symington HA, Federle W, Glover BJ. 2020. The mechanics of nectar offloading in the bumblebee Bombus terrestris and implications for optimal concentrations during nectar foraging. J. R. Soc. Interface 17:20190632
Article Location119. Pauchet Y, Wilkinson P, Vogel H, Nelson DR, Reynolds SE, et al. 2010. Pyrosequencing the Manduca sexta larval midgut transcriptome: messages for digestion, detoxification and defence. Insect Mol. Biol. 19:61–75
Article Locations:More AR articles citing this reference120. Pemberton RW, Wheeler GS. 2006. Orchid bees don’t need orchids: evidence from the naturalization of an orchid bee in Florida. Ecology 87:1995–2001
Article Location121. Penick CA, Crofton CA, Appler RH, Frank SD, Dunn RR, Tarpy DR. 2016. The contribution of human foods to honey bee diets in a mid-sized metropolis. J. Urban Ecol. 2:juw001
Article Locations:122. Proença C, Freitas M, Ribeiro D, Oliveira EFT, Sousa JLC, et al. 2017. α-Glucosidase inhibition by flavonoids: an in vitro and in silico structure–activity relationship study. J. Enzyme Inhib. Med. Chem. 32:1216–28
Article Location123. Pyrzynska K, Biesaga M. 2009. Analysis of phenolic acids and flavonoids in honey. Trends Anal. Chem. 28:894–902
Article Location124. Ramirez L, Negri P, Sturla L, Guida L, Vigliarolo T, et al. 2017. Abscisic acid enhances cold tolerance in honeybee larvae. Proc. R. Soc. B 284(1852):20162140
Article Location125. Root AI. 1888. The ABC & XYZ of Bee Culture: An Encyclopedia Pertaining to the Scientific and Practical Culture of Honey Bees. Medina, OH: A.I. Root Comp.
Article Location126. Rossano R, Larocca M, Polito T, Perna AM, Padula MC, et al. 2012. What are the proteolytic enzymes of honey and what they do tell us? A fingerprint analysis by 2-D zymography of unifloral honeys. PLOS ONE 7:e49164
Article Location127. Rueppell O, Christine S, Mulcrone C, Groves L. 2007. Aging without functional senescence in honey bee workers. Curr. Biol. 17:R274–75
Article LocationMore AR articles citing this reference128. Ruiz-Argueso T, Rodrıguez-Navarro A. 1973. Gluconic acid-producing bacteria from honey bees and ripening honeys. J. Gen. Microbiol. 76:211–16
Article Location129. Sabatier S, Amiot MJ, Tacchini M, Aubert S. 1992. Identification of flavonoids in sunflower honey. J. Food Sci. 57:773–74
Article Location130. Samarghandian S, Farkhondeh T, Samini F. 2017. Honey and health: a review of recent clinical research. Pharmacogn. Res. 9:121–27
Article Location131. Sann M, Niehuis O, Peters RS, Mayer C, Kozlov A, et al. 2018. Phylogenomic analysis of Apoidea sheds new light on the sister group of bees. BMC Evol. Biol. 18:71
Article Locations:132. Santos LM, Fonseca MS, Sokolonski AR, Deegan KR, Araujo RPC, et al. 2019. Propolis: types, composition, biological activities, and veterinary product patent prospecting. J. Sci. Food. Agr. 100:1369–82
Article Location133. Santos-Buelga C, Gonzalez-Paramas AM. 2017. Chemical composition of honey. In Bee Products—Chemical and Biological Properties, ed. JM Alvarez-Suarez, pp. 43–82. Berlin: Springer
Article Locations:134. Sato T, Miyata G. 2000. The nutraceutical benefit, part III: honey. Nutrition 16:468–69
Article Location135. Schepartz AI, Subers MH. 1966. Catalase in honey. J. Apic. Res. 5:37–43
Article Location136. Schmidt JO, Thoenes SC, Levin MD. 1987. Survival of honey bees, Apis mellifera (Hymenoptera: Apidae), fed various pollen sources. Ann. Entomol. Soc. Am. 80:176–83
Article Location137. Shelomi M, Jasper WC, Atallah J, Kimsey LS, Johnson BR. 2014. Differential expression of endogenous plant cell wall degrading enzyme genes in the stick insect (Phasmatodea) midgut. BMC Genom. 15:917
Article Location138. Simone-Finstrom M, Borba RS, Wilson M, Spivak M. 2017. Propolis counteracts some threats to honey bee health. Insects 8:46–66
Article Locations:More AR articles citing this reference139. Simpson J, Riedel IBM, Wilding N. 1968. Invertase in the hypopharyngeal glands of the honeybee. J. Apic. Res. 7:29–36
Article Location140. Sommeijer MJ, Rooijakkers EF, Jacobusse C, Kerkvliet JD. 2009. Larval food composition and food plants of the solitary bee Colletes halophilus (Hymenoptera: Colletidae) J. Apic. Res. 48:149–55
Article Location141. Spivak M, Goblirsch M, Simone-Finstrom M. 2019. Social-medication in bees: the line between individual and social regulation. Curr. Opin. Insect Sci. 33:49–55
Article LocationMore AR articles citing this reference142. Stamatakis A. 2014. RaxML version 8: a tool for phylogenetic analysis and post-analysis of large phylogenies. Bioinformatics 30:1312–13
Article LocationMore AR articles citing this reference143. Stevenson PC, Nicolson SW, Wright GA. 2017. Plant secondary metabolites in nectar: impacts on pollinators and ecological functions. Funct. Ecol. 31:65–75
Article LocationMore AR articles citing this reference144. Szweda P. 2017. Antimicrobial activity of honey. In Honey Analysis, ed. V De Alencar Arnaut De Toledo, ch. 67117. London: InTech Open
Article Locations:145. Terra WR, Barroso IG, Dias RO, Ferreira C. 2019. Molecular physiology of insect midgut. Adv. Insect Physiol. 56:118–54
Article LocationMore AR articles citing this reference146. Tomas-Barberan FA, Ferreres F, Garcia-Vignera C, Tomas-Lorente F. 1993. Flavonoids in honey of different geographical origin. Z. Lebensm. Unters. Forsch. 196:38–44
Article Location147. Vannette RL, Mohamed A, Johnson BR. 2015. Forager bees (Apis mellifera) highly express immune and detoxification genes in tissues associated with nectar processing. Sci. Rep. 5:16224
Article Location148. Wang C, Li S. 2015. Functional foods and nutraceuticals: potential role in human health. In Clinical Aspects of Functional Foods and Nutraceuticals, ed. D Ghosh, D Debasis Bagchi, T Konishi, pp. 51–72. Boca Raton, FL: CRC Press
Article Location149. Weston RJ. 2000. The contribution of catalase and other natural products to the antibacterial activity of honey: a review. Food Chem. 71:235–39
Article Location150. Wheeler MM, Robinson GE. 2014. Diet-dependent gene expression in honey bees: honey versus sucrose or high fructose corn syrup. Sci. Rep. 4:5726
Article LocationMore AR articles citing this reference151. White JW Jr. 1975. Composition of honey. See Reference 35, pp. 157–206
Article Location152. White JW Jr., Subers MH, Schepartz AI. 1963. The identification of inhibine, the antibacterial factor in honey, as hydrogen peroxide and its origin in a honey glucose-oxidase system. Biochim. Biophys. Acta 73:57–70
Article Location153. Willmer P. 2011. Pollination and Floral Ecology. Princeton, NJ: Princeton Univ. Press
Article Location154. Winston ML. 1987. The Biology of the Honey Bee. Cambridge, MA: Harvard Univ. Press
Article Location155. Wollstonecroft MM. 2011. Investigating the role of food processing in human evolution: a niche construction approach. Archaeol. Anthropol. Sci. 3:141–50
Article Location156. Wong MJ, Liao LH, Berenbaum MR. 2018. Biphasic concentration-dependent interaction between imidacloprid and dietary phytochemicals in honey bees (Apis mellifera). PLOS ONE 13:e0206625
Article Locations:157. Wright GA, Baker DD, Palmer MJ, Stabler D, Mustard JA, et al. 2013. Caffeine in floral nectar enhances a pollinator’s memory of reward. Science 339:1202–4
Article LocationMore AR articles citing this reference158. Yaacob M, Rajab NF, Shahar S, Sharif R. 2018. Stingless bee honey and its potential value: a systematic review. Food Res. 2:124–33
Article Location159. Zhang H, Wang G, Beta T, Dong J. 2015. Inhibitory properties of aqueous ethanol extracts of propolis on alpha-glucosidase. Evid.-Based Complement. Alternat. Med. 2015:587383
Article Location160. Zhao C, Doucet D, Mittapalli O. 2014. Characterization of horizontally transferred β-fructofuranosidase (ScrB) genes in Agrilus planipennis. Insect Mol. Biol. 23:821–32
Article LocationMore AR articles citing this reference161. Zhu K, Liu M, Fu Z, Zhou Z, Kong Y, et al. 2017. Plant microRNAs in larval food regulate honeybee caste development. PLOS Genet. 13(8):e1006946
Article LocationMore AR articles citing this reference
Добавить комментарий