Аннотация
Энтомопатогенные грибы показывают большие перспективы в качестве пестицидов с точки зрения их относительно высокой целевой специфичности, низкой нецелевой токсичности и низкого остаточного действия на сельскохозяйственных полях и в окружающей среде. Однако они также часто имеют характеристики, которые ограничивают их использование, особенно в отношении толерантности к температуре, ультрафиолетовому излучению или другим абиотическим факторам. Губительный эктопаразит медоносных пчел, Varroa destructor, восприимчив к энтомопатогенным грибкам, но относительно теплые температуры в ульях медоносных пчел не позволяют использовать эти грибки в качестве эффективных средств борьбы. Используя сочетание традиционной селекции и методов направленной эволюции, разработанных для этой системы, были созданы новые штаммы Metarhizium brunneum, которые выживали, прорастали и росли лучше при температуре в пчелином улье (35 °C). Полевые испытания с полноразмерными колониями медоносных пчел подтвердили, что новый штамм JH1078 более вирулентен против клещей Варроа и контролирует вредителя сопоставимо с существующими методами лечения. Эти результаты показывают, что энтомопатогенные грибы эволюционно лабильны и способны играть большую роль в современной практике борьбы с вредителями.
Введение
Биологические пестициды, основанные на микробах естественного происхождения, которые заражают виды вредителей, были доступны для производителей на американском и мировом рынках в течение десятилетий, но они не нашли широкого применения (1). Эти микробные биопестициды, по мнению Агентства по охране окружающей среды США, имеют изначально пониженный риск из-за набора благоприятных токсикологических характеристик (2). По сравнению с традиционными химическими синтетическими пестицидами, микробные биопестициды обычно обладают очень низкой токсичностью для человека и других позвоночных животных, быстро разлагаются, что приводит к снижению количества остатков и загрязнения окружающей среды, а также обладают высокой видовой специфичностью, что приводит к снижению нецелевого воздействия (2). Кроме того, микробные биопестициды легко интегрируются в растущий рынок сертифицированных органических продуктов питания3, а вредители могут медленнее вырабатывать устойчивость к микробным биопестицидам, чем к традиционным химическим пестицидам (4).
Несмотря на то, что биопестициды составляют все больший процент мирового использования пестицидов, они в целом не смогли вытеснить традиционные синтетические химические пестициды за пределами определенных нишевых рынков (5). Одна из основных причин заключается в том, что эффективность использования микробов для борьбы с вредителями часто ограничивается восприимчивостью микробов к температуре, ультрафиолетовому излучению, pH или другим абиотическим факторам (6,7,8). Такая восприимчивость к стрессу окружающей среды сокращает продолжительность обработки и снижает общий результат борьбы с вредителями при каждом применении. Повышение устойчивости микробных биопестицидов к абиотическим факторам признано неуловимым, но ключевым этапом преобразований, если мы хотим, чтобы они нашли широкое применение (1,7).
Varroa destructor — эктопаразит медоносных пчел, который считается основной причиной ухудшения здоровья медоносных пчел в последние десятилетия. Хотя целый ряд взаимодействующих факторов, включая патогены, пестициды и питательный стресс, способствовали ухудшению здоровья медоносных пчел (9,10,11,12), клещ Varroa является наиболее часто регистрируемой причиной потери колоний у коммерческих пчеловодов в США (13,14) и считается самой большой угрозой для пчеловодства во всем мире (15). Это, в свою очередь, угрожает сельскохозяйственным культурам, которые нуждаются в опылении насекомыми, на сумму около 238 миллиардов долларов США (16). Варроа питаются взрослыми и незрелыми медоносными пчелами, прокалывая экзоскелет острыми ротовыми члениками и потребляя ткани пчел путем внеротового переваривания (17). Кормление варроа ослабляет пчел, сокращает продолжительность жизни рабочих особей и их кормовую способность, а также является переносчиком некоторых из наиболее разрушительных вирусов медоносных пчел, включая вирус деформации крыльев, израильский вирус острого паралича, вирус кашмирской пчелы и вирус сакбуда (18,19). Если не лечить зараженные варроа колонии, их продолжительность жизни составляет 1-3 года (15,19). Кроме того, зараженные варроа пчелы с большей вероятностью могут переходить в соседние колонии, занося варроа и связанные с ним вирусы в незараженные колонии (20,21). Это особенно проблематично для пчел в условиях коммерческого опыления, когда тысячи ульев от разных пчеловодов и из разных мест сезонно собираются в садах и сельскохозяйственных полях (22,23).
В настоящее время пчеловоды в основном полагаются на химические акарициды для борьбы с Варроа, несмотря на опасность, которую эти химикаты представляют для пчел, и продолжающиеся проблемы с устойчивостью клещей к химикатам. Эти акарициды связаны с многочисленными проблемами здоровья медоносных пчел, и многие исследования показали, что их остатки могут накапливаться в улье с течением времени (24,25,26). Нежелательное воздействие на медоносных пчел включает повышенную смертность расплода и взрослых особей (27) и повышенную восприимчивость к патогенам и сельскохозяйственным химикатам (28,29,30). Растет число доказательств, связывающих акарициды с репродуктивными проблемами как у маток (31,32,33), так и у трутней (34,35). Кроме того, взаимодействие между различными химическими акарицидами может увеличить их токсичность для пчел (36,37), а метаболиты распада, как было показано, также оказывают токсическое воздействие (38,39). Ситуацию усугубляют и многие другие инсектициды, фунгициды и другие агрохимикаты, с которыми сталкиваются медоносные пчелы во время кормежки на сельскохозяйственных полях и вокруг них (40). Традиционные химические акарициды также создают проблемы для пчеловодов, включая повышенные требования к средствам индивидуальной защиты и запрет на обработку во время производства меда. Варроа неоднократно развивали устойчивость к химическим акарицидам, наиболее часто используемым пчеловодами, включая многочисленные пиретроиды (41), фосфорорганические соединения кумафос (42) и амидин амитраз (43).
Несколько лабораторий продемонстрировали, что варроа восприимчивы к энтомопатогенным грибам, включая Beauvaria bassiana, Hirsutella thompsonii и Metarhizium anisopliae (44,45,46,47). Полевые испытания Metarhizium показали, что гриб способен бороться с клещами (47,48), иногда с результатами, сравнимыми с широко используемыми в то время химическими акарицидами (49,50). Однако, несмотря на попытки использования нескольких различных составов, коммерчески доступные энтомопатогенные грибы, которые были протестированы, в целом отличались низкой согласованностью в своей способности контролировать Варроа (51). Исследователи неоднократно отмечали, что относительно теплая температура в ульях медоносных пчел, 35 °C (52) , пагубно влияет на выживаемость и инфекционный потенциал спор, что приводит к быстрому снижению эффективности лечения (43,53). Ситуация усугубляется жизненным циклом клещей Varroa, которые проводят большую часть своей жизни внутри закрытых расплодных ячеек с развивающимися куколками пчел. Это укрывает клещей от препаратов с коротким сроком действия, что позволяет уровню клещей быстро восстановиться (51,54).
Хотя в настоящее время исследователи проверили и протестировали десятки существующих штаммов энтомопатогенных грибов на их потенциал для борьбы с Варроа, никто еще не пытался создать штамм специально для борьбы с Варроа с помощью каких-либо генетических манипуляций или повторяющегося отбора. В дополнение к тому, что грибы клады Metarhizium PARB (включая виды M. anisopliae и M. brunneum) перспективны в качестве микробного биопестицида против варроа, они показали, что могут быть изменены с помощью генной инженерии (55) или скрининга сектора мутагенеза (56). В следующих экспериментах мы подвергли штамм Metarhizium brunneum многократным циклам отбора, используя как направленную эволюцию в лабораторных инкубаторах, так и повторяющийся отбор в полноразмерных колониях медоносных пчел. В результате были получены штаммы, которые лучше выживают в условиях пчелиного улья и лучше контролируют Варроа, чем родительские штаммы.
Результаты и обсуждение
В первых испытаниях Metarhizium для борьбы с Варроа использовали 30 созданных полноразмерных колоний медоносных пчел, которые разделили на три группы, уравновесив каждую группу по численности колоний и начальному уровню клещей. Штамм F52 Metarhizium brunneum (ATCC #90448) был выбран для тестирования из-за его эффективности против Varroa (47,48,49), генетической манипулируемости (55) и доказательств того, что патогенность и потенциал контроля существующих штаммов могут быть улучшены (57). Кроме того, мы протестировали родственный штамм Metarhizium brunneum (56) , который демонстрирует замедленную продукцию спор, чтобы проверить поведенческие или вредительские различия гиф Metarhizium по сравнению со спорами. Контрольные колонии получали неинокулированный агар. Обработка ульев заключалась в переворачивании агаровых дисков из 95-миллиметровой пластиковой чашки Петри на верхние планки рамок с расплодом в улье, по одному диску на коробку.
Обработка M. brunneum F52, продуцирующим митоспоры (бесполые споры, иногда называемые конидиями в Metarhizium), значительно увеличила количество мертвых клещей, собранных с липких карточек на нижней доске, по сравнению с ульями, получившими неинокулированные агаровые пластины (рис. 1a; на 5 и 7 день p < 0,03). Контроль варроа этим спорулирующим штаммом, который, по оценкам, обеспечивал 8,76 × 108 митоспор на обработку, достиг пика между 5-7 днями после обработки, что соответствует пику микоза (рис. 1b), а затем снизился до незначительного уровня, начиная с 9 дня. Быстрая потеря жизнеспособности митоспор в этом первом испытании была в некоторой степени ожидаема, так как предыдущие исследователи отмечали восприимчивость Metarhizium к температуре в ульях медоносных пчел. Рабочие пчелы наблюдали, как живой грибок был удален с агарового диска сразу после обработки, что позволяет предположить, что производство митоспор в результате обработки быстро сократилось, поскольку живой грибок был удален. Однако это действие могло способствовать распространению митоспор с диска на живых пчел и вокруг колонии.

Metarhizium, не продуцирующий митоспоры, не показал никакого эффекта от лечения (p > 0,2 для всех дней) (рис. 1). Хотя Metarhizium производит деструктины и другие соединения с пестицидными свойствами, эти результаты подтверждают предыдущие исследования (51) , показывающие, что митоспоры являются необходимым инфекционным агентом Metarhizium для борьбы с Варроа. Хотя гифы Metarhizium могут проявлять некоторые микоаттрактанты (56) , мы не наблюдали никакого привлечения варроа к этому грибу. Поэтому основной способ борьбы с варроа, скорее всего, заключается в адгезии митоспор и их прорастании на экзоскелете клеща, а затем проникновении гиф через экзоскелет и распространении по внутренним тканям клеща.
Клещи из этого первоначального полевого испытания были собраны с липких карточек, стерилизованы и помещены на агар. Metarhizium, выросшие из зараженных клещей, были субкультивированы и использованы в качестве исходной популяции для процесса направленной эволюции, который мы разработали, чтобы вызвать термотолерантность. Грибок подвергался повторяющимся циклам роста и размножения в стрессовых условиях при повышении температуры (рис. 2a). Стрессовыми условиями были либо окислительный стресс и легкая мутагенность, индуцированные обработкой перекисью водорода, либо питательный стресс, индуцированный ростом на минимальной среде агара с добавлением хитина или без него. Споры, подвергнутые питательному стрессу, лучше переносят УФ-стресс и тепловой стресс и демонстрируют повышенную инфекционность (7,58). Однако для грибов, выращенных на средах с дефицитом питательных веществ, существует компромисс: развитие гиф замедляется, а производство митоспор снижается (59). С каждым повторным циклом популяцию митоспор перемешивали, а температуру в инкубаторе постепенно повышали от идеальной температуры роста исходного штамма F52 (27 °C) до температуры, характерной для ульев медоносных пчел (35 °C).


Последнее поколение спор, полученное в результате процесса направленной эволюции, затем использовалось в качестве стартовой популяции для повторных раундов полевого отбора. Митоспоры проращивали на пластинах агара с солодовым экстрактом (MEA), давали им вырасти и произвести еще одно поколение митоспор, а затем агаровый диск переворачивали на верхние планки рамок с гребнем в полноразмерных открытых колониях медоносных пчел (рис. 2b). Новая пасека, обозначенная как стационарная, была создана с использованием полноразмерных колоний, полученных из «двухфунтовых пакетов» (0,91 кг пчел, взятых из общей популяции), при этом в общей сложности 48 колоний были выделены для повторной обработки либо Metarhizium, либо неинокулированными агаровыми дисками в качестве контроля. Первый раунд лечения после процедуры направленной эволюции не привел к высокому уровню инфекции в клещах; мы смогли рекультивировать живые Metarhizium из 3,38% клещей, собранных с липких карточек (рис. 3a), что указывает на низкое число клещей, погибших от грибка. Такое низкое число не было неожиданным, поскольку многие генетические изменения, приобретенные в процессе направленной эволюции, не были бы благоприятны для вирулентности у живых хозяев в полевых условиях. Кроме того, известно, что повторное субкультивирование на искусственных средах снижает вирулентность всего за 20 субкультур (60). Живой грибок, повторно культивированный из зараженных клещей, затем выращивали до споруляции, и последующее поколение использовали для повторной обработки той же популяции ульев (рис. 3a). После отбора через одно поколение хозяев Varroa, в результате такого лечения 49,9% клещей погибли от микоза. Процесс сбора митоспор из мертвых клещей, выращивания нового поколения и повторной обработки колонии повторялся еще два раза в тот полевой сезон. Окончательная обработка показала продолжительную эффективность, которая сохранялась до 5 недель после обработки (рис. 3а), что указывает на повышенную устойчивость к условиям пчелиного улья. Никаких негативных эффектов обнаружено не было, и колонии в лечебной и контрольной группах ушли в зиму с одинаковыми оценками численности пчел (t-тест p = 0,72, см. Дополнительный рис. S1 онлайн).
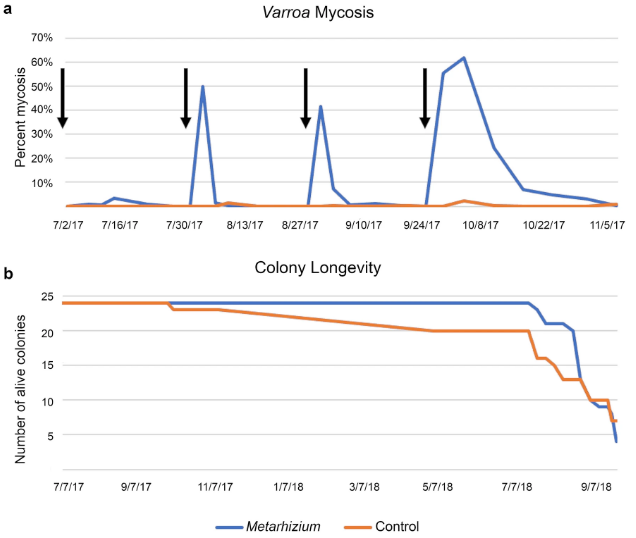
В следующем году колонии на стационарной пасеке продолжали обрабатывать либо Metarhizium, либо неинокулированным агаром, используя тот же протокол, что и раньше. Ульи, обработанные Metarhizium, выживали значительно дольше, чем необработанные (рис. 3б; p < 0,02), хотя 42 из 48 ульев погибли от варроа, давления патогенов и интенсивного хищничества желтой куртки к концу второго года. Обработка метаргизиумом задержала экспоненциальное увеличение уровня варроа, но не предотвратила его полностью (см. Дополнительный рис. S2 онлайн). Присутствие необработанных колоний на пасеке создавало так называемые «клещевые бомбы » (61). Колонии с высоким уровнем заражения варроа постоянно инокулируют колонии в районе клещами и связанными с ними вирусами через дрейфующих пчел и грабителей меда, что приводит к проблемам со здоровьем всех колоний на пасеке. Распространение клещей из необработанных колоний на все колонии можно увидеть при измерении уровня клещей на стационарной пасеке (см. Дополнительный рис. S3 онлайн).
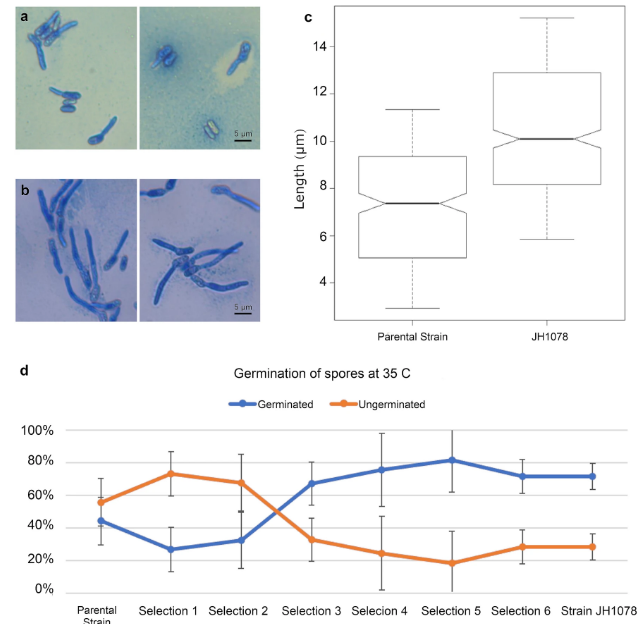
Штамм, полученный в результате отбора в конце экспериментов на стационарной пасеке и обозначенный как штамм JH1078, был сравнен с родительским штаммом по характеристикам роста и прорастания при 35 °C в лабораторном инкубаторе. Между родительским штаммом F52 и штаммом JH1078 имеется несколько существенных различий в морфологии и продолжительности жизни (рис. 4a,b). После 24 ч инкубации при 35 °C только 44% митоспор родительского штамма смогли прорасти, тогда как более 70% митоспор штамма JH1078 проросли при 35 °C (рис. 4d). Из проросших спор трубка прорастания родительского штамма в среднем имела длину 4,8 ± 0,20 мкм. Прорастающая трубка штамма JH1078 была значительно длиннее (t-тест p = 8,5 × 10-27), в среднем 10,48 ± 0,17 мкм (рис. 4c).
Чтобы проверить Metarhizium JH1078 в контексте современных пчеловодческих операций, полноразмерные ульи, которые участвовали в миграционном коммерческом опылении с февраля по июнь, обрабатывали Metarhizium или обычным средством борьбы с варроа, одобренным EPA, — капельной обработкой 2,8% щавелевой кислотой (62). Для этих экспериментов штамм JH1078 был выращен на коричневом рисе и помещен в сетчатые мешки из натурального волокна. Каждый улей был обработан 120 г колонизированного зерна, содержащего 2,63 × 108 спор на грамм. Обработка Metarhizium и щавелевой кислотой проводилась дважды с интервалом в 7 дней. Колонии были отобраны на уровень варроа с помощью промывки этанолом до обработки и в конце эксперимента через 18 дней. В этой полевой ситуации колонии, обработанные Metarhizium, существенно не отличались от колоний, обработанных щавелевой кислотой, и имели тенденцию к лучшему контролю клещей (Kruskall-Wallis p = 0,33; см. дополнительный рис. S4 онлайн).
Выводы
Эти результаты показывают пластичность Metarhizium как агента биоконтроля и демонстрируют, что новые полезные фенотипы могут быть созданы и отобраны с помощью комбинации направленной эволюции в лаборатории и полевого отбора. Важно отметить, что в эпоху ухудшения здоровья медоносных пчел штаммы Metarhizium, созданные в этих экспериментах, способны контролировать клещей Варроа и могут стать для пчеловодов альтернативой химическим акарицидам. Кроме того, возможно, что представленные здесь методы могут быть применены к грибам или другим агентам биоконтроля, направленным на других членистоногих вредителей. Восприимчивость к стрессовым факторам окружающей среды, таким как тепло, часто отмечается как фактор, ограничивающий эффективность энтомопатогенных грибов, но эти результаты показывают, что такие барьеры могут быть преодолены.
Материалы и методы
Изоляты грибов
Исходный штамм Metarhizium brunneum, который использовался в качестве родительского штамма перед селекцией, был получен из Американской коллекции типовых культур (ATCC #90448). Изолят преспорулирующего штамма (патент США №8501207B2) был получен от Fungi Perfecti LLC. (Олимпия, Вашингтон, США). Штаммы хранились в темноте на агаре солодового экстракта (MEA) при 4 °C. За исключением роста во время экспериментов по направленной эволюции с использованием инкубаторов, Metarhizium для обработки ульев выращивали на 95 мм MEA пластинах Петри при комнатной температуре (25 °C) до полной колонизации пластины и образования митоспор, обычно через 12-16 дней.
Первоначальные полевые испытания стартовых штаммов
В августе 2016 года полностью сформированные колонии медоносных пчел с четырех различных пасек в Восточном Вашингтоне были оценены на предмет уровня клещей Варроа, количества расплода и общей численности улья. Для эксперимента было отобрано 30 колоний, которые были отнесены к одной из трех групп, при этом группы были сбалансированы по этим связанным со здоровьем признакам. Затем ульи были перевезены на новую пасеку в Трой, штат Айдахо, и установлены с приподнятыми нижними досками, на которых можно было разместить липкие карточки. В сентябре колонии обрабатывали либо спорулирующим Metarhizium, либо предварительно спорулирующим Metarhizium, либо неинокулированным субстратом MEA. В конце испытания ульи обрабатывали одной полоской CheckMite+ (Bayer Animal Health, США; действующее вещество — фосфорорганическое соединение кумофос) для уничтожения оставшихся клещей и оценки общего уровня клещей, оставшихся в ульях. Данные, представленные на рис. 1а, были получены путем нормализации количества клещей, пойманных на липкие карточки с течением времени, к общему количеству клещей, упавших в течение всего эксперимента, включая 1 неделю после обработки CheckMite+. Значимость анализировали с помощью t-тестов (Microsoft Excel).
Отбор на термотолерантность in vitro
Митоспоры либо обрабатывали H2O2, либо выращивали на минимальной среде (агар Чапека Докс без сахарозы: NaNO3 0,2%, K2HPO4 0,1%, MgSO4 0,05%, KCl 0,05%, FeSO4 0,001%, Bacto Agar 1,5%) с хитином (4 г хитина/1 л) или без него. Споры, обработанные H2O2, погружали в 0,3% или 0,03% раствор H2O2 на 60 мин. Раствор готовили свежим перед использованием, а споры накрывали во время обработки, чтобы предотвратить световую деградацию H2O2. Через 60 мин споры трижды промывали стерильной водой перед высевом на MEA. Агаровые пластины (95 мм; 10 для каждой обработки) инокулировали 1 × 105 митоспор мл-1 и давали расти до споруляции. Пластины инкубировали при последовательно повышающейся температуре, начиная с 27 °C и повышая до 35 °C с шагом в один градус в течение восьми поколений.
Полевые испытания
Создание и содержание стационарной пасеки
Стационарная пасека, состоящая из 48 полноразмерных колоний, была создана в Москве, штат Айдахо, в апреле 2017 года для проведения долгосрочных полевых экспериментов по обработке и селекции. Чтобы ограничить контакт с пестицидами и больными пчелами с других предприятий, эти ульи не участвовали в какой-либо мигрирующей коммерческой опылительной деятельности. Полевая площадка находилась в пределах 2 км от городских районов и ферм с другими небольшими предприятиями медоносных пчел, которые могли послужить источниками инокуляции клещей и патогенов в наши ульи. Все ульи были запущены с использованием новых деревянных изделий (ульевых ящиков, досок и крышек) и новых «двухфунтовых пакетов» пчел (0,91 кг или ~ 7000 рабочих пчел и спаренная матка) от одного и того же коммерческого поставщика пчел, расположенного в Калифорнии, США. В ульи закладывали две рамки меда, три рамки основы, четыре рамки пустых оттянутых гребенок и кормушку объемом один галлон (3,8 л) для подкормки раствором сахарозы во время низкого цветочного изобилия.
Ульи были размещены в четырех кластерах на расстоянии не менее 20 м друг от друга с участками сосен, служившими барьерами между кластерами. Каждый кластер содержал 12 ульев в форме подковы, отдельные ульи располагались на расстоянии 2-3 м друг от друга. Входы в ульи были помечены уникальными цветовыми и текстурными узорами, чтобы уменьшить перемещение рабочих между колониями. В течение 6-8 недель за пасекой велось регулярное наблюдение, чтобы убедиться, что все колонии укоренились и имеют примерно одинаковые размеры и здоровье, прежде чем начать полевые испытания. Во время этого этапа создания колоний рамки с расплодом периодически перемещали из сильных ульев в слабые, чтобы выровнять численность ульев. Ульи содержались с минимальным вмешательством пчеловода, но с частым мониторингом ульев. Поскольку роение могло значительно повлиять на уровень клещей, маточные ячейки удалялись, а медовые сушь добавлялась по мере необходимости. Ульи контролировались по количеству расплода и рамок, чтобы определить, какое негативное влияние на здоровье колонии может оказать лечение, если таковое вообще возможно.
Чтобы предотвратить распространение инфекции в соседние ульи, ульи, в которых было обнаружено более 15 клещей на 100 пчел (в пять раз больше, чем порог лечения) в образцах этанола, удалялись с пасеки и считались функционально мертвыми для эксперимента.
Обработка стационарной пасеки
Колонии на стационарной пасеке обрабатывали либо спорулирующими Metarhizium на дисках с МЭА-агаром (N = 24), либо неинокулированными дисками с МЭА-агаром в качестве контроля (N = 24). Подсчеты на гемоцитометре в лаборатории показали, что каждая пластина с Metarhizium содержала в среднем 8,76 × 108 спор. Ульи обрабатывались каждые 4 недели в течение полевых сезонов 2017 и 2018 годов. Обработка заключалась в переворачивании чашек Петри (95 мм × 15 мм) и удалении агаровых дисков на верхние планки медовых гребней ульев, по одному диску на каждый ульевой ящик. Подсчеты на гемоцитометре в лаборатории показали, что каждая пластина содержала в среднем 8,76 × 108 спор.
Сбор и анализ данных на стационарной пасеке
Уровень популяции клещей Варроа на стационарной пасеке определяли дважды в первый год (июль, ноябрь) и четыре раза во второй год (апрель, июнь, август, сентябрь), используя отбор проб взрослых пчел с помощью этанола (по методу Дитемана (63) , но с увеличенным временем встряхивания для отгонки клещей). Кроме того, в течение всего полевого сезона постоянно поддерживались липкие карточки на нижней доске, чтобы фиксировать всех умирающих в улье варроа. Липкие карточки представляли собой картон размером 46 см × 33 см с тонким слоем вазелина, нанесенным на верхнюю сторону. Над карточкой был установлен экран из хозяйственной ткани с ячейками 3,18 мм; пчелы могли ходить по экрану, а мертвые клещи и мелкий ульевой мусор могли падать через него на карточку. Липкие карточки меняли каждые 3 дня в течение первых 15 дней после обработки, а затем каждые 7 дней до следующей обработки. На каждой карточке подсчитывали количество мертвых клещей и отбирали 12 клещей для анализа на микозы. Клещей поверхностно стерилизовали 95% этанолом, чтобы минимизировать возможность выращивания Metarhizium, находящегося снаружи на телах клещей, а не грибка, инфицировавшего клещей изнутри. Поверхностно стерилизованных клещей помещали на 1/4 силы PDA + стрептомицин/пенициллиновые антибиотики и инкубировали при 25 °C до появления грибкового роста. Клещи, на которых после поверхностной стерилизации выросли колонии Metarhizium, считались погибшими от микоза. Споры из колоний Metarhizium, выросших из клещей в этих культурах, собирали препаровальной иглой и переносили в 0,01% раствор Tween 80; 15 мкл этого раствора наносили на пластину MEA для создания следующего поколения обработок. Различия в смертности колоний медоносных пчел были проанализированы с помощью OASIS 2 (64). Для определения значительных различий в смертности между обработками использовались тесты Мантеля-Кокса.
Прорастание митоспор/пробирка для проращивания
Колонии Metarhizium выращивали на картофельно-декстрозном агаре (PDA). Митоспоры собирали через 2 недели роста с помощью стерильной микробиологической петли и переносили в 0,01% раствор Tween 80. Суспензию митоспор (105 митоспор мл-1) встряхивали на вихре в течение 30 с, после чего капали, не распределяя, 30 мкл на 20 мл 1/4 среды PDA в полистироловые чашки Петри (95 мм × 15 мм). На каждую чашку Петри инокулировали три различных образца митоспор. Образцы инкубировали в течение 24 ч при 35 °C в темноте — среде, которая наиболее точно имитирует улей медоносной пчелы. Через 24 ч добавляли три капли лактофенолового хлопкового синего красителя, чтобы зафиксировать и окрасить митоспоры и предотвратить дальнейшее прорастание. Капли накрывали покровным стеклом и рассматривали под световым микроскопом при увеличении 400×. Митоспоры считались проросшими, если длина зародышевой трубки превышала длину митоспоры (65). В каждом образце наблюдали не менее 300 митоспор и рассчитывали процент прорастания в соответствии с методикой Браги и др. (65). Длина зародышевой трубки измерялась для минимум 300 митоспор на образец с помощью программного обеспечения Zen (Carl Zeiss AG).
Сравнение Metarhizium JH1078 и щавелевой кислоты
В июне 2020 года 20 ульев на пасеке вблизи Москвы, штат Айдахо, были выбраны случайным образом для обработки Metarhizium JH1078 или щавелевой кислотой. Инокулят Metarhizium выращивали на Potato Dextrose Agar (PDA) при комнатной температуре до споруляции (~ 20 дней). Органический короткозерный коричневый рис (Lundberg Family Farms, Richvale, California) промывали, а затем замачивали в воде температурой 82,2 °C в течение 15 мин. Затем 3 кг увлажненного зерна пересыпали в мешки для выращивания грибов (Unicorn Corp.) и стерилизовали в автоклаве. После охлаждения мешки инокулировали спорами из стартовой культуры, опрокидывая агаровые пластины вверх дном через отверстие мешка. Пакеты встряхивали для равномерного распределения спор. Культуры в мешках выращивали до споруляции, а затем спорулирующее зерно переносили в мешки из бананового волокна размером 7 см × 10 см с сеткой 3,18 мм. Обработка щавелевой кислотой готовилась в виде 2,8% раствора щавелевой кислоты в сиропе сахарозы 1:1 (w/v). Пять миллилитров этого раствора капали в щели между всеми рамками в улье, которые были покрыты пчелами. Уровень клещей измерялся с помощью промывки этанолом в начале и в конце эксперимента.
Доступность данных
Наборы данных, созданные в ходе настоящего исследования и/или проанализированные в ходе него, можно получить у соответствующего автора по обоснованному запросу. Типовой образец M. brunneum JH1078 был депонирован в Коллекцию культур Службы сельскохозяйственных исследований Министерства сельского хозяйства США (NRRL), номер доступа NRRL 68016.
Ссылки
1.Glare, T. R. et al. Have biopesticides come of age?. Trends Biotechnol. 30, 250–258 (2012). Article CAS PubMed Google Scholar
2.Leahy, J., Mendelsohn, M., Kough, J., Jones, R. & Berckes, N. Biopesticide oversight and registration at the US Environmental Protection Agency. In Biopesticides: State of the Art and Future Opportunities (eds Gross, A. D. et al.) 3–18 (American Chemical Society Symposium Series, 2014).
3.Arthurs, S. & Dara, S. K. Global status of microbial control programs and practices. J. Invert. Pathol. 165, 3 (2019). Article Google Scholar
4.Dubovskiy, M. et al. Can insects develop resistance to insect pathogenic fungi?. PLoS One 8, e60248 (2013). Article ADS CAS PubMed PubMed Central Google Scholar
5.Damalas, C. A. & Koutroubas, S. D. Current status and recent developments in biopesticide use. Agriculture 8, 1–6 (2018). Article Google Scholar
6.Roberts, D. W. & Campbell, A. S. Stability of entomopathogenic fungi. Misc. Publ. Entomol. Soc. Am. 10(3), 19–76 (1977). Google Scholar
7.Lovett, B. & St. Leger, R. J. Stress is the rule rather than the exception for Metarhizium. Curr. Genet. 61, 253–261 (2015). Article CAS PubMed Google Scholar
8.Ortiz-Urquiza, A., Luo, Z. & Keyhani, N. O. Improving mycoinsecticides for insect biological control. Appl. Microbiol. Biotechnol. 99, 1057–1068 (2015). Article CAS PubMed Google Scholar
9.Berthoud, H., Imdorf, A., Haueter, M., Radloff, S. & Neumann, P. Virus infections and winter losses of honey bee colonies (Apis mellifera). J. Apic. Res. 49(1), 60–65 (2010). Article Google Scholar
10.Le Conte, Y., Ellis, M. & Ritter, W. Varroa mites and honey bee health: Can Varroa explain part of the colony losses?. Apidologie 41, 353–363 (2010). Article Google Scholar
11.van Engelsdorp, D. & Meixner, M. D. A historical review of managed honey bee populations in Europe and the United States and the factors that may affect them. J. Invert. Pathol. 103, S80–S95 (2010). Article Google Scholar
12.Goulson, D., Nicholls, E., Botı́as , C. & Rotheray, E. L. Bee declines driven by combined stress from parasites, pesticides, and lack of flowers. Science 347, 6229 (2015). Article CAS Google Scholar
13.Lee, K. V. et al. A national survey of managed honey bee 2013–2014 annual colony losses in the USA. Apidologie 46, 292–305 (2015). Article Google Scholar
14.Steinhauer, N. A. et al. A national survey of managed honey bee 2012–2013 annual colony losses in the USA: Results from the Bee Informed Partnership. J. Apic. Res. 53, 1–18 (2014). Article Google Scholar
15.Boecking, O. & Genersch, E. Varroosis—the ongoing crisis in bee keeping. J. Consum. Protect. Food Saf. 3(2), 221–228 (2008). Article Google Scholar
16.Gallai, N., Salles, J.-M., Settele, J. & Vaissière, B. E. Economic valuation of the vulnerability of world agriculture confronted with pollinator decline. J. Ecol. Econ. 68, 810–821 (2009). Article Google Scholar
17.Ramsey, S. D. et al. Varroa destructor feeds primarily on honey bee fat body tissue and not hemolymph. Proc. Natl. Acad. Sci. 116, 1792–1801 (2019). Article CAS PubMed PubMed Central Google Scholar
18.Chen, Y. P. & Siede, R. Honey bee viruses. Adv. Virus Res. 70, 33–80 (2007). Article CAS PubMed Google Scholar
19.Drummond, F. et al. Managed pollinator CAP coordinated agricultural project: The first two years of the stationary hive project: Abiotic site effects. Am. Bee J. 152(4), 369–372 (2012). Google Scholar
20.Goodwin, R. M., Taylor, M. A., Mcbrydie, H. M. & Cox, H. M. Drift of Varroa destructor infested worker honey bees to neighbouring colonies. J. Apicult. Res. 45(3), 155–156 (2006). Article Google Scholar
21.Kralj, J., Brockmann, A., Fuchs, S. & Tautz, J. The parasitic mite Varroa destructor affects non-associative learning in honey bee foragers, Apis mellifera L. . J. Comp. Physiol. 193, 363–370 (2007). Article Google Scholar
22.Seeley, T. D. & Smith, M. L. Crowding honeybee colonies in apiaries can increase their vulnerability to the deadly ectoparasite Varroa destructor. Apidologie 46, 716–727 (2015). Article Google Scholar
23.Nolan, M. P. & Delaplane, K. S. Distance between honey bee Apis mellifera colonies regulates populations of Varroa destructor at a landscape scale. Apidologie 48, 8–16 (2017). Article Google Scholar
24.Wallner, K. Varroacides and their residues in bee products. Apidologie 30, 235–238 (1999). Article CAS Google Scholar
25.Mullin, C. A. et al. High levels of miticides and agrochemicals in North American apiaries: Implications for honey bee health. PLoS One 5, e9754 (2010). Article ADS PubMed PubMed Central CAS Google Scholar
26.Fulton, C. A., Huff Hartz, K. E., Reeve, J. D. & Lydya, M. J. An examination of exposure routes of fluvalinate to larval and adult honey bees (Apis mellifera). Environ. Toxicol. Chem. 38, 1356–1363 (2019). Article CAS PubMed Google Scholar
27.Berry, J. A., Hood, W. M., Pietravalle, S. & Delaplane, K. S. Field-level sublethal effects of approved bee hive chemicals on honey bees (Apis mellifera L.). PLoS One 8, 76536 (2013). Article ADS CAS Google Scholar
28.Boncristiani, H. et al. Direct effect of acaricides on pathogen loads and gene expression levels in honey bees Apis mellifera. J. Insect Physiol. 58, 613–620 (2012). Article CAS PubMed Google Scholar
29.O’Neal, S. T., Brewster, C. C., Bloomquist, J. R. & Anderson, T. D. Amitraz and its metabolite modulate honey bee cardiac function and tolerance to viral infection. J. Invertebr. Pathol. 149, 119–126 (2017). Article CAS PubMed Google Scholar
30.Locke, B., Forsgren, E., Fries, I. & de Miranda, J. R. Acaricide treatment affects viral dynamics in Varroa destructor infested honey bee colonies via both host physiology and mite control. Appl. Environ. Microbiol. 78, 227–235 (2012). Article CAS PubMed PubMed Central Google Scholar
31.Haarmann, T., Spivak, M., Weaver, D., Weaver, B. & Glenn, T. Effects of fluvalinate and coumaphos on queen honey bees (Hymenoptera: Apidae) in two commercial queen rearing operations. J. Econ. Entomol. 95, 28–35 (2002). Article CAS PubMed Google Scholar
32.Pettis, J. S., Collins, A. M., Wilbanks, R. & Feldlaufer, M. F. Effects of coumaphos on queen rearing in the honey bee, Apis mellifera L.. Apidologie 35, 605–610 (2004). Article CAS Google Scholar
33.Collins, M., Pettis, J. S., Wilbanks, R. & Feldlaufer, M. F. Performance of honey bee (Apis mellifera) queens reared in beeswax cells impregnated with coumaphos. J. Apic. Res. 43, 128–134 (2004). Article CAS Google Scholar
34.Burley, L. M., Fell, R. D. & Saacke, R. G. Survival of honey bee (hymenoptera: Apidae) spermatozoa incubated at room temperature from drones exposed to miticides. J. Econ. Entomol. 101, 1081–1087 (2008). Article PubMed Google Scholar
35.Collins, M. & Pettis, J. S. Correlation of queen size and spermathecal contents and effects of miticide exposure during development. Apidologie 44, 351–356 (2013). Article CAS Google Scholar
36.Johnson, R. M., Pollock, H. S. & Berenbaum, M. R. Synergistic interactions between in-hive miticides in Apis mellifera. J. Econ. Entomol. 102, 474–479 (2009). Article CAS PubMed Google Scholar
37.Forkpah, C., Dixon, L. R., Fahrbach, S. E. & Rueppell, O. Xenobiotic effects on intestinal stem cell proliferation in adult honey bee (Apis mellifera L.) workers. PLoS One 9, e91180 (2014). Article ADS PubMed PubMed Central CAS Google Scholar
38.Dhooria, S. & Agarwal, R. Amitraz, an underrecognized poison: A systematic review. Indian J. Med. Res. 144, 348–358 (2016). Article CAS PubMed PubMed Central Google Scholar
39.Knowles, C. O. & Gayen, A. K. Penetration, metabolism and elimination of amitraz and N-(2,4-dimethylphenyl)-N-methylformamidine in Southwestern corn borer larvae (Lepidoptera: Pyralidae). J. Econ. Entomol. 76, 410–413 (1983). Article CAS Google Scholar
40.Krupke, C. H., Hunt, G. J., Eitzer, B. D., Andino, G. & Given, K. Multiple routes of pesticide exposure for honey bees living near agricultural fields. PLoS One 7, e29268. https://doi.org/10.1371/journal.pone.0029268 (2012). Article ADS CAS PubMed PubMed Central Google Scholar
41.Gonzalez-Cabrera, J. et al. A single mutation is driving resistance to pyrethroids in European populations of the parasitic mite, Varroa destructor. J. Pest Sci. 91, 1137–1144 (2018). Article Google Scholar
42.Pettis, J. S. A scientific note on Varroa destructor resistance to coumaphos in the United States. Apidologie 35, 91–92 (2004). Article Google Scholar
43.Elzen, P. J., Baxter, J. R., Spivak, M. & Wilson, W. T. Amitraz resistance in Varroa: New discovery in North America. Am. Bee J. 139, 362 (1999). Google Scholar
44.Chandler, D. et al. Fungal biocontrol of Acari. Biocontrol Sci. Technol. 10, 357–384 (2000). Article Google Scholar
45.Kanga, L. H. B., James, R. R. & Boucias, D. G. Hirsutella thompsonii and Metarhizium anisopliae as potential microbial control agents of Varroa destructor, a honey bee parasite. J. Invertebr. Pathol. 81, 175–184 (2002). Article CAS PubMed Google Scholar
46.Meikle, W. G., Mercadier, G., Holst, N., Nansen, C. & Girod, V. Impact of a treatment of Beauveria bassiana (Deuteromycota: Hyphomycetes) on honeybee (Apis mellifera) colony health and on Varroa destructor mites (Acari: Varroidae). Apidologie 39, 247–259 (2008). Article Google Scholar
47.Rodríguez, M., Gerding, M., France, A. & Ceballos, R. Evaluation of Metarhizium anisopliae var anisopliae qu-M845 isolate to control Varroa destructor (Acari: Varroidae) in laboratory and field trials. Chil. J. Agric. Res. 69, 541–547 (2009). Article Google Scholar
48.Kanga, L. H. B., Adamczyk, J., Patt, J., Gracia, C. & Cascino, J. Development of a user-friendly delivery method for the fungus Metarhizium anisopliae to control the ectoparasitic mite Varroa destructor in honey bee, Apis mellifera, colonies. Exp. Appl. Acarol. 52, 327–342 (2010). Article PubMed Google Scholar
49.Kanga, L. H. B., Jones, W. A. & James, R. R. Field trials using the fungal pathogen, Metarhizium anisopliae (Deuteromycetes: Hyphomycetes) to control the ectoparasitic mite, Varroa destructor (Acari: Varroidae) in honey bee, Apis mellifera (Hymenoptera: Apidae) colonies. J. Econ. Entomol. 96, 1091–1109 (2003). Article PubMed Google Scholar
50.Kanga, L. H. B., Jones, W. A. & Gracia, C. Efficacy of strips coated with Metarhizium anisopliae for control of Varroa destructor (Acari: Varroidae) in honey bee colonies in Texas and Florida. Exp. Appl. Acarol. 40, 249 (2006). Article PubMed Google Scholar
51.James, R. R. Microbial control for invasive arthropod pests of honey bees. In Progress in Biological Control, Use of Microbes for Control and Eradication of Invasive Arthropods (eds Hajek, A. E. et al.) 4–15 (Springer, 2009). Google Scholar
52.Kraus, B., Velthuis, H. H. W. & Tingek, S. Temperature profiles of the brood nests of Apis cerana and Apis mellifera colonies and their relation to Varroosis. J. Apic. Res 37, 175–181 (1998).Article Google Scholar
53.Rodríguez, M., Gerding, M. & France, A. Selection of entomopathogenic fungi to control Varroa destructor (Acari: Varroidae). Chil. J. Agric. Res. 69, 534–540 (2009). Article Google Scholar
54.James, R. R., Hayes, G. & Leland, J. E. Field trials on the microbial control of Varroa with the fungus Metarhizium anisopliae. Am. Bee J. 146, 968–972 (2006). Google Scholar
55.St. Leger, R. J. & Wang, C. Genetic engineering of fungal biocontrol agents to achieve greater efficacy against insect pests. Appl. Microbiol. Biotechnol. 85, 901–907 (2010). Article CAS PubMed Google Scholar
56.Stamets, P. Mycoattractants and mycopesticides, U.S. Patent No. 8501207B2. U.S. Patent and Trademark Office (2013).
57.Lovett, B. & St Leger, R. J. Genetically engineering better fungal biopesticides. Pest Manag. Sci. 74, 781–789 (2018). Article CAS PubMed Google Scholar
58.Rangel, D. E. N., Anderson, A. J. & Roberts, D. W. Growth of Metarhizium anisopliae on non-preferred carbon sources yields conidia with increased UV-B tolerance. J. Invert. Pathol. 93, 127–134 (2006). Article CAS Google Scholar
59.Ibrahim, L., Butt, T. M. & Jenkinso, P. Effect of artificial culture media on germination, growth, virulence and surface properties of the entomopathogenic hyphomycete Metarhizium anisopliae. Mycol. Res. 106(6), 705–715 (2002). Article Google Scholar
60.Nahar, P. B. et al. Effect of repeated in vitro sub-culturing on the virulence of Metarhizium anisopliae against Helicoverpa armigera (Lepidoptera: Noctuidae). Biocontrol Sci. Technol. 18, 337–355 (2008). Article Google Scholar
61.Peck, D. T. & Seeley, T. D. Mite bombs or robber lures? The roles of drifting and robbing in Varroa destructor transmission from collapsing honey bee colonies to their neighbors. PLoS One 14(6), 0218392 (2019). Google Scholar
62.Gregorc, A., Knight, P. R. & Adamczyk, J. Powdered sugar shake to monitor and oxalic acid treatments to control Varroa mites (Varroa destructor Anderson and Trueman) in honey bee (Apis mellifera) colonies. J. Apic. Res. 56, 71–75 (2017). Article Google Scholar
63.Dietemann, V. et al. Standard methods for Varroa research. J. Apic. Res. 52(1), 1–54 (2013). Google Scholar
64.Han, S. K. et al. OASIS 2: Online application for survival analysis 2 with features for the analysis of maximal lifespan and healthspan in aging research. Oncotarget 7, 56147–56152 (2016). Article PubMed PubMed Central Google Scholar
65.Braga, G. U. L., Flint, S. D., Messias, C. L., Anderson, A. J. & Roberts, D. W. Effect of UV-B on conidia and germlings of the entomopathogenic hyphomycete Metarhizium anisopliae. Mycol. Res. 105(7), 874–882 (2001). Article Google Scholar
Благодарности
Мы хотели бы поблагодарить Силену Харпер, Фадиме Йетис и Родриго Гизара за техническую поддержку в поле и лаборатории. Эта работа была частично профинансирована Фондом WWW под руководством Брайса, Эмери и Адама Родса; Департаментом сельского хозяйства штата Вашингтон (WSDA) Specialty Crop Block Grant K2531; Thurber Endowment for Pollinator Ecology; и Национальным институтом продовольствия и сельского хозяйства США, Hatch 1007314.
Информация об авторах
Авторы и аффилиации
Факультет энтомологии, Университет штата Вашингтон, Пулман, штат Вашингтон, США.
Дженнифер О. Хан, Николас Л. Нейгер, Брэндон К. Хопкинс и Уолтер С. Шеппард
Fungi Perfecti LLC, Олимпия, штат Вашингтон, США
Дэвид Шумерлин и Пол Э. Стаметс
Факультет патологии растений, Университет штата Вашингтон, Пулман, штат Вашингтон, США
Лори М. Каррис
Вклад
J.O.H., N.L.N., L.M.C. и W.S.S. разработали дизайн исследования. J.O.H., N.L.N. и B.K.H. выполнили исследование. P.E.S. и D.S. предоставили живые культуры и провели ценное обсуждение. J.O.H. предоставила все использованные изображения. J.O.H. и N.L.N. проанализировали данные. J.O.H., N.L.N. и W.S.S. написали статью. Все авторы прорецензировали рукопись.
Автор-корреспондент
Переписка с Уолтером С. Шеппардом.
Этические декларации
Конкурирующие интересы
J.O.H., N.L.N., L.M.C. и W.S.S. подали заявку на интеллектуальную собственность, связанную со штаммом JH1078 и методами, использованными для его получения. B.K.H., D.S. и P.E.S. заявляют об отсутствии конкурирующих интересов.
Дополнительная информация
Примечание издателя
Springer Nature сохраняет нейтралитет в отношении юрисдикционных претензий в опубликованных картах и институциональной принадлежности.
Дополнительная информация
Права и разрешения
Открытый доступ Эта статья лицензирована по лицензии Creative Commons Attribution 4.0 International License, которая разрешает использование, совместное использование, адаптацию, распространение и воспроизведение на любом носителе или в любом формате, при условии, что вы отдаете должное автору (авторам) и источнику, даете ссылку на лицензию Creative Commons и указываете, были ли внесены изменения. Изображения или другие материалы третьих лиц в этой статье включены в статью по лицензии Creative Commons, если иное не указано в кредитной строке к материалу. Если материал не включен в лицензию Creative Commons статьи, а предполагаемое использование не разрешено законом или выходит за рамки разрешенного использования, вам необходимо получить разрешение непосредственно у правообладателя. Чтобы ознакомиться с копией этой лицензии, посетите сайт http://creativecommons.org/licenses/by/4.0/.

Добавить комментарий