Аннотация
Возрастное разделение труда между рабочими особями является фундаментальной чертой жизненной истории многих социальных насекомых, включая западную медоносную пчелу Apis mellifera L. Обширные исследования причин наиболее выраженного перехода от выполнения задач в гнезде к добыче корма вне гнезда указывают на гормональную регуляцию сложных физиологических изменений. Однако ближайшие нейробиологические механизмы, вызывающие изменение поведенческого репертуара, до сих пор не поняты и требуют новых подходов для полной характеристики. Таким образом, мы создали первый комплексный микрочип моноклональных антител у медоносных пчел с 16 320 антителами для прямой идентификации белков в мозге, которые регулируют переход к кормовой деятельности. Основные белки маточного молочка (MRJP) 1 и MRJP3 были идентифицированы как потенциальные белки-эффекторы и подверглись дальнейшему исследованию. Серия экспериментальных манипуляций с поведенческим переходом рабочих привела к изменению количества MRJP1 и MRJP3 в соответствии с их предполагаемой функциональной ролью. Инъекция MRJP в мозг приводила к увеличению реверсии задачи от кормления к кормлению и уменьшению регрессии задачи от кормления к кормлению, в то время как последняя увеличивалась при инъекции антител к MRJP. Наконец, снижение экспрессии MRJP1 и MRJP3 с помощью RNAi инъекции в мозг увеличивало переход от выкармливания в улье к добыче корма вне улья, подтверждая причинно-следственную роль этих двух белков в непосредственной регуляции поведения и жизненной истории рабочих медоносных пчел. Среди партнеров по взаимодействию MRJP1 и MRJP3 в мозге медоносной пчелы были и другие регуляторы поведения и жизненной истории медоносной пчелы. Таким образом, наше революционное методологическое усовершенствование анализа протеома у медоносных пчел выявило новые регуляторы поведения медоносных пчел, расширило наше понимание функциональной плейотропии MRJPs и поддержало общую модель регуляции возрастного разделения труда у медоносных пчел, основанную на питании.
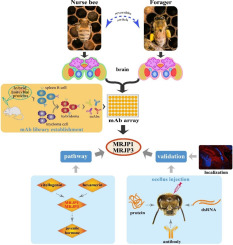
1.Введение
Социальные группы получают большую часть своего конкурентного преимущества над одиночными конкурентами, потому что их члены могут эффективно разделить труд, специализируясь на определенных задачах [1], [2]. В дополнение к наиболее фундаментальному разделению на репродуктивных и нерепродуктивных рабочих, дальнейшая специализация среди рабочих характеризует большинство социальных обществ насекомых, включая колонии западной медоносной пчелы (Apis mellifera L.). Рабочие пчелы проходят через возрастное разделение труда с ярко выраженным переходом от выполнения различных задач в улье к добыванию пищи вне его [3]. Когда рабочие молоды, они выполняют различные действия в улье, но одной из основных задач является выхаживание, обеспечение кормом и другим уходом расплода, который развивается в восковых ячейках и полностью зависит от кормилиц. Кормление не менее важно, и переход рабочих от кормления к корму имеет глубокие последствия для жизненной истории отдельных особей и колонии [4], [5], [6]. Причины этого сложного перехода были широко изучены на различных уровнях биологической организации [7], [8], [9], [10], [11].
Внутренние и внешние факторы определяют возраст, в котором происходит переход от выполнения задач в улье к добыванию корма: В частности, на переход к фуражировке влияют расплод и феромон расплода [12], мандибулярный феромон королевы [13], а также фуражиры и их феромон [9], [14]. Различные формы стресса на уровне особи и колонии могут ускорить переход к фуражировке [10], [15], [16]. Основные эндокринные регуляторы, включая инсулиноподобный сигналинг, ювенильный гормон и вителлогенин, играют центральную роль в переводе внешних воздействий в согласованные физиологические изменения при переходе от кормления к корму [6], [8], [17], а фуражиры возвращаются к кормлению только при исключительных обстоятельствах [5]. Существуют выраженные генотипические различия в возрасте этого перехода среди популяций медоносных пчел [18], [19], и генетические исследования указывают на множество влиятельных локусов [20], а также крупномасштабные сдвиги в транскриптоме мозга [10], которые сопровождают значительную реорганизацию нейронов во время перехода [21]. На протеомном уровне также было выявлено несколько различий между кормилицами и фуражирами, которые коррелируют с альтернативными поведенческими состояниями [22], [23], [24].
Помимо прочих задач, кормилицы в улье кормят растущий выводок сложным белковым секретом, содержащим несколько основных белков маточного молочка (MRJPs) [25]. В дополнение к своей основной функции в качестве корма для расплода, MRJP могут выполнять и другие функции в жизненной истории медоносной пчелы, включая влияние на поведение [26], [27], [28]. Кормление расплода влечет за собой физиологические издержки для кормилиц, поскольку истощает внутренние питательные вещества, включая белок яичного желтка вителлогенин [29]. Этот белок также обладает плейотропными сигнальными эффектами, и его истощение приводит к повышению уровня ювенильного гормона и, предположительно, к взаимодействию с инсулиноподобной сигнализацией, вызывая начало фуражировки [7], [8]. Механизмы, лежащие в основе перехода от кормления к питанию в мозге, включают изменения протеинкиназы G и биогенных аминов [30], [31] и рост нейронов [32]. Однако причинно-следственные связи между этими результатами еще предстоит выяснить, и неясно, могут ли пищевые воздействия также действовать непосредственно на мозг, чтобы повлиять на начало фуражировки у рабочих медоносных пчел. Таким образом, мы разработали первый массив моноклональных антител (mAb) для медоносной пчелы и использовали его для углубленного изучения изменений протеома мозга, которые влияют на сложный поведенческий переход от пчел-кормилиц в улье к фуражирам снаружи. Наш новый подход предполагает регуляторную роль MRJPs в разделении труда у медоносных пчел, что мы подтвердили в ходе обширных последующих экспериментов. Эти результаты подтверждают полезность массива мАб, проливают новый свет на регуляцию возрастного полиэтизма у медоносных пчел и расширяют функциональную плейотропию MRJPs.
2.Материалы и методы
Все эксперименты проводились с медоносными пчелами (Apis mellifera ligustica), выращенными в Институте пчеловодческих исследований Китайской академии сельскохозяйственных наук, Пекин, Китай. После создания первого комплексного набора моноклональных антител (mAb) для медоносных пчел (Эксперимент 1) мы использовали этот новый инструмент для сравнения протеома мозга медведицы и кормилицы в серии наблюдательных и манипуляционных экспериментов (Эксперименты 1-3). Исходя из того, что основные белки маточного молочка (MRJP) демонстрируют наибольшие различия среди успешно идентифицированных и подтвержденных белков, мы приступили к описанию их пространственной экспрессии в мозге (Эксперимент 2) и их партнеров по белковому взаимодействию (Эксперимент 4). Чтобы исследовать причинное участие MRJP1 и MRJP3, мы манипулировали уровнями этих белков посредством инъекций в мозг RNAi, антител или самих MRJPs и наблюдали за изменениями в переходе от кормления к питанию или его обратном направлении (эксперименты 5, 6).
2.1. Эксперимент 1: сравнение медсестры и фуражира с использованием набора моноклональных антител (mAbs)
Только что появившихся рабочих получали из выводковых рамок нескольких колоний, которые перед появлением рабочих переносили в инкубатор (34 °C и относительная влажность 80 %). В течение 24 ч появившихся рабочих пометили краской в виде точки на грудной клетке и вернули в соответствующие ульи. Из каждой когорты (= повтор) 80 медведиц были собраны с расплодных рамок во время ухода за расплодом, определяемого как просовывание головы в ячейки, содержащие молодых личинок, в течение не менее 10 с. Соответственно, 80 фуражиров были отобраны у входа в улей, когда они возвращались с пыльцой. Всех отобранных пчел немедленно анестезировали при 4 °C, после чего проводили вскрытие мозга в соответствии с ранее описанными методами [33]. Следует отметить, что ткани желез, соединенные с мозгом, не должны быть полностью удалены. Выделенные мозги немедленно замачивали в растворе ингибитора протеаз (Roche, Базель, Швейцария) и хранили при -80 °C до дальнейшего использования.
2.1.1. Создание библиотеки mAb и микрочипов для медоносных пчел
Для создания углубленной библиотеки антител, mAbs были получены путем иммунизации мышей в соответствии со стандартными протоколами [34]. Для увеличения охвата библиотеки в качестве источников антигенов были выбраны репрезентативные образцы нескольких стадий развития (эмбрионы на 3-й день, личинки на 6-й день, куколки на 12-й день и смесь мозгов взрослых рабочих). Замороженные образцы пчел были объединены вместе, а затем измельчены в мелкий порошок жидким азотом в присутствии 2 % поливинилпирролидона. Все химические вещества были приобретены у компании Sigma-Aldrich (Сент-Луис, МО, США), если не указано иное. Пять объемов ледяного экстракционного буфера [pH 8,0, ингредиенты: 200 мМ Трис-HCl, 200 мМ NaCl, 50 мМ аскорбат натрия, 5 мМ Na4EDTA, 10% глицерин, 1% NP-40, 1% Triton X-100, 1% Tween-20, 0,25% метабисульфит натрия, коктейль ингибиторов протеаз (Roche, Базель, Швейцария), 2 мМ PMSF] добавляли для лизиса образцов. Образцы осторожно перемешивали при 4 °C в течение 2 ч. Полученные растворы центрифугировали при 15000g в течение 30 мин для получения супернатанта.
Экстрагированные белки в супернатанте смешивали с полным адъювантом Фрейнда, чтобы использовать в качестве антигенов. Мышей BALB/c иммунизировали 4 раза с интервалом в 14 дней смесью антигенов. Клетки селезенки мышей были выделены и слиты с линией клеток P3X63Ag8.653 для получения клеток гибридомы. Используя полиэтиленгликоль в качестве адъюванта, клетки гибридомы проверяли методом ИФА, чтобы убедиться, что все отобранные клоны способны обнаруживать антиген в концентрации <1 × 10-8 М. Отобранные клоны культивировали для расширения, и антитела получали коммерческим путем по стандартным протоколам (Abmart Ltd., Шанхай, Китай). Каждое антитело наносили 10 нл раствора 1 мкг/мкл на пятно на поверхность предметных стекол микроскопа, покрытых нитроцеллюлозой (чип FAST, Capitalbio, Пекин, Китай; Arrayjet Ltd., Рослин, Великобритания) при 4 °C и хранили при -80 °C до использования. Перед инкубацией слайды микрочипов с антителами промывали, а затем блокировали 10 % БСА на ночь при 4 °C.
2.1.2. Сравнение протеома головного мозга
Для сравнения протеома мозга между медсестрами и фуражирами белки были выделены из замороженного мозга 50 медсестер и 50 фуражиров в каждой биологической копии. В каждом опыте анализировали три биологические копии, и эксперимент включал три независимых испытания. После того как первые технические реплики показали высокую воспроизводимость, дальнейшие технические реплики не проводились.
Разбавленный раствор белка (1 мкг/мкл) был помечен NHS-биотином (Molecular Probes, Карлсбад, Калифорния, США). Эффективность мечения проверяли методом вестерн-блоттинга (ВБ; см. ниже). Меченые образцы белка разводили до конечной концентрации 0,1 мкг/мкл с помощью TBS в присутствии 0,1 % Tween-20 (TBS + 0,1 % T20) и 10 % BSA. Это разведение использовали для инкубации микрочипов при комнатной температуре в течение 60 мин. После трех последующих промывок антиген-конъюгированные микрочипы инкубировали с Cy3-меченым стрептавидином (1:5000) при комнатной температуре в течение 60 мин. После четырех дополнительных промывок в TBS + 0,5 % T20 и двух заключительных промывок в ddH2O слайды центрифугировали для удаления остатков буфера и высушивали. Слайды сканировали прибором Genepix (Axon Instruments, Union City, CA, США) и определяли сигналы флуоресценции Cy3 при 570 нм.
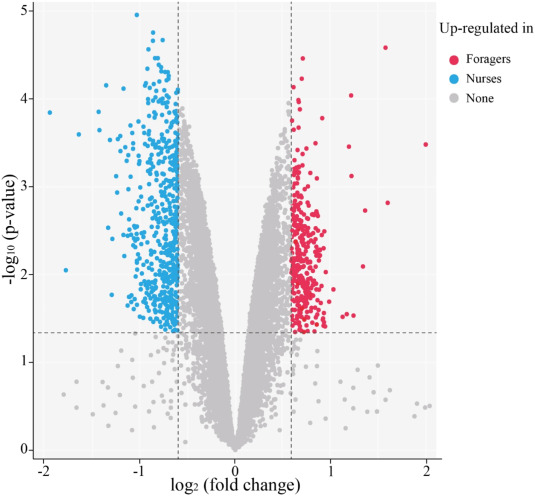
Для оценки дифференциального обилия белков интенсивность флуоресценции Cy3 была определена с помощью программного обеспечения GenePix 6.0 (Axon Instruments, Union City, CA, USA) и далее проанализирована с помощью пакета limma (http://bioconductor.org/). Необработанные данные были нормализованы путем коррекции фона и квантильной нормализации с помощью модулей «Background Correct» и «Normalize Between Arrays», соответственно. Для выявления различий применяли отсечку изменения фолда в 1,5 раза и отсечку p-значения в 0,05.
2.1.3. Выделение белков методом иммунопреципитации
Для выделения и последующей идентификации кандидатов с наиболее значительными различиями между кормилицами и фуражирами, мАб, соответствующие 500 лучшим пятнам массива, были использованы для экспериментов по иммунопреципитации (IP): Для каждого mAb 1 мг экстрагированного общего белка из объединенных голов рабочих пчел готовили на смоле protein G в течение 4 ч при 4 °C (Invitrogen, Carlsbad, CA, USA). После центрифугирования супернатант инкубировали с конъюгированным с цианоген бромидом антителом при 4 °C в течение ночи. Комплекс IP собирали после центрифугирования, повторно растворяли в 0,2 М растворе глицина (pH 2,5) и анализировали методом ЖХ-МС/МС для идентификации (см. ниже). Дополнительные образцы разделяли с помощью SDS-PAGE с последующим ВБ-анализом (см. ниже) для подтверждения аффинности осажденного белка к соответствующему mAb.
2.1.4. Идентификация белков с помощью ЖХ-МС/МС
Элюированные белковые комплексы подвергались трипсиновому перевариванию. Переваренные трипсином белки анализировали с помощью системы EASY-nLC 1000 (ThermoFisher Scientific, Waltham, MA, США), соединенной с масс-спектрометром Q-Exactive HF (ThermoFisher Scientific, Бремен, Германия). Для разделения в хроматографе использовали ацетонитрил с линейными градиентами от 2 % до 40 % в течение 60 мин. Тандемные масс-спектры обрабатывали в программе PEAKS Studio (версия 8.5, Bioinformatics Solutions Inc., Ватерлоо, Канада). PEAKS DB использовалась для поиска в базе данных NCBI Apis mellifera (загружена в апреле 2020 года, содержит 23 478 записей), объединенной с общей базой данных Repository of Adventitious Proteins (cRAP, загружена из The Global Proteome Machine Organization, апрель 2020 года). Параметры поиска были следующими: допуск родительского иона — 15 ppm; допуск фрагмента — 0,05 Da; фермент — трипсин; максимальное количество пропущенных расщеплений — 2; максимальное количество изменяемых PTM на пептид — 3; фиксированная модификация — карбамидометил (C, +57,02 Da); изменяемая модификация — окисление (M, +15,99 Da). Белок идентифицировался только в том случае, если он содержал хотя бы один уникальный пептид с не менее чем двумя спектрами (частота ложных обнаружений (FDR) ≤ 1,0 %) при поиске в базе данных fusion-decoy, что является более консервативной оценкой FDR по сравнению с подходом target decoy [35]. Модуль PEAKS Q использовался для количественного анализа обилия пептидов и белков. Обнаружение признаков и выравнивание проводилось с помощью алгоритмов ожидания-максимизации и высокоэффективного времени удерживания, соответственно. Нормализация для расчета соотношения образцов проводилась путем деления каждого значения на общий ионный ток (TIC) и умножения на TIC эталонного образца. На основе распределения сдвигов m/z, распределения сдвигов RT и качества соотношения устанавливались допуск на ошибку массы, диапазон времени удерживания и качество характеристики, соответственно. Количество белков во всех образцах определяли по интенсивности трех наиболее часто встречающихся пиков ионов-предшественников пептидов, переваренных трипсином. Белки в разных образцах считались значительно отличающимися по уровню обилия только в том случае, если их изменение было больше 1,5 раз и p-значение было <0,05.
2.1.5. Вестерн-блоттинг для подтверждения идентичности белков и количественных различий белков
Для подтверждения идентичности белков, идентифицированных с помощью IP и ЖХ-МС/МС, проводили Вестерн-блоттинг (ВБ) в соответствии со стандартными протоколами [36]. Кроме того, ВБ также служила для подтверждения различий в количестве целевых белков в мозге медсестры и фуражира, а также для количественного определения уровней белков в других экспериментальных группах (см. ниже). Вкратце, равные количества белков из отобранных образцов разделяли на полиакриламидных гелях SDS 12,5 % и переносили электрофоретически на мембраны из поливинилиденфторида (ПВДФ) при 42 В при комнатной температуре (КТ) в течение 2 ч. Эффективность переноса проверяли по наличию на мембранах предварительно окрашенных низкомолекулярных маркерных полос. Затем мембраны блокировали 5 % обезжиренным молоком при комнатной температуре в течение 1 ч, после чего инкубировали с первичными антителами и HRP-антимышиными IgG антителами. Иммунореактивные полосы визуализировали с помощью системы усиленной хемилюминесценции (Biouniquer, Китай) и экспонировали на рентгеновской пленке. Интенсивность сигнала оценивали с помощью программы ImageJ и нормировали на соответствующий сигнал тубулина.
2.1.6. 2D SDS-PAGE для дифференциации MRJPs
Из-за сходства молекулярных масс основных белков маточного молочка (MRJPs) и их изоформ, двумерный гель-электрофорез был проведен для дифференциации специфических белков в соответствии с установленными протоколами [37]. Вкратце, 100 мкг белков, выделенных из мозга медсестры, загружали на полоску IPG (NL, pH 3-10, GE Healthcare) и применяли условия для первого измерения электрофореза: 30 В в течение 12 ч, 500 В в течение 1 ч, 1000 В в течение 1 ч, 8000 В в течение 8 ч и 500 В в течение 4 ч. Второе измерение электрофореза проводилось как стандартный 10% SDS-PAGE. Гели переносили на PVDF мембраны для WB анализа (аналогично анализу одномерных гелей, описанному выше). Препаративные гели проводили параллельно с 1 мг белков, загруженных на полосу IPG. После окрашивания серебром целевые белковые пятна вырезали из препаративного геля для дальнейшей МС идентификации (как описано выше).
2.2. Эксперимент 2: сравнение белков-кандидатов среди экспериментальных когорт медсестер и фуражиров
Чтобы получить кормилиц и фуражиров с разным физиологическим состоянием, две нормальные колонии, которые содержались рядом друг с другом не менее семи дней в стандартных условиях, были подвергнуты следующим манипуляциям: В течение дня, пока наблюдалась кормовая активность, из одной из колоний удаляли королеву с одной рамкой меда, одной рамкой пыльцы и двумя пустыми рамками для создания новой колонии. Старую колонию (OC) оставляли в улье на прежнем месте для сбора возвращающихся кормовых пчел, а оставшиеся две колонии, включая расплод, маток и всех не кормящих пчел, объединяли в новую колонию (NC) и переносили на новое место.
После появления нового расплода в КО некоторые из фуражиров были вынуждены вернуться к кормлению [38], а отсутствие фуражиров в НЦ заставило молодых пчел преждевременно начать кормовую деятельность [14]. Как только такое поведение наблюдалось после манипуляции, возвратившихся медсестер и контрольных фуражиров собирали из ОК, а преждевременно начавших фуражиров и контрольных медсестер — из НК. Фуражиров определяли по возвращению ко входу в улей с видимой пыльцой, а медсестер — по демонстрации кормления (голова в расплодной ячейке в течение не менее 10 с) на расплодном гребне.
Образцы из этих четырех групп использовались либо для количественной оценки уровней 42 белков-кандидатов, определенных в первом эксперименте с помощью SDS-PAGE (см. Результаты), либо для дальнейшей характеристики пространственного распределения MRJP1 и MRJP3 в мозге рабочих с помощью иммуногистохимического окрашивания in situ, следуя ранее установленному протоколу [39]. Мозг пчелы вскрывали и немедленно переносили в холодный раствор ацетона/метанола перед фиксацией в 6,7 мМ PBS, содержащем 4 % параформальдегида. Ткани обезвоживали в серии 50%-100% этанола перед фиксацией в ксилоле, затем встраивали в парапласт (Leica, Wetzlar, Германия). Смонтированные ткани разрезали на секции размером 5 мкм, а предметные стекла повторно обезвоживали в этаноле в убывающей серии от 100 % до 50 %. Затем предметные стекла промывали 3 раза 0,01 М PBS и переносили в 3 % раствор перекиси водорода для инкубации в течение 10 мин в темноте. После этого предметные стекла переносили в 5 %-ный раствор БСА на 20 мин для блокирования неспецифического связывания. Первичные антитела (мышиные анти-пчелиные MRJP1/MRJP3, Abmart Co., Шанхай) использовались в концентрации 1:500 в БСА для инкубации срезов в течение ночи при 4 °С. После этого срезы промывали 3 раза по 5 мин в PBS, затем переносили на антирабитовый IgG (разбавленный 1:50 в BSA) с Cy5 и инкубировали в течение 1 ч при комнатной температуре. Промытые срезы инкубировали с DAPI (4′, 6-диамидино-2-фенилиндол) в течение 5 мин при комнатной температуре в темноте. Наконец, срезы промывали 3 раза по 5 мин в PBS и покрывали каплей Fluoromount-GTM для гашения флуоресценции. Локализацию MRJP1 и MRJP3 исследовали и фотографировали под инвертированной микроскопией (Olympus Corp., Токио, Япония) с использованием возбуждающей длины волны 405 нм. Интенсивность мишеней обрабатывали с помощью программного обеспечения ImageJ (Национальные институты здоровья, Бетесда, Мэриленд, США).
2.3. Эксперимент 3: реакция MRJP на манипуляции с онтогенезом рабочих особей
Для дальнейшего изучения корреляции MRJP1 и MRJP3 с переходом от кормления в улье к корму, мы манипулировали скоростью онтогенеза рабочих, обрабатывая их феромоном этил олеат (EO) для замедления перехода к корму [9] или 8-Br-cGMP для ускорения этого перехода [40]. В общем, 6000 только что появившихся пчел с возрастными цветными метками были добавлены в 6 параллельных колоний (3 обработанные ЭО и 3 контрольные): каждая колония содержала две открытые расплодные рамки, три закрытые расплодные рамки, две рамки с небольшим количеством корма и соответствующее количество рабочих с одной королевой. Через две недели (через 15-17 дней после вылупления фокусных когорт) лечебные колонии кормили 50%-ным сиропом, содержащим 2,1 мг ЭО на грамм сахара, а контрольные ульи — 50%-ным сиропом. Фуражиров нормального возраста отбирали из лечебных колоний во время фуражировки через 18-20 дней после появления. Помеченных в улье рабочих собирали из ульев, обработанных ЭО, когда в контрольном улье уже не было помеченных особей. В общей сложности было собрано около 300 пчел с отложенными кастовыми переключателями.
В аналогичной установке шесть колоний обрабатывали 500 мкМ 8-Br-cGMP в 50 % сахарном сиропе через 7-10 дней после появления фокальных когорт для активации кормового гена [30], [41] и тем самым способствовали переходу к кормовой деятельности, контрольные ульи кормили 50 % необработанным сахарным сиропом. Через один-пять дней рабочие особи с ускоренным онтогенезом из обработанных колоний и контрольные рабочие особи из необработанных колоний были идентифицированы путем проведения тестов на рефлекс выдвижения хоботка (PER). Тестирование PER проводилось по ранее описанным протоколам [42] с использованием 50 % раствора сахарозы. Положительные ответы PER у рабочих из обработанных колоний интерпретировались как особи с вероятным ускоренным поведенческим онтогенезом, а отрицательные ответы из необработанных колоний считались контролем без ускорения. Эти особи были собраны для вскрытия мозга и последующего определения количества MRJP с помощью ВБ, как описано выше.
2.4. Эксперимент 4: ко-иммунопреципитация для выявления партнеров MRJP
9 мкг/мкл общего количества белков, выделенных из мозга пчелы, как описано выше, были использованы для экспериментов по ко-иммунопреципитации (Co-IP), которые проводились с помощью набора Pierce Co-IP Kit (Thermo Scientific) в соответствии с рекомендациями производителя. Вкратце, антитела MRJP1 и MRJP3 независимо друг от друга инкубировали с матрицей смолы для ковалентного связывания. Затем 1 мг общего белка мозга (гомогенат в 500 мкл PBS) очищали центрифугированием при 20 000 g в течение 30 мин и инкубировали в течение ночи со смолой, связанной с антителами, при температуре 4 °C. Затем бусины смолы удаляли магнитом из раствора, а белки, связанные с антителом MRJP1 или MRJP3, элюировали в элюирующем буфере. Элюированные белки нейтрализовали и затем идентифицировали с помощью МС, как описано выше.
2.5. Эксперимент 5: введение MRJPs и соответствующих mAbs in-vivo
Для изучения причинной роли MRJPs были изучены поведенческие последствия экспериментального увеличения или уменьшения количества MRJP1 и MRJP3. Рабочим пчелам вводили либо MRJP1, либо MRJP3, либо соответствующие антитела, следуя установленному протоколу введения в мозг [43]. Сначала были выделены и очищены белки MRJP1 (мономер) и MRJP3. Вкратце, 100 мг RJ растворяли в фосфатном буфере (pH 8,0). Суспензию центрифугировали в течение 20 мин при 4 °C, а надосадочную жидкость фильтровали с помощью мембранного фильтра 0,45 мкм. Фильтрат добавляли к 1 мл 20 мМ Tris-HCl (pH 8,0), затем концентрировали и обессоливали с помощью целлюлозной мембраны (Ultracel-50, Amicon Ultra-0,5, Millipore, США.). Концентрированный раствор очищали хроматографией на колонке Q Sepharose (GE Healthcare) и элюировали линейным градиентом NaCl от 0 до 1,0 М. Элюированный раствор разделяли на SDS-PAGE, полосы, содержащие MRJPs, собирали и очищали далее на колонке Superdex 75 10/300 GL (GE Healthcare), уравновешенной буфером, содержащим 20 мМ Tris-HCl (pH 8,0) и 150 мМ NaCl. Элюированный пик собирали и концентрировали для последующих экспериментов по инъекции. Как только белки для инъекций были готовы, рабочих пчел анестезировали на льду в течение 10 минут. Затем с помощью изготовленной на заказ стеклянной инъекционной иглы (внутренний диаметр 50 мкм) в среднее глазное яблоко (глубина прокола 1 мм) им вводили один из следующих препаратов (1 мкл на пчелу): 500 нг антител MRJP1 (AP04) или 500 нг антител MRJP3 (AP01) через 10-12 дней после появления (группа 1), 500 нг MRJP1 или MRJP3 через 15-17 дней после появления (группа 2), или 500 нг MRJP1 и MRJP3 в фуражиров, которым было 18-20 дней (группа 3). В группу 3 также была включена обработка 100 нг для изучения дозозависимости переключения с кормовых задач на задачи кормления. Кроме того, в качестве контроля в этих группах были протестированы инъекции 500 нг BSA или PBS, а также лечение «без инъекций» (показаны только контрольные данные BSA/PBS). Каждая группа в целом содержала 1500 индивидуально помеченных краской рабочих среди всех видов лечения, которые были равномерно распределены по 3 колониям. В течение пяти дней после обработки мы регистрировали кормовую активность меченых пчел, наблюдая за входом в улей, записывая и собирая всех пчел, которые были замечены возвращающимися в улей с видимым количеством пыльцы на задних ножках. Кормилиц идентифицировали, когда наблюдали, как они просовывали голову в ячейки, содержащие молодых личинок, в течение не менее 10 с.
2.6. Эксперимент 6: РНКи-опосредованный нокдаун MRJPs
Для подавления экспрессии генов mrjp1 и mrjp3 были синтезированы три siRNA (BGI, Китай) для каждого гена (последовательности см. в таблице S1) и смешаны в равных количествах. Рабочих медоносных пчел в возрасте от десяти до двенадцати дней собирали при проявлении кормящего поведения. В трех независимых повторах 260, 330 и 100 пчел были инъецированы siRNAs против mrjp1, а 210, 100 и 80 — siRNAs против mrjp3. В каждом случае меченым пчелам в возрасте 10-12 дней вводили 1 мкл PBS, содержащего 500 нг/мкл общей siRNA или отсутствие siRNA в качестве контроля, в мозг через среднее глазное яблоко. В каждой группе в качестве контроля использовали 50 пчел, которым вводили 1 мкл PBS, и 50 неинъецированных пчел из той же когорты. Испытуемые особи были возвращены в родной улей, и их кормовое поведение отслеживалось в течение пяти дней после инъекции, как описано выше. Количество пчел, перешедших от медсестер к фуражирам, регистрировалось ежедневно.
В конце эксперимента уровни MRJP1 и MRJP3 были определены в необработанных пчелах-кормилицах (n = 30) и пчелах-фуражирах (n = 30), а также в обработанных RNAi-пчелах, которые оставались кормилицами (n = 30) и которые перешли к фуражированию (n = 30), с помощью ВБ после сбора и вскрытия мозга, как описано выше.
2.6.1. Количественная ПЦР в реальном времени
Для изучения влияния РНК-интерференции на уровень мРНК MRJP1, общая РНК 30 РНК-инъецированных медсестер, которые перешли на кормление, и 30 медсестер, которые остались медсестрами после РНК-инъекции, а также 20 неманипулированных медсестер и 20 неманипулированных фуражиров была выделена (реагент TRLzol, Invitrogen, CA) и количественно определена на спектрофотометре NanoDrop ND1000 (ThermoFisher Scientific, Wilmington, DE, USA). Соответственно для MRJP3, мы обработали 30 конвертированных и 30 неконвертированных медведиц после лечения РНКи, а также 20 контрольных медведиц и 20 контрольных фуражиров. Набор реагентов PrimeScript RT, RR037 (Takara Bio, Киото, Япония) использовали для получения кДНК в соответствии с рекомендациями производителя (500 нг общей РНК использовали для реакции кДНК). Последовательности праймеров, использованных для амплификации мишеней MRJP1 и MRJP3, перечислены в Дополнительной таблице S2. Амплификация ПЦР и получение данных проводились на iQ5 Multicolor Real-Time PCR Detection System (Bio-Rad, Hercules, CA). Каждая ПЦР проводилась в 20 мкл реакции: 95 °C в течение 30 с, затем 40 циклов 95 °C в течение 5 с и 58 °C в течение 30 с, с отслеживанием кривой плавления от 55 до 95 °C. Глицеральдегид-3-фосфатдегидрогеназа (GAPDH) была выбрана в качестве референсного гена, а различия в экспрессии генов были рассчитаны методом 2-△△Ct [44]. Вероятность ошибки p < 0,05 считалась статистически значимой разницей в экспрессии генов с помощью одностороннего ANOVA (SPSS версия 18.0, SPSS Inc. Chicago, IL).
3.Результаты
3.1. Различия в белках головного мозга пчел-кормилиц и пчел-фуражиров
Для облегчения протеомных исследований у медоносной пчелы (Apis mellifera) была создана обширная библиотека моноклональных антител (mAb) из широкого спектра образцов, включающих различные органы и ткани на разных стадиях развития. Полученные 16 320 мАб были нанесены на микрочипы, которые затем можно было использовать для прямой оценки количественных различий между протеомом мозга пчел-кормилиц и пчел-фуражиров путем гибридизации. Примерно 10 % пятен мАбс (1622) показали значительно отличающуюся интенсивность сигнала (рис. 1; табл. S3). Белки, связанные с 500 пятнами массива с наибольшими различиями, были идентифицированы с помощью IP и MS, что позволило получить 83 уникальных, успешно идентифицированных белка (Таблица S4).
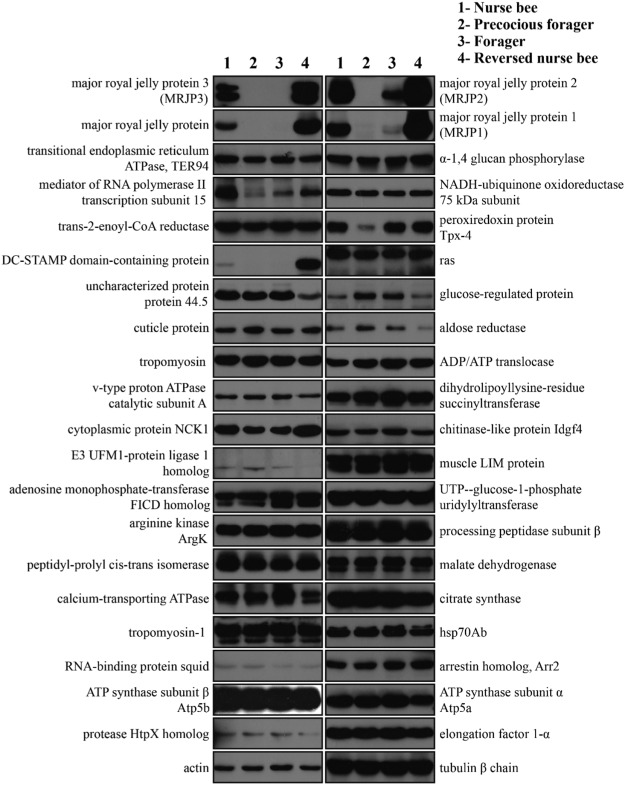
Среди идентифицированных белков 40 были подтверждены результатами ВБ (рис. 2; табл. S5). Среди самых разных белков (fold change >5), несколько были высокоизбыточными, которые были идентифицированы как MRJPs. Четыре антитела, распознающие MRJPs, были идентифицированы с помощью IP и MS-анализа, а для дифференциации сходных MRJPs были проведены двумерный гель-электрофорез и ВБ-анализ (рис. S1A). В общей сложности 32 mAb-распознанных пятна были помечены и вырезаны из геля, а 18 пятен были успешно идентифицированы с помощью МС (Таблица S6). Большинство пятен показали, что антитело «AP04» распознает различные изоформы MRJP1 и MRJP2 (рис. S1B), тогда как «AP03» распознает изоформы MRJP1 и MRJP4 (рис. S1C), а «AP01» специфично для изоформ MRJP3 (рис. S1D). Несмотря на то, что «AP03» связывало изоформы MRJP1 и MRJP4, мы интерпретировали это антитело как индикатор MRJP1, поскольку MRJP4 был в десять раз менее многочисленным, чем MRJP1, что также верно для других тканей [45], [46]. Специфичность «AP01» и «AP04» была дополнительно подтверждена ВБ-анализом с очищенными MRJP3 и MRJP1, соответственно (рис. S1E).
3.2. Валидация различий между MRJP в состояниях кормилицы и фуражира
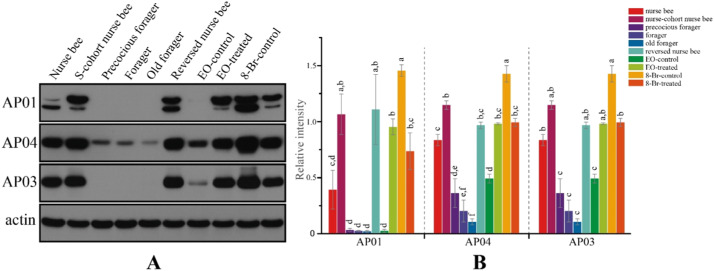
Для дальнейшего изучения взаимосвязи между обилием MRJP1 и MRJP3 и поведенческим состоянием рабочих, демографические манипуляции в эксперименте 2 были использованы для создания преждевременных фуражиров и медсестер, которые вернулись от фуражирской деятельности, для сравнения с обычными медсестрами и фуражирами по уровню MRJP в мозге. Последовательно, MRJP1 и MRJP3 были более многочисленными у медсестер, чем у фуражиров (рис. 3). В дополнительном эксперименте 3 кормление на уровне колонии этил олеатом, который, как известно, задерживает переход от кормления к питанию [9], увеличивало содержание MRJP1 и MRJP3 в мозге рабочих (рис. 3). Соответственно, кормление на уровне колонии 8-Br-cGMP, который индуцирует кормление [30], было связано с уменьшением MRJP1 и MRJP3 (рис. 3).
Чтобы исключить возможность того, что различия в измеренных белках были обусловлены загрязнением железистых тканей, отличительные особенности экспрессии MRJP1 и MRJP3 были дополнительно подтверждены иммуногистохимическим окрашиванием участков грибовидного тела и усиковой доли мозга контрольных кормилиц и фуражиров, а также преждевременных фуражиров и реверсированных кормилиц (рис. 4). MRJPs постоянно и значительно (p < 0,05) более многочисленны в обеих областях мозга рабочих в состоянии кормления по сравнению с состоянием кормления.
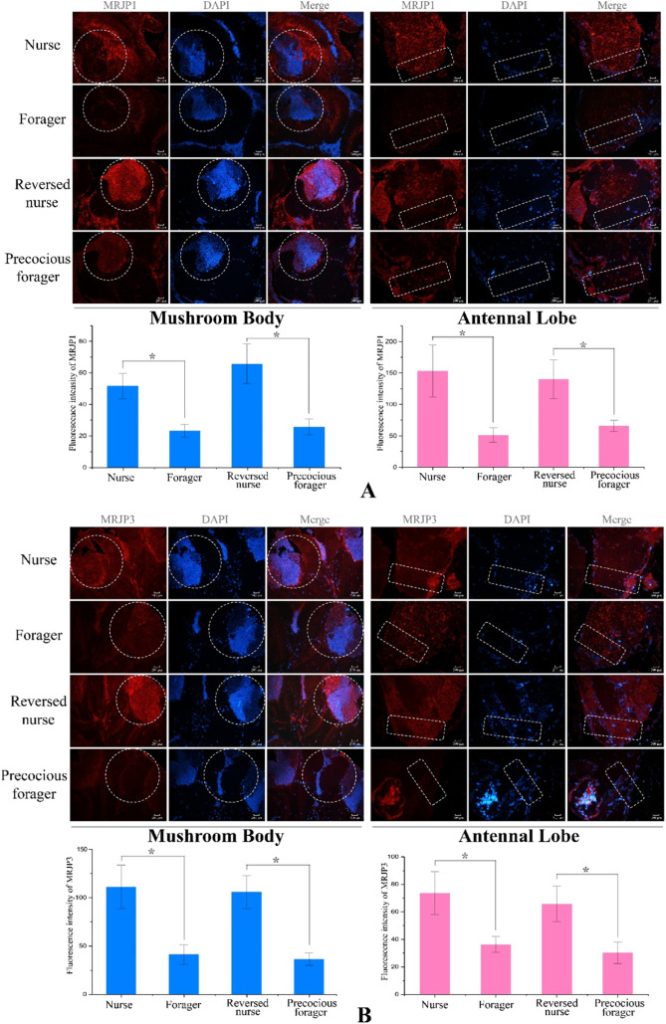
Манипуляции с MRJPs в естественных условиях указывают на их причинную роль в поведенческом переходе от кормления к питанию.
Причинное участие MRJPs в регуляции перехода от кормления к питанию было проверено путем изучения поведенческого эффекта инъекций в мозг MRJP1 (мономер), MRJP3 или соответствующих антител. Рабочие, которым вводили очищенный MRJP1 (мономер) и MRJP3, меньше переходили к кормовой деятельности (рис. 5A), в то время как введение анти-MRJP1 и анти-MRJP3 вызывало значительно больший процент перехода пчел к кормовой деятельности (рис. 5B). Соответственно, инъекция в мозг MRJP1 (мономер) и MRJP3 приводила к тому, что большая доля фуражиров возвращалась к кормящему поведению (рис. 5C).
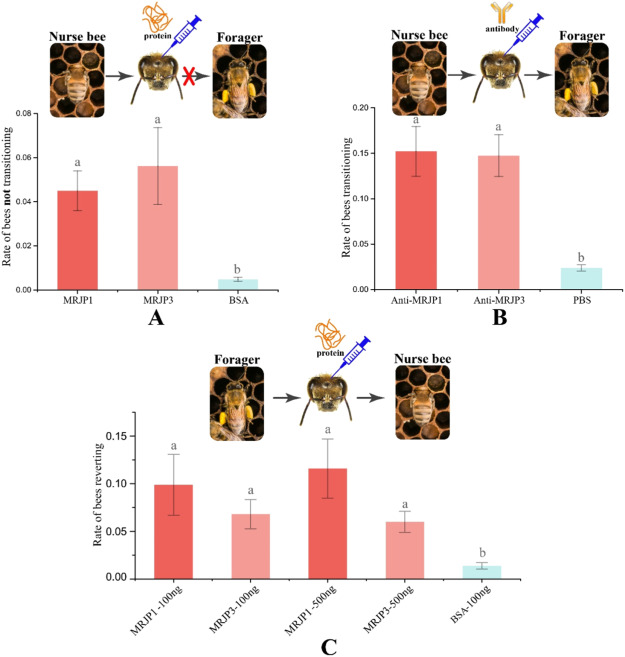
Манипуляции in-vivo с экспрессией генов mrjp1 и mrjp3 в мозге медоносной пчелы подтверждают роль MRJPs в регуляции поведенческого состояния рабочих особей.
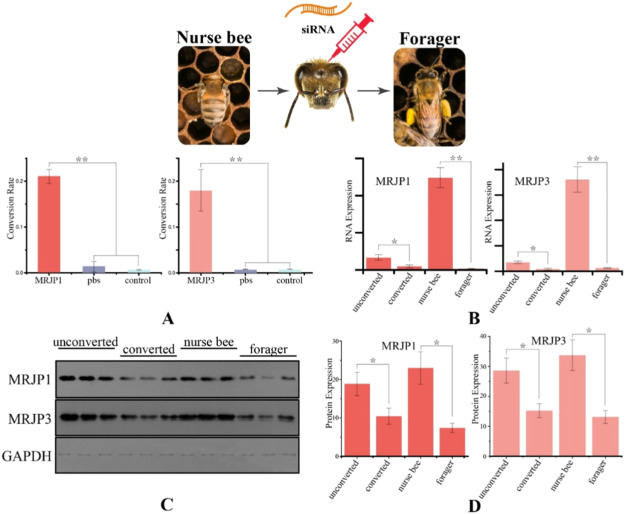
Для дальнейшего подтверждения причинной роли MRJPs в поведенческом переходе рабочих пчел от выкармливания к добыче корма, гены mrjp1 и mrjp3 были понижены с помощью RNAi-подхода путем введения смеси малых ингибирующих РНК пчелам-кормилицам и наблюдения за их последующим переходом к добыче корма. Как и предсказывалось, значительно большая доля медсестер, инъецированных mrjp, перешла к кормодобыванию, чем медсестры отрицательного или PBS-контроля (рис. 6A). Даун-регуляция mrjp1 и mrjp3 была подтверждена методом qPCR. Инъецированные пчелы демонстрировали гораздо более низкие уровни экспрессии, чем неманипулированные медсестры, с дополнительным значительным различием между инъецированными медсестрами, которые перешли в фуражиры, и теми, которые не перешли (рис. 6B). Однако экспериментальная пониженная регуляция обоих генов была слабее, чем естественные различия, наблюдаемые между медведицами и фуражирами. Уровень белков MRJP1 и MRJP3 в этих четырех группах был определен с помощью вестерн-блот анализа, который показал параллельные результаты: значительно более высокие уровни у медсестер, которые не перешли в фуражиры, по сравнению с медсестрами, которые перешли (рис. 6C, D). Количество MRJP1 и MRJP3 в рабочих особях с переключенным поведением было сходным с обычными фуражирами, в то время как у пчел без переключения поведение было почти таким же, как у контрольных пчел-кормилиц (рис. 6D).
3.3. Идентификация белков, взаимодействующих с MRJPs
Чтобы определить, как MRJPs связаны с другими известными механизмами, оказывающими влияние на поведенческий переход от кормления к выкармливанию, белки, взаимодействующие с MRJP1 и MRJP3, были отобраны с помощью ко-IP, идентифицированы и количественно определены с помощью ЖХ-МС/МС. Всего было идентифицировано более 100 белков, и 19 белков взаимодействовали как с MRJP1, так и с MRJP3 (Таблица 1). Среди них гексамерин 110 (Hex) и вителлогенин были основными взаимодействующими белками с MRJPs в мозге медсестер. Более того, другие MRJP, такие как MRJP2, MRJP4 и MRJP7, также были идентифицированы как интеракторы с MRJP1 и MRJP3 (Таблица 1).
| Регистрационный номер | Описание | Название гена | Анти-MRJP1 | Анти-MRJP3 | Клеточная локализацияа | ||||
| Кормилица | Корм | Рацион | Кормилица | Корм | Рацион | ||||
| O18330 | Основной белок маточного молочка 1 | MRJP1 | 90 | 4 | 22,5 | 87 | 6 | 14,5 | EC |
| O77061 | Основной белок маточного молочка 2 | MRJP2 | 41 | NA | 55 | 4 | 13.8 | EC | |
| Q17061 | Основной белок маточного молочка 4 | MRJP4 | 548 | 14 | 39,1 | 29 | 1 | 29,0 | EC |
| A0A088AU27 | Основной белок маточного молочка 3 | MRJP3 | 35 | NA | 29 | NA | EC | ||
| D3Y5T0 | Основной белок маточного молочка 7 | MRJP7 | 50 | 2 | 25 | 1360 | 122 | 11.1 | EC |
| A0A088A1A1 | Гексамерин 110 | Hex110 | 396 | 1 | 396 | 396 | 3 | 132 | EC |
| Q868N5 | Вителлогенин | Vg | 17 | NA | 11 | NA | EC | ||
| A0A088ADL8 | Вителлогенин | Vg | 299 | 33 | 9.1 | 171 | 29 | 5.9 | EC |
| A0A088AS56 | Аполипофорины | apolpp | 344 | 118 | 2.9 | 240 | 108 | 2.2 | EC |
| Q5BLY4 | Икарапин | 12 | 4 | 3 | 18 | 2 | 9 | EC | |
| A0A088ASG4 | Белок синтеза кофактора молибдена корица | 92 | 39 | 2.4 | 15 | 7 | 2.1 | Cyt | |
| A0A088ALS8 | Фермент дебранчинга гликогена | 86 | 21 | 4.1 | 85 | 9 | 9.4 | Cyt | |
| H9K5X4 | Дегидрогеназа/редуктаза член семьи | SDR | 19 | 8 | 2.4 | 19 | 8 | 2.4 | Cyt |
| A0A088ACJ2 | Динактин субъединица 2 | dcnt2 | 26 | 12 | 2.2 | 27 | 13 | 2.1 | CS |
| A0A088A9R3 | Неспецифический липид-трансферный белок | 24 | 9 | 2.7 | 17 | 8 | 2.1 | Cyt; Mt.; PO | |
| A0A088AC74 | 40S рибосомальный белок S18 | 28 | 8 | 3,5 | 23 | 10 | 2,3 | Cyt; Rib | |
| A0A088ADQ6 | 40S рибосомальный белок S14 | 13 | 4 | 3.3 | 11 | 5 | 2.2 | Cyt, Rib | |
| A0A088ARI3 | Никотинат фосфорибозилтрансфераза | 14 | 6 | 2.3 | 14 | 4 | 3.5 | Cyt | |
| A0A088A4N3 | Эукариотический фактор инициации трансляции 3 субъединица H | eIF3h | 11 | 5 | 2.2 | 14 | 4 | 3.5 | Cyt |
a EC = Extracellular, CS = Centrosome, Cyt = Cytoplasm, Mt. = Mitochondria, PO = Peroxisome, Rib = Ribosome.
4.Обсуждение
Сложная социальная регуляция разделения труда среди рабочих медоносных пчел, особенно выраженный переход между стадиями жизненного цикла в улье и фуражира, была широко изучена на молекулярном, организменном и общественном уровнях, выявляя гормональную, феромональную и пищевую регуляцию [8], [9], [47], [48]. Многочисленные корреляты этого перехода также были охарактеризованы на транскриптомном, эпигеномном и протеомном уровнях [5], [10], [23]. Наши исследования выявили плейотропные эффекты MRJPs как новое, непосредственное звено между питанием и гормональной сигнализацией в причинах начала фуражировки рабочих особей на основе изучения первого набора моноклональных антител (mAb) для медоносных пчел. Впоследствии мы усиливаем аргументы в пользу функциональной роли MRJPs в регуляции жизненного цикла рабочих медоносных пчел с помощью серии экспериментов, которые манипулируют переходом между пчелами в улье и фуражирами, и демонстрируем причинную роль путем снижения уровня MRJPs с помощью RNAi, что вызывает предсказанное увеличение фуражировки. Эти результаты показывают полезность массива mAb в качестве нового инструмента для расширенного протеомного исследования и являются большим шагом вперед в нашем понимании одного из самых сложных и наиболее изученных переходов от одной истории жизни к другой.
Благодаря значительным усилиям по разработке комплексных массивов мАб, этот метод в основном используется в протеомике заболеваний человека [49]. Однако массивы мАб имеют ряд преимуществ перед протеомикой на основе масс-спектрометрии, включая лучшую чувствительность, разрешение, точность, динамический диапазон и воспроизводимость [50]. В сотрудничестве с компанией Abmart Ltd. мы создали первый массив mAb для медоносных пчел, наиболее важного управляемого опылителя и важной научной модели с давней традицией применения подходов «-омики» [51]. В целом, было разработано 16 320 мАб и напечатано на массивах, чтобы иметь возможность одновременно исследовать большую часть протеома медоносной пчелы. Однако мы не знаем, сколько уникальных белков опрашивает наш массив. Наше исследование 500 специфических пятен массива, которые демонстрировали наибольшие различия между мозгом медведицы и кормилицы, привело только к идентификации 83 уникальных белков, и только половина из них была подтверждена с помощью вестерн-блотов. Эти результаты объясняются комбинацией факторов: Некоторые антитела распознавали один и тот же белок, а другие белки не могли быть однозначно идентифицированы с помощью масс-спектрометрии. Тем не менее, этот новый инструмент представляет собой значительный прогресс в расширении инструментов функциональной протеомики у медоносных пчел, а растворы антител могут быть предоставлены по запросу.
MRJPs являются основными компонентами расплодного корма, которым пчелы-кормилицы кормят развивающихся личинок [52], 51]. MRJPs количественно важны для питания развивающихся личинок, и их производство имеет решающее значение для выполнения задачи по выхаживанию рабочих особей, которые производят MRJPs в своих гипофарингеальных железах в зависимости от задачи [28]. Наши результаты показывают, что два из девяти функциональных MRJP [54] (MRJP1 и MRJP3) выполняют дополнительную регуляторную функцию, влияя на поведенческую специализацию рабочих на кормилиц или фуражиров. Таким образом, те же самые белки, которые важны для осуществления кормления, также регулируют стадию кормления. Такое привлечение эффекторных белков к сигнальным функциям развивалось в различных контекстах [55], включая медоносных пчел [6]. MRJP1 и MRJP3 являются основными компонентами пищи расплода, составляя 31 % и 26 % белков RJ, соответственно [54], [55]. Для обоих белков были описаны и другие функции, включая антибактериальную активность [58] MRJP1 и связывание иммунных элиситоров [59] MRJP3, и они экспрессируются в тканях за пределами гипофарингеальных желез [25]. В частности, известно, что оба белка экспрессируются в мозге [60], что мы и подтвердили в данном исследовании.
Что касается молекулярной структуры MRJP1, то мономер и олигомер обычно существуют вместе [61], причем последний является преобладающей формой благодаря своей термостойкости и длительной стабильности хранения в физиологических условиях [62], [63], [64], [65]. Кроме того, олигомер MRJP содержит молекулы 24-метиленхолестерина, которые действуют как гормональный регулятор, способствующий росту личинок медоносной пчелы [66]. Более того, мономерный MRJP1 может играть решающую роль в продлении продолжительности жизни маток. Важно отметить, что только мономерный MRJP1 играет решающую роль в определении кастовой судьбы [67] из-за того, что агрегированный MRJP1 в РЖ снижает переваривание и утилизацию питания у личинок медоносной пчелы [68]. Это согласуется с результатами настоящего исследования, согласно которым мономерный MRJP1 играет ключевую роль в регуляции родового перехода медоносной пчелы.
Наши исследования показали, что уровни MRJP1 и MRJP3 в мозге коррелируют с поведенческим состоянием рабочих особей медоносных пчел, что подтверждает предыдущие открытия [60], [61]. Результаты серии экспериментальных манипуляций, направленных на ускорение перехода от кормления к корму, задержку этого перехода или обратный переход, усиливают аргументы в пользу того, что уровни обоих белков тесно связаны с поведенческим состоянием: Независимо от того, проводились ли поведенческие манипуляции демографически или фармакологически, кормление всегда было связано с повышенным уровнем MRJP1 и MRJP3, в то время как кормление всегда было связано с низким уровнем. Эти количественные различия белков в мозге были подтверждены иммуногистохимическим окрашиванием, что исключает возможность того, что образцы мозга с тесно связанной железистой тканью могли объяснить наблюдаемые различия. В частности, уровни MRJP1 и MRJP3 в функционально важных антеннальных долях и грибовидных телах отражали общие количественные различия в мозге между кормилицами и фуражирами. Обе эти области мозга были вовлечены в поведенческую специализацию кормилиц и фуражиров [70]. Грибовидные тела участвуют во многих функциях высшего порядка, и в них происходит значительное расширение арборизации, когда рабочие медоносные пчелы переходят к добыче корма [32]. Клетки Кеньона — внутренние нейроны грибовидных тел, участвующие в ассоциативном обучении и памяти, специфически экспрессирующие MRJP1 [71], хотя его нейробиологическая функция не выяснена. MRJP3 и MRJP1 могут служить резервом аминокислот в мозге во время онтогенетического и поведенческого развития от кормилицы к фуражиру [69], а также обладают способностью агрегировать РНК и могут опосредовать сборки рибонуклеопротеинов высокого порядка (РНП) [59], которые, в свою очередь, связаны с синаптической пластичностью у дрозофилы [72]. Таким образом, снижение уровня MRJPs может влиять на изменения нейронов для адаптации к различным вызовам кормления и выхаживания несколькими способами.
Причинно-следственные эффекты MRJP1 и MRJP3 на поведенческое состояние рабочих особей медоносной пчелы продемонстрированы прямыми манипуляциями с этими белками в мозге, которые повлияли на поведение рабочих, как и было предсказано: В отдельных экспериментах инъекция MRJP увеличивала долю медведиц, которые не переходили к фуражировке, и увеличивала долю фуражиров, которые возвращались к фуражировке. Напротив, инъекция антител к MRJP для уменьшения количества активных MRJP увеличивала долю медсестер, которые переходили к фуражировке. Аналогичным образом, снижение экспрессии MRJP путем введения дсРНК в мозг привело к снижению уровней белков MRJP1 и MRJP3 и увеличению числа рабочих, переходящих от кормления к кормлению, по сравнению с контрольными группами, которым вводили PBS или не манипулировали. Хотя противоположные генетические манипуляции для увеличения экспрессии MRJP были затруднены практическими трудностями генной инженерии медоносных пчел, эти эксперименты в совокупности убедительно подтверждают причинную роль MRJP1 и MRJP3 в регулировании разделения труда у медоносных пчел.
Механизмы функционирования MRJP при переходе от кормления к питанию, вероятно, отличаются от предложенной связи MRJP1 с сигналом рецептора эпидермального фактора роста (Egfr) в жировом теле во время личиночного развития [73]. Во время личиночного развития потребление маточного молочка вызывает одновременное повышение уровня ювенильного гормона (JH) и вителлогенина (Vg) [73], в отличие от взаимно репрессивной связи между JH и Vg, которая хорошо установлена при переходе от кормления к питанию [7]. В конце стадии выкармливания титры Vg снижаются, предположительно в результате кормления выводка, когда Vg используется в качестве предшественника для MRJPs [48], [74]. Это снижение сопровождается усилением инсулиноподобного сигналинга (ИЛС) и выработки JH из corpora allata [8], [17]. Направленная причинно-следственная связь между снижением питательных веществ, MRJPs, Vg, JH и ILS неясна и может включать несколько дополнительных медиаторов экспрессии генов [75]. Однако наше исследование белков, взаимодействующих с MRJPs, указывает на прямое взаимодействие на уровне белков между MRJP1/3 и вителлогенином, что может быть непосредственной связью между этими двумя компонентами чувствительности к питательным веществам. Возможность существования прямых индикаторов питательного статуса с помощью MRJPs подтверждается взаимодействием MRJP1/3 с другими белками, связанными с питанием (гексамерин 110 и аполипофорины). Гексамерины, известные в первую очередь как белки хранения личинок, экспрессируются в жировом теле рабочих и индуцируются JH [76], но в свою очередь могут также участвовать в связывании JH в сочетании с аполипофоринами [77]. Взаимодействуют ли MRJPs с транспортом или секвестрацией JH, еще предстоит выяснить.
В целом, наши результаты для MRJP1 и MRJP3 были удивительно похожи в нескольких экспериментах, включающих регуляцию кормления в сравнении с кормлением. Более того, мы обнаружили, что они соосаждаются и, таким образом, взаимодействуют с MRJP2, MRJP4 и MRJP7. Эти MRJP произошли от одного гена-предшественника путем дупликации генов [25], поэтому можно ожидать частичного дублирования. Несмотря на то, что эволюционная дивергенция между этими генами привела к значительным различиям в последовательности и различным функциям [25], [52], [78], их биохимические свойства и иммуномечение могут быть весьма схожими, поэтому в данном исследовании мы старались различать отдельные MRJP. Является ли сходство MRJP1 и MRJP3 в контексте поведенческой регуляции функциональной избыточностью, еще предстоит выяснить.
В заключение следует отметить, что мы создали первую библиотеку антител медоносной пчелы с полным охватом 16 320 мАбс, что обеспечивает мощную платформу для функциональной протеомики медоносной пчелы, которая позволяет проводить крупномасштабную генерацию антител и профилирование мишеней. MRJP1 и MRJP3 были идентифицированы как потенциальные нейронные белки-эффекторы в мозге рабочих медоносных пчел обратимой смены подкаст между кормилицами и фуражирами. Мы экспериментально подтвердили, что снижение регуляции MRJP1 и MRJP3 в мозге медоносной пчелы сдвигает жизненную историю рабочих в сторону кормодобывания, в то время как повышение регуляции имеет противоположный эффект. Эта новая плейотропная функция MRJP1 и MRJP3 может действовать совместно с JH, Vg и другими путями хранения и восприятия питательных веществ, которые ранее были связаны с регулированием разделения труда у медоносных пчел. Расширение репертуара MRJPs служит примером промискуитета пищевых белков и эволюционного потенциала дупликации генов и функциональной диверсификации.
Ниже приведены дополнительные данные, относящиеся к этой статье.
Рис. S1. Различие аналогичных мАбс MRJPs. (A) Окрашивание серебром белков, разделенных на 2-DE. Всего 32 пятна, распознанные mAb, были помечены и соответственно вырезаны из геля для дальнейшей идентификации с помощью MS-анализа, и 18 пятен были успешно идентифицированы (Таблица S5). (B) (C) (D) Вестерн-блоттинг был проведен для идентификации белков, распознанных антителами. AP04 был идентифицирован как изоформы MRJP1 и MRJP2 для более чем 10 пятен; AP03 был распознан как изоформы MRJP1 и MRJP4; AP01-распознанные белки были изоформами MRJP3. (E) Проверка специфичности антител (AP01 и AP04) с помощью Вестерн-блоттинга с очищенными MRJP1 и MRJP3. AP01 и AP04 были идентифицированы как антитела к MRJP3 и MRJP1, соответственно.
Скачать Дополнительные таблицы.
Содержит шесть дополнительных таблиц с деталями метода и результатами.
S1 — Детали последовательностей олигосом RNAi
S2 — Детали зондов для qPCR
S3 — Дифференциально изобилующие белки на основе массива mAb
S4 — Успешно идентифицированные белки
S5 — Валидированные дифференциально изобильные белки
S6 — Подробные результаты MS-идентификации MRJP.
Ссылки
1.G.F. Oster, E.O. Wilson
Caste And Ecology in the Social Insects
Princeton University Press, Princeton (1978)
Google Scholar
2.S.N. Beshers, J.H. Fewell
Models of division of labor in social insects
Annu. Rev. Entomol., 46 (2001), pp. 413-440
CrossRef View in Scopus Google Scholar
3.M.L. Winston
The Biology of the Honey Bee
Harvard University Press, Cambridge, Massachusetts (1987)
Google Scholar
4.O. Rueppell, C. Bachelier, M.K. Fondrk, R.E. Page Jr.
Regulation of life history determines lifespan of worker honey bees (Apis mellifera L.)
Exp. Gerontol., 42 (2007), pp. 1020-1032
View PDF View article View in Scopus Google Scholar
5.B.R. Herb, F. Wolschin, K.D. Hansen, M.J. Aryee, B. Langmead, R. Irizarry, G.V. Amdam, A.P. Feinberg
Reversible switching between epigenetic states in honeybee behavioral subcastes
Nat. Neurosci., 15 (2012), pp. 1371-1373
CrossRef View in Scopus Google Scholar
6.R.E. Page, G.V. Amdam
The making of a social insect: developmental architectures of social design
Bioessays, 29 (2007), pp. 334-343
CrossRef View in Scopus Google Scholar
7.R.E. Page, O. Rueppell, G.V. Amdam
Genetics of reproduction and regulation of honeybee (Apis mellifera L.) social behavior
Annu. Rev. Genet., 46 (2012), pp. 97-119
CrossRef View in Scopus Google Scholar
8.S.A. Ament, M. Corona, H.S. Pollock, G.E. Robinson
Insulin signaling is involved in the regulation of worker division of labor in honey bee colonies
Proc. Natl. Acad. Sci. U. S. A., 105 (2008), pp. 4226-4231
View PDF CrossRef View in Scopus Google Scholar
9.I. Leoncini, Y. Le Conte, G. Costagliola, E. Plettner, A.L. Toth, M.W. Wang, Z. Huang, J.M. Becard, D. Crauser, K.N. Slessor, G.E. Robinson
Regulation of behavioral maturation by a primer pheromone produced by adult worker honey bees
Proc. Natl. Acad. Sci. U. S. A., 101 (2004), pp. 17559-17564
CrossRef View in Scopus Google Scholar
10.C.W. Whitfield, Y. Ben-Shahar, C. Brillet, I. Leoncini, D. Crauser, Y. Le Conte, S. Rodriguez-Zas, G.E. Robinson
Genomic dissection of behavioral maturation in the honey bee
Proc. Natl. Acad. Sci. U. S. A., 103 (2006), pp. 16068-16075
CrossRef View in Scopus Google Scholar
11.O. Rueppell, T. Pankiw, D.I. Nielson, M.K. Fondrk, M. Beye, R.E. Page Jr.
The genetic architecture of the behavioral ontogeny of foraging in honey bee workers
Genetics, 167 (2004), pp. 1767-1779
View PDF View in Scopus Google Scholar
12.A. Maisonnasse, J.-C. Lenoir, D. Beslay, D. Crauser, Y. Le Conte
E-β-ocimene, a volatile brood pheromone involved in social regulation in the honey bee colony (Apis mellifera)
PLoS One, 5 (2010), Article e13531
View PDF CrossRef View in Scopus Google Scholar
13.C.M. Grozinger, N.M. Sharabash, C.W. Whitfield, G.E. Robinson
Pheromone-mediated gene expression in the honey bee brain
Proc. Natl. Acad. Sci. U. S. A., 100 (2003), pp. 14519-14525
View PDF View in Scopus Google Scholar
14.Z.Y. Huang, G.E. Robinson
Regulation of honey bee division of labor by colony age demography
Behav. Ecol. Sociobiol., 39 (1996), pp. 147-158
View in Scopus Google Scholar
15.C.J. Perry, E. Søvik, M.R. Myerscough, A.B. Barron
Rapid behavioral maturation accelerates failure of stressed honey bee colonies
Proc. Natl. Acad. Sci. U. S. A., 112 (2015), pp. 3427-3432
View PDF CrossRef View in Scopus Google Scholar
16.D.J. Schulz, Z.Y. Huang, G.E. Robinson
Effects of colony food shortage on behavioral development in honey bees
Behav. Ecol. Sociobiol., 42 (1998), pp. 295-303
Google Scholar
17.J.P. Sullivan, O. Jassim, S.E. Fahrbach, G.E. Robinson
Juvenile hormone paces behavioral development in the adult worker honey bee
Hormon. Behav., 37 (2000), pp. 1-14
View PDF View article Google Scholar
18.T. Pankiw
Directional change in a suite of foraging behaviors in tropical and temperate evolved honey bees (Apis mellifera L.)
Behav. Ecol. Sociobiol., 54 (2003), pp. 458-464
View in Scopus Google Scholar
19.T. Giray, E. Guzman-Novoa, C.W. Aron, B. Zelinsky, S.E. Fahrbach, G.E. Robinson
Genetic variation in worker temporal polyethism and colony defensiveness in the honey bee, Apis mellifera
Behav. Ecol., 11 (2000), pp. 44-55
View PDF View in Scopus Google Scholar
20.O. Rueppell
Characterization of quantitative trait loci for the age of first foraging in honey bee workers
Behav. Genet., 39 (2009), pp. 541-553
View article CrossRef View in Scopus Google Scholar
21.G.S. Withers, S.E. Fahrbach, G.E. Robinson
Selective neuroanatomical plasticity and division of labor in the honeybee
Nature, 364 (1993), pp. 238-240
View in Scopus Google Scholar
22.F. Wolschin, G.V. Amdam
Plasticity and robustness of protein patterns during reversible development in the honey bee (Apis mellifera)
Anal. Bioanal. Chem., 389 (2007), pp. 1095-1100
CrossRef View in Scopus Google Scholar
23.F. Wolschin, G.V. Amdam
Comparative proteomics reveal characteristics of life-history transitions in a social insect
Proteome Sci., 5 (2007), pp. 1-11
Google Scholar
24.B. Han, Y. Fang, M. Feng, H. Hu, Y. Hao, C. Ma, X.M. Huo, L.F. Meng, X.F. Zhang, F. Wu, J.K. Li
Brain membrane proteome and phosphoproteome reveal molecular basis associating with nursing and foraging behaviors of honeybee workers
J. Proteome Res., 16 (2017), pp. 3646-3663
CrossRef View in Scopus Google Scholar
25.A. Buttstedt, R.F.A. Moritz, S. Erler
Origin and function of the major royal jelly proteins of the honeybee (Apis mellifera) as members of the yellow gene family
Biol. Rev., 89 (2014), pp. 255-269
CrossRef View in Scopus Google Scholar
26.A. Buttstedt, R.F. Moritz, S. Erler
More than royal food-major royal jelly protein genes in sexuals and workers of the honeybee Apis mellifera
Front. Zool., 10 (2013), pp. 1-10
View in Scopus Google Scholar
27.X. Zhang, H. Hu, B. Han, Q. Wei, L. Meng, F. Wu, Y. Fang, M. Feng, C. Ma, O. Rueppell
The neuroproteomic basis of enhanced perception and processing of brood signals that trigger increased reproductive investment in honeybee (Apis mellifera) workers
Mol. Cell. Proteomics, 19 (2020), pp. 1632-1648
View PDF View article CrossRef View in Scopus Google Scholar
28.D. Dobritzsch, D. Aumer, M. Fuszard, S. Erler, A. Buttstedt
The rise and fall of major royal jelly proteins during a honeybee (Apis mellifera) workers’ life
Ecol.Evol., 9 (2019), pp. 8771-8782, 10.1002/ece3.5429
View PDF View in Scopus Google Scholar
29.G.V. Amdam, O. Rueppell, M.K. Fondrk, R.E. Page, C.M. Nelson
The nurse’s load: early-life exposure to brood-rearing affects behavior and lifespan in honey bees (Apis mellifera)
Exp. Gerontol., 44 (2009), pp. 467-471
View PDF View article View in Scopus Google Scholar
30.Y. Ben-Shahar, A. Robichon, M.B. Sokolowski, G.E. Robinson
Influence of gene action across different time scales on behavior
Science, 296 (2002), pp. 741-744
View in Scopus Google Scholar
31.R. Scheiner, S. Pluckhahn, B. Oney, W. Blenau, J. Erber
Behavioural pharmacology of octopamine, tyramine and dopamine in honey bees
Behav. Brain Res., 136 (2002), pp. 545-553
View PDF View article View in Scopus Google Scholar
32.S.M. Farris, G.E. Robinson, S.E. Fahrbach
Experience- and age-related outgrowth of intrinsic neurons in the mushroom bodies of the adult worker honeybee
J. Neurosci., 21 (2001), pp. 6395-6404
View PDF CrossRef View in Scopus Google Scholar
33.N.L. Carreck, M. Andree, C.S. Brent, D. Cox-Foster, H.A. Dade, J.D. Ellis, F. Hatjina, D. Van Englesdorp
Standard methods for Apis mellifera anatomy and dissection
J. Apic. Res., 52 (2013), pp. 1-40
View PDF CrossRef Google Scholar
34.W.M. Yokoyama, M. Christensen, G.D. Santos, D. Miller, J. Ho, T. Wu, M. Dziegelewski, F.A. Neethling
Production of monoclonal antibodies
Curr. Protoc. Immunol., 102 (2013), pp. 2.5. 1-2.5. 29
Google Scholar
35.J. Zhang, L. Xin, B. Shan, W. Chen, M. Xie, D. Yuen, W. Zhang, Z. Zhang, G.A. Lajoie, B. Ma
PEAKS DB: de novo sequencing assisted database search for sensitive and accurate peptide identification
Mol. Cell. Proteomics, 11 (2012)
Google Scholar
36.T. Mahmood, P.-C. Yang
Western blot: technique, theory, and trouble shooting 4 (2012), pp. 429-434, 10.4103/1947-2714.100998
View in ScopusGoogle Scholar
37.J. Li, Y. Fang, L. Zhang, D. Begna
Honeybee (Apis mellifera ligustica) drone embryo proteomes
J. Insect Physiol., 57 (2011), pp. 372-384
View PDF View article View in Scopus Google Scholar
38.G.V. Amdam, A.L.T.O. Aase, S.C. Seehuus, M.K. Fondrk, K. Norberg, K. Hartfelder
Social reversal of immunosenescence in honey bee workers
Exp. Gerontol., 40 (2005), pp. 939-94
View PDF View article View in Scopus Google Scholar
39.B. Zimmermann, P. Dames, B. Walz, O. Baumann
Distribution and serotonin-induced activation of vacuolar-type H+-ATPase in the salivary glands of the blowfly Calliphora vicina
J. Exp. Biol., 206 (2003), pp. 1867-1876
View in Scopus Google Scholar
40.M. Thamm, R. Scheiner
PKG in honey bees: spatial expression, Amfor gene expression, sucrose responsiveness, and division of labor
J. Comp. Neurol., 522 (2014), pp. 1786-1799
CrossRef View in Scopus Google Scholar
41.Y. Ben-Shahar, H.-T. Leung, W.L. Pak, M.B. Sokolowski, G.E. Robinson
cGMP-dependent changes in phototaxis: a possible role for the foraging gene in honey bee division of labor
J. Exp. Biol., 206 (2003), pp. 2507-2515
View in Scopus Google Scholar
42.Y. Matsumoto, R. Menzel, J.-C. Sandoz, M. Giurfa
Revisiting olfactory classical conditioning of the proboscis extension response in honey bees: a step toward standardized procedures
J. Neurosci. Methods, 211 (2012), pp. 159-167
View PDF View article View in Scopus Google Scholar
43.A.S. French, K.L. Simcock, D. Rolke, S.E. Gartside, W. Blenau, G.A. Wright
The role of serotonin in feeding and gut contractions in the honeybee
J. Insect Physiol., 61 (2014), pp. 8-15, 10.1016/j.jinsphys.2013.12.005
View PDF View article View in Scopus Google Scholar
44.K.J. Livak, T.D. Schmittgen
Analysis of relative gene expression data using real-time quantitative PCR and the 2−ΔΔCT method
Methods, 25 (2001), pp. 402-408, 10.1006/meth.2001.1262
View PDF View article Google Scholar
45.O. Sano, T. Kunikata, K. Kohno, K. Iwaki, M. Ikeda, M. Kurimoto
Characterization of royal jelly proteins in both Africanized and European honeybees (Apis mellifera) by two-dimensional gel electrophoresis, 52 (2004), pp. 15-20
View in Scopus Google Scholar
46.K. Ohashi, S. Natori, T. Kubo
Expression of amylase and glucose oxidase in the hypopharyngeal gland with an age-dependent role change of the worker honeybee (Apis mellifera L.)
Eur. J. Biochem., 265 (1999), pp. 127-133
View PDF View in Scopus Google Scholar
47.A.L. Toth, G.E. Robinson
Worker nutrition and division of labour in honeybees
Anim. Behav., 69 (2005), pp. 427-435
View PDF View article View in Scopus Google Scholar
48.G.V. Amdam, K. Norberg, A. Hagen, S.W. Omholt
Social exploitation of vitellogenin
Proc. Natl. Acad. Sci. U. S. A., 100 (2003), pp. 1799-1802
View PDF View in Scopus Google Scholar
49.C.A. Borrebaeck, C. Wingren
Antibody array generation and use
Monoclonal Antibodies, Springer (2014), pp. 563-571
CrossRef View in Scopus Google Scholar
50.C. Wingren
Antibody-based proteomics
Á. Végvári (Ed.), Proteogenomics, Springer International Publishing, Cham (2016), pp. 163-179, 10.1007/978-3-319-42316-6_11
Google Scholar
51.G.M. Weinstock, G.E. Robinson, R.A. Gibbs, K.C. Worley, J.D. Evans, R. Maleszka, H.M. Robertson, D.B. Weaver, M. Beye, P. Bork, C.G. Elsik, K. Hartfelder, G.J. Hunt, E.M. Zdobnov, G.V. Amdam, M.M.G. Bitondi, A.M. Collins, A.S. Cristino, H.M.G. Lattorff, C.H. Lobo, R.F.A. Moritz, F.M.F. Nunes, R.E. Page, Z.L.P. Simoes, D. Wheeler, P. Carninci, S. Fukuda, Y. Hayashizaki, C. Kai, J. Kawai, N. Sakazume, D. Sasaki, M. Tagami, S. Albert, G. Baggerman, K.T. Beggs, G. Bloch, G. Cazzamali, M. Cohen, M.D. Drapeau, D. Eisenhardt, C. Emore, M.A. Ewing, S.E. Fahrbach, S. Foret, C.J.P. Grimmelikhuijzen, F. Hauser, A.B. Hummon, J. Huybrechts, A.K. Jones, T. Kadowaki, N. Kaplan, R. Kucharski, G. Leboulle, M. Linial, J.T. Littleton, A.R. Mercer, T.A. Richmond, S.L. Rodriguez-Zas, E.B. Rubin, D.B. Sattelle, D. Schlipalius, L. Schoofs, Y. Shemesh, J.V. Sweedler, R. Velarde, P. Verleyen, E. Vierstraete, M.R. Williamson, S.A. Ament, S.J. Brown, M. Corona, P.K. Dearden, W.A. Dunn, M.M. Elekonich, T. Fujiyuki, I. Gattermeier, T. Gempe, M. Hasselmann, T. Kadowaki, E. Kage, A. Kamikouchi, T. Kubo, R. Kucharski, T. Kunieda, M.D. Lorenzen, N.V. Milshina, M. Morioka, K. Ohashi, R. Overbeek, C.A. Ross, M. Schioett, T. Shippy, H. Takeuchi, A.L. Toth, J.H. Willis, M.J. Wilson, K.H.J. Gordon, I. Letunic, K. Hackett, et al.
Insights into social insects from the genome of the honeybee Apis mellifera
Nature, 443 (2006), pp. 931-949
Google Scholar
52.M.D. Drapeau, S. Albert, R. Kucharski, C. Prusko, R. Maleszka
Evolution of the Yellow/Major Royal Jelly Protein family and the emergence of social behavior in honey bees
Genome Res., 16 (2006), pp. 1385-1394
View PDF CrossRef View in Scopus Google Scholar
54.S. Helbing, H.M.G. Lattorff, R.F. Moritz, A. Buttstedt
Comparative analyses of the major royal jelly protein gene cluster in three Apis species with long amplicon sequencing
DNA Res., 24 (2017), pp. 279-287
View PDF CrossRef View in Scopus Google Scholar
55.L. Aravind, V.M. Dixit, E.V. Koonin
The domains of death: evolution of the apoptosis machinery
Trends Biochem. Sci., 24 (1999), pp. 47-53
View PDF View article Google Scholar
58.T.V. Vezeteu, O. Bobiş, R.F.A. Moritz, A. Buttstedt
Food to some, poison to others — honeybee royal jelly and its growth inhibiting effect on European Foulbrood bacteria
MicrobiologyOpen, 6 (2017), Article e00397, 10.1002/mbo3.397
View PDF View in Scopus Google Scholar
59.E. Maori, I.C. Navarro, H. Boncristiani, D.J. Seilly, K.L.M. Rudolph, A. Sapetschnig, C.-C. Lin, J.E. Ladbury, J.D. Evans, J.L. Heeney, E.A. Miska
A secreted RNA binding protein forms RNA-stabilizing granules in the honeybee royal jelly
Mol. Cell, 74 (2019), pp. 598-608.e6, 10.1016/j.molcel.2019.03.010
View PDF View article View in Scopus Google Scholar
60.L.G. Peixoto, L.K. Calábria, L. Garcia, F.E. Capparelli, L.R. Goulart, M.V. de Sousa, F.S. Espindola
Identification of major royal jelly proteins in the brain of the honeybee Apis mellifera
J. Insect Physiol., 55 (2009), pp. 671-677, 10.1016/j.jinsphys.2009.05.005
View PDF View article View in Scopus Google Scholar
61.S. J
Some properties of the main protein of honeybee (Apis mellifera) royaljelly
Apidologie, 32 (2001), pp. 69-80
Google Scholar
62.T. Moriyama, A. Ito, S. Omote, Y. Miura, H. Tsumoto
Heat resistant characteristics of major royal jelly protein 1 (MRJP1) oligomer
PLoS One, 10 (2015), Article 0119169
Google Scholar
63.S. Tamura, T. Kono, C. Harada, K. Yamaguchi, T. Moriyama
Estimation and characterisation of major royal jelly proteins obtained from the honeybee Apis merifera
Food Chem., 114 (2008), pp. 1491-1497
Google Scholar
64.S. Tamura, S. Amano, T. Kono, J. Knodoh, K. Yamaguchi, S. Kobayashi, T. Ayabe, T. Moriyama
Molecular characteristics and physiological functions of major royal jelly protein 1 oligomer
Proteomics, 9 (2009), pp. 5534-5543
CrossRef View in Scopus Google Scholar
65.T. Furusawa Y. Arai K. Kato K. Ichihara , Quantitative analysis of Apisin, a major protein unique to royal jelly, Evidence-Based Complementary and Alternative Medicine: ECAM. 2016 (n.d.) 5040528.
Google Scholar
66.W. Tian, M. Li, H. Guo, W. Peng, X. Xue, Y. Hu, Y. Liu, Y. Zhao, X. Fang, K. Wang, X. Li, Y. Tong, M.A. Conlon, W. Wu, F. Ren, Z. Chen
Architecture of the native major royal jelly protein 1 oligomer
Nat. Commun., 9 (2018), p. 3373, 10.1038/s41467-018-05619-1
View PDF View in Scopus Google Scholar
67.M. Kamakura
Royalactin induces queen differentiation in honeybees
Nature, 473 (2011), pp. 478-483
CrossRef View in Scopus Google Scholar
68.J. Qiao, X. Wang, L. Liu, H. Zhang
Nonenzymatic browning and protein aggregation in royal jelly during room-temperature storage
J. Agric. Food Chem., 66 (2018), pp. 1881-1888, 10.1021/acs.jafc.7b04955View article
View in Scopus Google Scholar
69.L. Garcia, C.H.Saraiva Garcia, L.K. Calábria, G.Costa Nunes da Cruz, A.Sánchez Puentes, S.N. Báo, W. Fontes, C.A. Ricart, F.Salmen Espindola, M.Valle de Sousa
Proteomic analysis of honey bee brain upon ontogenetic and behavioral development
J. Proteome Res., 8 (2009), pp. 1464-1473
CrossRef View in Scopus Google Scholar
70.D.J. Schulz, G.E. Robinson
Biogenic amines and division of labor in honey bee colonies: behaviorally related changes in the antennal lobes and age-related changes in the mushroom bodies
J. Comp. Physiol. A., 184 (1999), pp. 481-488
View in Scopus Google Scholar
71.R. Kucharski, R. Maleszka, D.C. Hayward, E.E. Ball
A royal jelly protein is expressed in a subset of Kenyon cells in the mushroom bodies of the honey bee brain
Naturwissenschaften, 85 (1998), pp. 343-346
View in Scopus Google Scholar
72.I.P. Sudhakaran, J. Hillebrand, A. Dervan, S. Das, E.E. Holohan, J. Hülsmeier, M. Sarov, R. Parker, K. VijayRaghavan, M. Ramaswami
FMRP and Ataxin-2 function together in long-term olfactory habituation and neuronal translational control
Proc. Natl. Acad. Sci., 111 (2014), pp. E99-E108
View PDF View in Scopus Google Scholar
73.M. Kamakura
Royalactin induces queen differentiation in honeybees
Nature, 473 (2011), pp. 478-483
CrossRef View in Scopus Google Scholar
74.S.-C. Seehuus, K. Norberg, T. Krekling, K. Fondrk, G.V. Amdam
Immunogold localization of vitellogenin in the ovaries, hypopharyngeal glands and head fat bodies of honeybee workers, Apis mellifera
J. Insect Sci., 7 (2007), p. 52
View PDF View in Scopus Google Scholar
75.F.M.F. Nunes, K.E. Ihle, N.S. Mutti, Z.L.P. Simões, G.V. Amdam
The gene vitellogenin affects microRNA regulation in honey bee (Apis mellifera) fat body and brain
J. Exp. Biol., 216 (2013), pp. 3724-3732, 10.1242/jeb.089243View article
View in Scopus Google Scholar
76.J.R. Martins, F.M. Nunes, A.S. Cristino, Z.L. Simões, M.M. Bitondi
The four hexamerin genes in the honey bee: structure, molecular evolution and function deduced from expression patterns in queens, workers and drones
BMC Mol. Biol., 11 (2010), pp. 1-20
View in Scopus Google Scholar
77.M. Zalewska, A. Kochman, J.-P. Estève, F. Lopez, K. Chaoui, C. Susini, A. Ożyhar, M. Kochman
Juvenile hormone binding protein traffic — interaction with ATP synthase and lipid transfer proteins
Biochim. Biophys. Acta Biomembr., 1788 (2009), pp. 1695-1705, 10.1016/j.bbamem.2009.04.022
View PDF View article View in Scopus Google Scholar
78.Š. Albert, J. Klaudiny
The MRJP/YELLOW protein family of Apis mellifera: identification of new members in the EST library
J. Insect Physiol., 50 (2004), pp. 51-59
View PDF View article View in Scopus Google Scholar

Добавить комментарий