АБСТРАКТ
Медоносные пчелы (Apis mellifera) опыляют растения как в естественных, так и в управляемых экосистемах, способствуя производству продуктов питания, поддержанию и увеличению биоразнообразия. К сожалению, депопуляция пчел и потеря колоний становится все более распространенным явлением во всем мире. Снижению численности пчел способствуют несколько факторов, включая патогены (паразиты, грибки, бактерии и вирусы), изменение или утрата экосистем и/или использование агрохимикатов. Все эти факторы изменяют защитные механизмы иммунной системы пчел. Медоносные пчелы имеют врожденную иммунную систему, которая включает физические барьеры и обобщенные клеточные и гуморальные реакции для защиты от инфекционных и паразитических организмов. Патогены, акарициды, фунгициды, гербициды и другие пестициды влияют на иммунную систему пчел и, следовательно, на их здоровье. Защитные механизмы иммунной системы пчел включают сигнальные пути, рецепторы распознавания патогенов и эффекторы врожденной иммунной системы. Хотя иммунная система A. mellifera очень похожа на иммунную систему мух-дрозофил и комаров Anopheles, они обладают лишь третью генов иммунной системы, выявленных у этих видов. Такое относительно небольшое количество генов, вероятно, является следствием того, что у A. mellifera развился социальный иммунитет. Эта стратегия защиты снижает нагрузку на индивидуальную иммунную систему пчел. В данной обзорной статье обобщены и обсуждены основы иммунной системы медоносной пчелы.
ВВЕДЕНИЕ
Наряду с другими дикими опылителями, медоносные пчелы (Apis mellifera) участвуют в опылении растений как в естественных, так и в управляемых сельскохозяйственных системах. В этих экосистемах опыление представляет собой экологическую услугу, которая способствует увеличению природного биоразнообразия, а также производству продуктов питания и волокон для потребления человеком (1,2). К сожалению, за последнее десятилетие во всем мире произошли случаи депопуляции пчел и потери колоний медоносных пчел, особенно в конце зимы (3—6). К сокращению популяций пчел приводят различные факторы, включая патогены (паразиты, грибки, бактерии и вирусы), изменение или утрату экосистемы и/или использование агрохимикатов. Поскольку все эти потенциальные факторы могут изменить защитные механизмы иммунной системы пчел, необходимо сначала понять, как она функционирует, чтобы иметь возможность анализировать ее реакцию на различные инфекционные или неинфекционные условия, которые влияют на пчел.
Иммунные системы растений и животных включают органы и защитные механизмы, которые защищают их от чужеродных веществ и патогенных организмов, распознавая их как угрозу и реагируя на них. Большая часть современных знаний об иммунных системах и их реакциях была получена с использованием насекомых в качестве объектов исследования; в результате иммунитет у насекомых очень хорошо изучен. Многие насекомые являются переносчиками болезней животных и человека, а другие наносят большой ущерб сельскохозяйственным культурам. Большинство видов насекомых живут относительно недолго, но обладают сложными и эффективными иммунными системами. Например, иммунная система насекомых более эффективно обнаруживает патогены и реагирует на них, чем у позвоночных (7).
Плодовая мушка Drosophila melanogaster является наиболее изученным видом насекомых, и, помимо многих других областей исследований, изучение этой мушки помогло лучше понять врожденный иммунитет у других организмов. Исследования плодовых мушек позволили получить знания о механизмах распознавания патогенов, иммунной сигнализации и эффекторных реакциях против патогенов. Завершение работы над последовательностью генома дрозофилы в 2000 году позволило провести более мощный и специфический анализ иммунных реакций, существенно расширив знания о молекулярных основах иммунных систем. Эти исследования показали не только работу иммунной системы насекомых, но и функционирование врожденной иммунной системы человека, поскольку многие основные иммунные механизмы являются общими для дрозофилы и человека. Исследования других насекомых, геномы которых были секвенированы, таких как A. mellifera, также могут внести свой вклад в изучение иммунных реакций на молекулярном уровне. Поскольку их естественные патогены и генетическая структура хорошо известны, медоносная пчела может присоединиться к нескольким видам мух и мотыльков в качестве важной модели для изучения генетических механизмов иммунитета и болезней.
Иммунная система медоносной пчелы очень похожа на иммунную систему мух-дрозофил и комаров Anopheles, за исключением того, что у медоносных пчел имеется примерно одна треть иммунных генов, общих для Drosophila и Anopheles, которые объединены в 17 семейств (8,9). Однако у медоносных пчел больше генов для рецепторов запаха, а также специфических генов, регулирующих сбор пыльцы и нектара, что соответствует их поведению и социальной организации (10). Неявное уменьшение числа иммунных генов у пчел может отражать важность социальной защиты (т.е. основанной на социальном поведении) и/или их склонность подвергаться атакам ограниченного набора патогенов, которые в значительной степени коэволюционировали с ними (11). Сходство врожденных иммунных систем медоносных пчел, плодовых мушек и комаров Anopheles заключается в том, что все они обладают одинаковыми сигнальными путями. Поэтому большая часть наших знаний об иммунной системе A. mellifera была получена на основе знаний об иммунных системах диптерообразных.
Достижения в области геномики позволяют изучать эволюцию биологических систем и иммунных систем. Полученные в результате более глубокие знания оказались ценными для понимания, лечения и предотвращения заболеваний у видов, имеющих социальное или экономическое значение. Действительно, секвенирование генома A. mellifera позволило предсказать компоненты их иммунной системы, такие как распознающие рецепторы, эффекторы и пути, участвующие в защите хозяина (8).
Настоящий обзор иммунной системы медоносной пчелы охватывает как общие, так и специфические аспекты современных знаний о врожденной иммунной системе, ее компонентах и регуляции, иммунных ответах и социальном иммунитете.
Типы иммунных систем
Из двух типов иммунных систем, врожденной и адаптивной, высшие позвоночные имеют обе для борьбы с патогенами, в то время как у насекомых врожденная иммунная система является единственной линией защиты (Таблица 1).
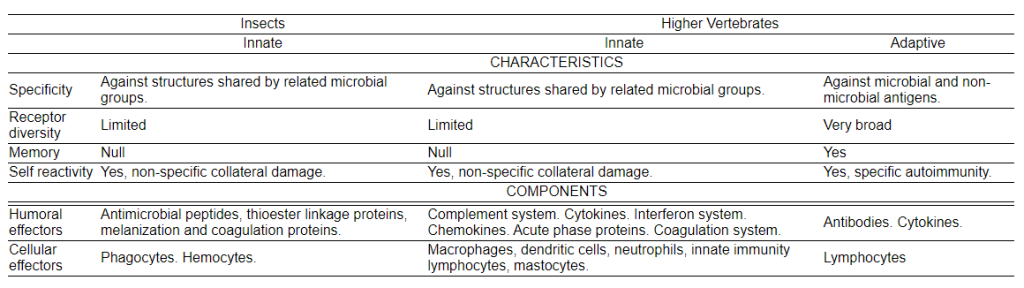
Врожденный иммунитет отвечает на воздействие патогенов или токсичных веществ приобретенными (уже существующими) механизмами, такими как физические барьеры (например, кутикула, слизистые оболочки и т.д.), а также клетки и химические вещества, нейтрализующие токсины и патогены. Врожденная иммунная система у высших позвоночных использует клеточные эффекторы, включая фагоциты, дендритные клетки, естественные клетки-киллеры и тучные клетки, среди прочих (7). Гуморальные эффекторы состоят из фракций системы комплемента, белков острой фазы, антимикробных пептидов (AMP), естественных антител и различных цитокинов, которые модулируют иммунный ответ (7). Специфичность врожденной иммунной системы отчасти передается по наследству, являясь результатом коэволюции индивидуальных иммунных систем с мириадами патогенов (12).
Адаптивный, или приобретенный, иммунитет относится к специфическим иммунным реакциям, направленным на определенные токсины или патогены. Эти токсины или патогены известны как антигены (генераторы антител) или иммуногены. Адаптивный иммунитет у позвоночных подразумевает способность запоминать конкретные патогены и реагировать выработкой антител, специфичных для каждого патогена, когда организм подвергается воздействию одного и того же патогена более одного раза.
Один из способов различия между врожденной и адаптивной иммунными системами основан на том, как организм кодирует молекулы, с помощью которых он распознает патогены. Врожденный иммунитет предполагает кодирование рецепторов распознавания непосредственно в зародышевой линии, которые затем наследуются потомством. В этом смысле репертуар рецепторов, выявленных у изученных видов, ограничен и беспорядочен. Адаптивный иммунитет требует гораздо больше рецепторов, чем врожденный иммунитет, причем репертуар рецепторов адаптивного иммунитета достаточно широк, чтобы потенциально распознавать бесконечное число патогенов (7).
Врожденная иммунная система и ее компоненты
Физические барьеры в сочетании с гуморальными защитными механизмами и различными клеточными процессами, действующими в синергии, являются мощными инструментами для нейтрализации паразитов, патогенов и ксенобиотиков.
Физические барьеры
Патогены и ксенобиотики, поражающие насекомых, сначала должны преодолеть физические барьеры системы врожденного иммунитета, такие как экзоскелет, трахейные трубки и слизистая оболочка кишечника. Вирусы, в частности, часто способны проникать через эти барьеры с помощью переносчика; например, многие вирусы передаются A. mellifera клещом Varroa destructor, который пробивает эти физические барьеры, облегчая тем самым вирусную инфекцию.
Клеточный иммунитет
Клеточный иммунитет обеспечивается гемоцитами — клетками, переносимыми гемолимфой, которые осуществляют такие процессы, как фагоцитоз, инкапсуляция и меланизация (13). У насекомых гемоциты также синтезируют и накапливают гуморальные эффекторы, такие как антимикробные пептиды (14), совместно с другими источниками растворимых эффекторов иммунной системы, такими как слюнные железы (15) и жировое тело. Последнее является функциональным аналогом печени у высших позвоночных, поскольку вырабатывает белки для борьбы с патогенами (16,17). Клеточные механизмы способствуют уничтожению чужеродных агентов; при столкновении с инфекционной или внешней частицей гемоциты могут ответить фагоцитированием или лизисом, или поглощением, чтобы нейтрализовать ее (13,18).
Мелкие инородные агенты могут быть фагоцитированы гемоцитами для удаления. Более крупные (или агрегаты мелких), однако, могут вызвать нодуляцию или инкапсуляцию, что предполагает совместное действие нескольких гемоцитов (19). Этот процесс требует агрегации и частичного разрушения гемоцитов на поверхности удаляемого агента (20). Затем высвобождаются кислородные и азотные медиаторы, воздействующие на микроорганизмы, и одновременно вырабатываются вещества, регулирующие процесс, которые действуют как антиоксиданты, сводя к минимуму возможный ущерб от чужеродных агентов.
Для того чтобы гемоциты могли выполнять свои фагоцитарные и восстановительные функции, они могут иметь своего рода молекулы адгезии, которые позволяют им связываться с различными поверхностями, другими клетками или друг с другом, что и происходит при нодуляции или инкапсуляции (21,22).
Хотя количество гемоцитов варьируется на разных стадиях развития пчел, эта функция инкапсуляции остается неизменной (23). Это примечательно, поскольку у взрослых пчел, включая рабочих, маток и трутней, количество кровяных телец уменьшается по мере старения (24).
Гемоциты насекомых были идентифицированы и классифицированы по их морфологическим, гистохимическим и функциональным характеристикам. В частности, у пчел цитология гемолимфы была охарактеризована с помощью различных методов. Первоначальные исследования выявили пять основных типов гемоцитов (25) , 90% которых представлены плазмоцитами. Они, в свою очередь, были классифицированы на четыре подтипа: прогемоциты, гемоциты сгустка, зернистые клетки и эноцитоиды; последние два связаны с меланизацией во время и после процесса инкапсуляции (20). Анализ проточной цитометрии не выявил значительных морфологических различий между гемоцитами (26), но определил два типа плазмоцитов. В другом исследовании группы клеток гемолимфы были классифицированы как пролейкоциты, эозинофилы, базофилы, нейтрофилы, пикнонуклеоциты, адиполейкоциты, сферукоциты, гранулоциты, макронуклеоциты, микролейкоциты и клетки веретенообразного типа (27). Другие предлагают функциональную классификацию клеток гемолимфы (например, адгезия к стеклу), что позволяет избежать возможной путаницы при морфологической классификации (21).
Меланизация — это сочетание гуморальных и клеточных процессов, происходящих во время инкапсуляции или нодуляции и заживления, и направленных на борьбу с повреждениями, будь они патогенно-опосредованные или иные. Эта клеточная реакция в системе защиты насекомых уничтожает большое количество бактериальных клеток, паразитов и ксенобиотиков (19). Ее основная функция — ограничить распространение агента и сохранить его для уничтожения (13). Эта центральная и очень эффективная стратегия защиты является фокусом механизмов уклонения, используемых многими энтомопатогенными микроорганизмами, что подтверждает ее важность как защитного механизма (19,28).
Профенолоксидаза (proPO) — это белок гемолимфы, который опосредует меланизацию. Активация proPO у насекомых происходит через каскад активации, начинающийся с распознавания патоген-ассоциированных молекулярных паттернов (PAMPs) рецепторами распознавания патогенов (PRRs), расположенными на гемоцитах. Они начинают процесс адгезии на вторгшихся агентах, создавая перекрывающую оболочку, вырабатывая и высвобождая проПО для дегрануляции или лизиса агентов. Вместе с образованием меланина и его полимеризацией (наряду с другими белками) для инкапсуляции вторгшегося агента, образуются реактивные промежуточные соединения кислорода и азота, такие как супероксидный анион, перекись водорода (20) и оксид азота (21,29). Они участвуют в разрушении агента и индукции меланизации. Этот процесс был продемонстрирован у A. mellifera (29). У пчел имеется только один ген proPO, тогда как у Drosophila sp. их три, а у Anopheles sp. девять. Этот кодируемый proPO ген экспрессируется сильнее у взрослых пчел, чем у личинок или куколок (9).
Гуморальный и химический иммунитет
Гуморальный ответ — это вторая категория врожденного иммунитета и наиболее важная защитная система насекомых, включая медоносных пчел. Он опосредован химическими веществами и антимикробными пептидами (АМП). Это небольшие, высококонсервативные белки, обычно размером от 12 до 50 аминокислот, которые вырабатываются и выделяются в гемолимфу насекомых в ответ на бактериальные и грибковые инфекции, но также могут синтезироваться при вирусных инфекциях (14). Эти гуморальные эффекторы являются основополагающими для врожденного иммунитета у насекомых. У некоторых опыляющих насекомых, таких как Bombus pascuorum, гуморальный ответ обнаруживается в течение 24-48 часов после заражения. Гуморальные эффекторы могут вырабатываться в гемоцитах, эпителиальных клетках и слюнных железах, но основным органом синтеза эффекторов является жировое тело спинной полости (30,31).
У насекомых описано более 170 AMP, хотя медоносные пчелы производят меньше гуморальных эффекторов, чем другие насекомые, такие как Drosophila и Anopheles (32). У медоносных пчел есть четыре семейства AMP с широкой активностью в гемолимфе: апидаецин, абаецин, гименоптаецин и дефенсин. Дефенсины — это небольшие AMP, которые действуют в основном против грамотрицательных бактерий, таких как E. coli, хотя они влияют на грамположительные бактерии и грибы (33). Существует 29 различных последовательностей кДНК для дефенсинов, пронумерованных от дефенсина 1 до дефенсина 29. Для абаецина существует одиннадцать последовательностей кДНК, кодирующих два различных пептида абаецина под названием AcAb1 и AcAb2. Апидаецин имеет тринадцать последовательностей кДНК, кодирующих четыре пептида: AcAp1 — AcAp4. Наконец, для гименоптаэцина существует 34 различные последовательности кДНК, кодирующие 13 различных пептидов (34).
В B. pascuorum и B. terrestris было показано, что AMP действуют в синергии для обеспечения более сильного антимикробного эффекта; это может включать потенцирование, когда один AMP может улучшить активность другого. Комбинация AMP увеличивает спектр ответов, а также их специфичность, эффективность и устойчивость, что позволяет сократить ресурсы, выделяемые иммунной системе, за счет усиления антимикробной активности AMP в низких концентрациях (35).
Регулирование иммунного ответа
Любой иммунный ответ включает в себя последовательность событий, которые в целом можно разделить на три этапа: 1) распознавание, 2) активация сигнальных путей и 3) клеточные и гуморальные эффекторные механизмы, направленные на уничтожение патогенов (рис. 1) (36). Иммунный ответ запускается процессом распознавания, в ходе которого PAMPs идентифицируются PRRs в клетках иммунной системы. В ответ активируются различные сигнальные пути, способствующие синтезу эффекторов и рецепторов, участвующих в гуморальном и клеточном иммунном ответе, а также белков распознавания пептидогликана (PGRP) (20).

Распознавание патогенов
Микроорганизмы представляют собой антигенные мозаики, которые могут по-разному распознаваться врожденной и адаптивной иммунными системами. Врожденная иммунная система распознает PAMPs, которые представляют собой сохраненные и жизненно важные белковые структуры, присутствующие в определенных группах микробов; например, липопарасахариды (LPS), липотейкоиновая кислота, зимозан, гликолипиды, гликопротеины или двухцепочечная РНК (7). Врожденная иммунная система также распознает молекулярные паттерны, ассоциированные с повреждением (DAMPs), которые представляют собой молекулы, экспрессируемые в клетках, подвергшихся инфекционному или неинфекционному повреждению, например, белок теплового шока. Однако у насекомых чаще всего речь идет об ассоциированных с микробами молекулярных паттернах (MAMPs), которые включают так называемые вирус-ассоциированные молекулярные паттерны (VAMPs) (32). Эти структуры действуют как экзогенные лиганды и распознаются белками или PRRs, которые присутствуют в растворимой форме или в клетках иммунной системы (12).
У дрозофилы существует множество PRR, например, некоторые члены семейства PGRP. Из 13 PRR у дрозофилы медоносные пчелы имеют четыре, два из которых синтезируются в ответ на инфекции (PGRP-S2 для пути Toll и PGRP-LC для пути Imd). Другие белки распознают грамотрицательные бактерии, например, GNBP1, который распознает 1,3 глюканы, но также могут распознавать грибы и участвуют в распознавании некоторых грамположительных бактерий (37,38). Эти белки распознавания образов могут быть связаны с серинпротеазами, которые инициируют деление Spaetzle и эндогенным лигандом Toll у дрозофилы; оба они активируются в эмбриогенезе и иммунном ответе (39). Два ортологичных гена семейства Spaetzle были идентифицированы в геноме пчелы (8,32,40,41,42).
Распознавание микробных структур запускает два основных события: 1) сигнальные события, которые происходят при стимуляции Toll и/или IMD рецепторов, и 2) события фагоцитоза. Гены DSCAM и Eater являются двумя примерами генов, связанных с эндоцитозом у пчел. Известно, что у дрозофилы DSCAM участвует в распознавании бактерий гемоцитами (42,43). Пептидогликаны, LPS и зимозан также распознают MAMPs. Вителлогенин является белком-носителем бактериальных фрагментов; он приобретается трансгенерационно, производя своего рода сенсибилизацию или «прайминг» врожденной иммунной системы у потомков (44,45).
Сигнальные пути
Внутриклеточные сигнальные пути преобразуют внешние сигналы или стимулы в действия внутри клеток, вызывая иммунный ответ, например, путем активации ряда генов, кодирующих белки, связанные с защитными системами хозяина (например, белки тиоэфирных связей — TLPs). Сигнальные пути зависят от больших мультибелковых комплексов, которые вызывают стимуляцию рецепторов клеточной поверхности специфическим лигандом и испускают внутриклеточный сигнал, инициирующий каскад ферментативной активности. Рецепторы, состоящие из трансмембранных белков, связаны с ферментами, такими как протеинкиназы. Они обычно фосфорилируют аминокислоту тирозин и поэтому называются тирозиназами. Начало этого внутриклеточного сигнального каскада направляет различные биохимические реакции, которые характеризуют конкретный клеточный ответ. У пчел имеются ортологичные гены для центральных членов или компонентов четырех внутриклеточных сигнальных путей, участвующих в активации эффекторов врожденного иммунитета (рис. 2), причем пути Toll и Imd являются наиболее важными у насекомых, включая пчел.

Рисунок 2 Сигнальные пути, молекулярная детализация
Толл-сигнальный путь
Толл-рецепторы на мембране клеток играют критическую роль как в онтогенетическом развитии, так и в иммунной системе. Только пять генов, связанных с Toll, были идентифицированы у пчел (Toll-1, -6, -2/7, -8, -10); они также присутствуют в геноме других насекомых, принадлежащих к порядкам Diptera, Lepidoptera и Coleoptera, за некоторыми исключениями. Сочетание генов Toll, присутствующих и отсутствующих у этих насекомых, позволяет предположить, что эти пять генов кодируют основной набор рецепторов Toll, присутствующих у их общего предка (8,32).
Пути активации включают привлечение цитоплазматических адаптерных белков, которые активируют киназы, что приводит к активации ядерных факторов и дерегуляции генов, кодирующих эффекторы иммунной системы, такие как факторы роста AMP. Отщепление Спаетцля стимулирует Toll-рецепторы, которые рекрутируют белки с доменом смерти (DD-death) для сборки рецепторного комплекса. В этом процессе адаптерный белок MyD88 рекрутирует TUBE и активирует протеинкиназу PELLE (аналог IRAK), которая затем рекрутирует адаптер dTRAF0. Этот комплекс вызывает деградацию CACTUS (аналог белка-ингибитора NF-κB, IκB), позволяя фактору транскрипции DORSAL (аналог NF-κB) транспортироваться в ядро и связываться с регионами, способствующими развитию иммунных эффекторных генов, вызывая их экспрессию. Эффекторы, синтезируемые при активации этого пути, — это в основном AMP и лизоцимы (8,46).
Сигнальный путь Imd
У пчел и мух сигнальный путь иммунодефицита (Imd) активирует фактор транскрипции RELISH (гомолог фактора транскрипции NF-κB). У мух он контролирует экспрессию большинства AMP, что делает этот путь незаменимым для иммунного ответа против микроорганизмов. Также было продемонстрировано присутствие CACTUS в качестве ингибитора транскрипционного фактора. Этот путь хорошо сохранился у пчел с возможными ортологами для всех компонентов. Хотя это убедительно свидетельствует о том, что сигнальные пути у мух и пчел похожи, это не обязательно означает, что они имеют одинаковые биологические функции (8). Распознавание микроорганизмов через белок распознавания пептидов-глюканов (PGRP-LC) является первым шагом в начале иммунного ответа через Imd-сигнализацию (47). Активация Imd-пути также приводит к активации компонентов сигнального пути JNK, и есть доказательства того, что последний контролирует экспрессию синтеза AMP посредством как положительной, так и отрицательной обратной связи. Известно, что возможные ортологи этого пути, такие как Basket, JNK и JNK-protein 1 interaction, среди прочих, присутствуют у пчел (48).
Сигнальный путь JAK/STAT
JAK/STAT (Janus-family tyrosinkinases [JAK]/transcription activator proteins [STAT]) сигнальный путь у насекомых участвует в синтезе эффекторов, аналогичных системе комплемента, а также в пролиферации и индукции фагоцитоза клетками крови, и противовирусных ответах (8). У высших позвоночных этот сигнальный путь необходим для синтеза многих цитокинов. Это относительно быстрый сигнальный путь, поскольку он напрямую фосфорилирует STATs, которые являются димеризованными транскрипционными факторами. Они переносятся в ядро, где стимулируют экспрессию генов, которые могут быть индуцированы лигандом рецептора. Единственный белок, который, похоже, полностью отсутствует у пчелы, — это лиганд сигнального пути JAK /STAT.
У пчел существует пять генов-гомологов дрозофилы для компонентов JAK/STAT-пути: 1) цитокиновый рецептор DOMELESS (dom), 2) тирозинкиназа JAK (hopscotch), 3) транскрипционный фактор STAT92E, 4) негативные регуляторные белки пути, такие как супрессоры цитокинового сигналинга (SOCS), и 5) белок-ингибитор активированного STAT (PIAS). Этот путь заканчивается дерегуляцией генов, кодирующих гуморальные эффекторы иммунной системы; например, различные тиоэстер-переносящие белки (TEPs) у пчел. Однако не было выявлено генов tot, которые у дрозофилы кодируют гуморальные эффекторы в результате сильного стресса и вырабатываются при активации этого пути (49,50). У пчел также существуют два компонентных ортолога этого пути: тирозинфосфатазы Ptp61F и WD40 (8). Хотя ключевой лиганд для JAK/STAT неизвестен, наличие аналога цитокинового рецептора Domeless, в дополнение к присутствию других компонентов JAK/STAT, указывает на то, что это общий механизм у насекомых, проявляющийся у пчел и плодовых мушек.
Сигнальный путь RNAi
Распознавание VAMPs у пчел было связано с системой РНК-интерференции (RNAi), физиологическим механизмом глушения генов, который также функционирует как защитный механизм против вирусных инфекций, заглушая цикл репликации вируса. Основные компоненты пути RNAi существуют при вирусных инфекциях у пчел; в ходе этого процесса двухцепочечные РНК (дсРНК) распознаются сенсором дсРНК, производимым dicer-подобным геном у пчел (51). Этот сенсор связан с семейством PRRs или цитозольными сенсорами RIG-1 у млекопитающих (dicer). После того как DICER разрезает дсРНК, образующиеся небольшие фрагменты дсРНК, известные как малые интерферирующие РНК (siRNA) и микроРНК (miRNA), распознаются комплексом РНК-индуцированного сайленсинга (RISC). Последний содержит белки семейства AGO2 (argonaute-2) (51) , которые он превращает в малые одноцепочечные РНК (ssRNA). Эти малые ssRNA связываются с транскриптами мРНК, которые содержат комплементарные последовательности, тем самым предотвращая синтез белка. Активация этого пути у пчел приводит к увеличению экспрессии гена vago, ортолога, найденного у дрозофилы, что приводит к подавлению вирусной репликации (47,52). Другим эпигенетическим механизмом у пчел с противовирусной функцией является метилирование ДНК, которое является частью противовирусного ответа (52).
Эффекторы иммунного ответа
Распознавание патогенных PAMPs или MAMPs с помощью PRRs, которое активирует различные сигнальные пути, заканчивается синтезом или активацией клеточных и/или гуморальных эффекторов иммунной системы. В то время как AMP являются основными постинфекционными эффекторами, у пчел и других насекомых был идентифицирован трансферрин. У высших позвоночных трансферрин входит в группу белков острой фазы, иммунная функция которых заключается в связывании железа и, таким образом, ограничении бактериальной инфекции (53,54). Подобно Drosophila и B. mori, у медоносных пчел есть три члена семейства трансферрина (55), а пути их экспрессии — Imd и Toll (9). Активация сигнального пути JAK-STAT приводит к синтезу других эффекторов системы врожденного иммунитета, таких как TEPs, которые имеют фракцию C3 системы комплемента, характерную тиоэфирную связь их аналога у высших позвоночных. Эта характерная связь позволяет активированным белкам ковалентно связываться с поверхностью микроорганизмов и запускать иммунный ответ (12).
У дрозофилы эти белки синтезируются жировым телом, а у Anopheles — гемоцитами. У последних прямые доказательства показали связь TEPs с функцией распознавания белков микроорганизмов и их участие в фагоцитозе грамотрицательных бактерий; поэтому их приравнивают к опсонинам. В геноме пчелы было найдено только четыре гена, кодирующих TEPs, по сравнению с 15 генами в геноме Anopheles и шестью генами у Drosophila (8,56,57).
Сериновые протеазы (СП) — это ферменты, участвующие в различных физиологических процессах, таких как пищеварение, развитие и иммунный ответ. Синтезируемые как зимогены, они участвуют в активационных каскадах, которые приводят к синтезу эффекторов. У млекопитающих наиболее известными представителями этого семейства белков с иммунной функцией являются те, которые участвуют в каскаде коагуляции и системе комплемента; у беспозвоночных они участвуют в острофазовом ответе (8,58). Из 57 геномных последовательностей, связанных с SP в геноме пчелы, 44 соответствуют SP и 13 — гомологам SP. Как и в случае со многими другими генами (8) , 57 связанных с SP последовательностей у пчел меркнут перед 204 последовательностями у Drosophila (59) и 305 последовательностями у Anopheles (60).
У пчел сигнальный путь Toll распознает предполагаемые ортологи змеи и пожирателя, связанные с расщеплением Spaetzle и активацией пути, что приводит к синтезу эффекторов, таких как DROSOMICINE, как это происходит у плодовой мушки. У пчел также есть геномные последовательности SP, сходные с другими насекомыми, которые связаны с каскадом активации профенолоксидазы (58).
Последним регуляторным механизмом являются СЕРПИНЫ — высококонсервативные белки, присутствующие в гемолимфе насекомых. Эти белки отвечают за устранение избытка протеаз, поддержание гомеостаза и предотвращение нерегулируемой активации иммунных реакций, таких как меланизация или синтез Toll-опосредованных антимикробных белков (61). У медоносных пчел было выявлено семь ортологов, пять из которых кодируют SERPINES, а остальные два кодируют белки типа SERPINE (58).
Социальный иммунитет
Одной из характеристик социальных насекомых в целом, и пчел в частности, является их социальная жизнь, совместное использование гнезда. Гнезда обычно содержат запасы пищи и высокую плотность особей, живущих в относительном гомеостазе. Поэтому гнезда социальных насекомых являются привлекательными местами для развития различных инфекционных агентов (62). Однако социальные насекомые выработали социальный иммунитет (11), который характеризуется кооперативным поведением внутри колонии с помощью различных механизмов, таких как:
1) Социальная лихорадка. Социальная лихорадка возникает в результате выработки пчелами дополнительного тепла в гнезде. Этот механизм является дорогостоящим для здоровых особей, но позволяет контролировать патогены в зараженных хозяевах. Повышение температуры в гнезде благоприятствует борьбе с патогенным грибком Ascosphaera apis (63).
2) Груминг. Груминг — это способность пчел удалять внешних паразитов со своего тела с помощью мандибул и ног (36,64). Существует два типа грумингового поведения: само груминг и социальный груминг. Социальный груминг предполагает сотрудничество нескольких особей (65) , но само груминг встречается чаще, чем социальный груминг. Колонии, в которых большая часть рабочих выражает этот признак, более устойчивы к заражению клещом Varroa destructor, чем колонии, в которых его выражает меньшее количество членов. Более того, энергичность, с которой рабочие колонии осуществляют груминг, напрямую связана с количеством клещей, которых они снимают со своего тела (66,67). На поведение груминга влияют генетические факторы, степень выраженности которых варьируется между колониями медоносных пчел разных рас и пород (68,69). В нескольких исследованиях был картирован ген (Neurexin), который связан с этим поведением (70,71).
3) Гигиеническое поведение. Гигиеническое поведение — это способность рабочих пчел обнаруживать и удалять больной или паразитирующий расплод (личинок и куколок) из ячеек гребня (36). Это двухступенчатый защитный механизм. Сначала рабочие откупоривают ячейки, содержащие больных или паразитирующих личинок или куколок, а затем удаляют их из гнезда (36). Такое социальное поведение является защитным механизмом, который помогает контролировать грибок A. apis (возбудитель меловой мухи)(72), бактерию Paenibacillus larvae (73) (этиологический агент американской мухи) и клеща V. destructor (68). Пчелы разных генотипов различаются по уровню выраженности этого поведения (73,74,75). Гигиеническое поведение зависит от группы, состоящей по меньшей мере из семи генов, что означает, что оно имеет более сложное генетическое кодирование, чем считалось ранее (74), а также, по-видимому, наследуется по материнской линии (75).
4) Сбор и использование прополиса. Пчелы собирают прополис — смолы деревьев (в основном хвойных), обладающие антисептическими и противомикробными свойствами. Они используют его в основном в качестве профилактического средства. Прополис используется для покрытия внутренней поверхности расплодных ячеек или для мумификации беспозвоночных или мелких позвоночных животных, которые попадают внутрь колонии и погибают там, предотвращая или сводя к минимуму развитие болезнетворных бактерий и грибков (64). Кроме того, наличие определенных видов прополиса внутри колонии может способствовать экспрессии генов иммунной системы пчел (3,76).
5) Уменьшение контактов между сородичами. Особи выражают этот тип альтруистического поведения, когда болеют, удаляясь от колонии, чтобы умереть вне расплодного гнезда (77).
6) Каннибализм потомства. В стрессовых ситуациях, которые могут привести к гибели расплода (например, отсутствие пищи, экстремальные температуры), пчелы-кормилицы обычно каннибализируют мертвый расплод, чтобы предотвратить развитие патогенных микроорганизмов, таких как A. apis. Этот механизм также предотвращает потерю питательных веществ из колонии.
В качестве защитной стратегии социальный иммунитет существенно снижает давление на иммунную систему отдельных пчел, тем самым уменьшая количество генов, необходимых для защиты от инфекции, по сравнению с Diptera. Это может объяснить, почему A. mellifera обладает лишь одной третью генов распознавания и иммунных эффекторных сигнальных генов Anopheles и Drosophila (8, 9, 11).
ВЫВОДЫ
Медоносные пчелы обладают врожденной иммунной системой, также известной как индивидуальный иммунитет. Эта система включает физические барьеры, а также клеточные и гуморальные реакции, которые являются генералистическими по своей природе и позволяют им защищаться от широкого спектра инфекционных и паразитических организмов. Помимо различных патогенов, поражающих пчел и активизирующих их иммунную систему, ксенобиотики, такие как акарициды, фунгициды, гербициды и пестициды, также могут оказывать влияние на здоровье пчел и иммунную систему. Защитные механизмы включают сигнальные пути, рецепторы распознавания патогенов и эффекторы врожденной иммунной системы.
Условия высокой плотности в гнездах медоносных пчел в сочетании с наличием запасов пищи делают их привлекательными для различных патогенов. Однако эти условия также способствуют развитию социального иммунитета, характеризующегося кооперативным поведением внутри колонии с помощью различных механизмов, таких как социальная лихорадка, поведение груминга, гигиеническое поведение, сбор и использование прополиса и др. Социальный иммунитет — это стратегия защиты, которая значительно снижает нагрузку на иммунную систему отдельных пчел, что приводит к уменьшению количества генов, связанных с защитой. Это может объяснить, почему A. mellifera имеет одну треть генов, связанных с распознаванием и сигнализацией иммунных эффекторов, по сравнению с Anopheles или Drosophila. На иммунную систему Apis mellifera влияют многочисленные факторы, такие как патогены и пестициды, что подчеркивает важность дальнейшего изучения влияния этих факторов на иммунные реакции. Будущие исследования должны быть направлены на изучение молекулярных механизмов иммунной системы, а также на потенциальное применение определенных эффекторов для лечения и/или профилактики патологий и заболеваний.
ССЫЛКИ
1. Klein AM, Müller C, Hoehn P, Kremen C. Understanding the role of species richness for crop pollination services. Biodiversity, ecosystem function and human wellbeing. New York, USA. 2009;10:195-208. [ Links ]
2. Lautenbach S, Seppelt R, Liebscher J, Dormann CF. Spatial and temporal trends of global pollination benefit. PloS One 2012;7:e35954. [ Links ]
3. Simon-Delso N, San Martin G, Bruneau E, Minsart LA, Mouret C, Hautier L. Honeybee colony disorder in crop areas: The role of pesticides and viruses. PLoS ONE 2014;9(7):e103073. doi:10.1371/journal.pone.0103073. [ Links ]
4. Dainat B, Evans JD, Chen YP, Gauthier L, Neumann P. Predictive markers of honey bee colony collapse. PLoS ONE 2012;7(2):e32151. doi:10.1371/journal.pone.0032151. [ Links ]
5. Guzman-Novoa E. Colony collapse disorder and other threats to honey bee. In: One health case studies, 5M Publishing LTD, 2016:204-216. [ Links ]
6. Sánchez-Bayo F, Goulsonb D, Pennacchio F, Nazzi F, Goka K, Desneux N. Are bee diseases linked to pesticides? — A brief review. Env Internat 2016;89-90:7-11. [ Links ]
7. Murphy K, Travers P, Walport M. Janeway`s Inmunobiology. 9na ed. London and New York: Garland Science Ed; 2017. [ Links ]
8. Evans JD, Aronstein K, Chen YP, Hetru C, Imler JL, Jiang H, et al. Immune pathways and defense mechanisms in honey beesApis mellifera. Ins Molec Biol 2006;15(5):645-656. [ Links ]
9. Lourenço AP, Karina R, Guidugli-Lazzarini FCP, Freitas M, Bitondi MG, Zilá LP et al. Bacterial infection activates the immune system response and dysregulates microRNA expression in honey bees. Ins Bioch Molec Biol 2013;43(5):474-82. doi: 10.1016/j.ibmb.2013.03.001. [ Links ]
10. HGSC (The Honeybee Genome Sequencing Consortium). Insights into social insects from the genome of the honeybee Apis mellifera. Nature 2006;443:931-949. [ Links ]
11. Cremer S, Armitage SAO, Schmid-Hempel P. Social immunity. Curr Biol 2007;17:R693-R701. doi:10.1016/j.cub.2007.06.008. [ Links ]
12. Murphy K, Travers P, Walport M. Inmunobiologia de Janeway, 7ma ed. Capítulo 16. Evolución del sistema inmunitario. México: Editorial McGrawHill; 2009. [ Links ]
13. Strand MR. The insect cellular immune response. Ins Sci 2008;15:1-14. [ Links ]
14. Lemaitre B, Hoffmann J. The host defense of Drosophila melanogaster. Annu Rev Immunol 2007;25:697-743. [ Links ]
15. Korayem AM, Fabbri M, Takahashi K, Scherfer C, Lindgren M, Schmidt O, et al. A Drosophila salivary gland mucin is also expressed in immune tissues: evidence for a function in coagulation and the entrapment of bacteria. Ins Bioch Molec Biol 2004;34(12):1297-304. [ Links ]
16. Brown GD, Gordon S. Fungal β-Glucans and mammalian immunity. Inmunity 2003;19(3):311-315. [ Links ]
17. Gillespie JP, Trenczek T, Kanost MR. Biological mediators of insect immunity. Annu Rev Entomol 1997:42:611-643. [ Links ]
18. Marmaras VJ, Lampropoulou M. Regulators and signalling in insect haemocyte immunity. Cell Signal 2009;21,186-195. [ Links ]
19. Eleftherianos I, Felföldi G, French-Constant RH, Reynolds SE. Induced nitric oxide synthesis in the gut of Manducasexta protects against oral infection by the bacterial pathogen Photorhabdusluminescens. Insect Mol Biol; 2009;18(4):507-16. doi: 10.1111/j.1365-2583.2009.00899.x. [ Links ]
20. Dubovskiy IM, Kryukova NA, Glupov VV, Ratcliffe. Review: Encapsulation and nodulation in insects ISJ 2016;13:229-246. [ Links ]
21. Negri P, Maggi M, Correa-Aragunde N, Brasesco C, Eguaras M, Lamattina L. Nitric oxide participates at the first steps of Apis mellifera cellular immune activation in response to non-self recognition. Apidologie 2013; doi:10.1007/s13592-013-0207-8. [ Links ]
22. Marringa WJ, Krueger MJ, Burritt NL, Burritt, JB. Honey bee hemocyte profiling by flow cytometry. PLoS ONE 2014;9 (10), e108486. doi:10.1371/journal.pone.0108486. [ Links ]
23. Wilson-Rich N, Stephanie T, Starks PT. The ontogeny of immunity: Development of innate immune strength in the honey bee (Apis mellifera) J Insect Physiol 2008;54,1392-1399. [ Links ]
24. Schmid MR, Brockmann A, Pirk CW, Stanley DW, Tautz J. Adult honeybees (Apis mellifera L.) abandon hemocytic, but not phenoloxidase-based immunity. J Ins Physiol 2008;54(2):439-44. doi:10.1016/j.jinsphys.2007.11.002. [ Links ]
25. Van Steenkiste D. De hemocyten van dehonigbij (Apis mellifera L). Typologie, bloedbeeldencellulaireverdedigingsreacties [doctoral thesis]. Gent, Belgium: Rijksuniversiteit; 1988. [ Links ]
26. de Graaf D, Dauwe R, Walravens K, Jacobs FJ. Flow cytometric analysis of lectin-stained haemocytes of the honeybee (Apis mellifera). Apidologie 2002;33,571-579 doi: 10.1051/apido:2002041. [ Links ]
27. Zakaria ME. The cellular immunity responses in the haemolymph of honey bee workers infected by american foulbrood disease (AFB). J App Sci Res 2007;3(1):56-63. [ Links ]
28. Dean P, Richards EH, Edwards JP, Reynolds SE, Charnley K. Microbial infection causes the appearance of haemocytes with extreme spreading ability in monolayers of the tobacco hornworm Manducasexta. Dev Comp Immunol 2004;28,689-700. [ Links ]
29. Negri P, Maggi MD, Massazza D, Correa-Aragunde N, Eguaras MJ, Lamattina L. Nitric oxide stimulates melanin production during immune response in Apis mellifera . Biocell 2012;36,68. [ Links ]
30. Gätschenberger H, Azzami K, Tautz J, Beier H. Antibacterial immune competence of honey bees (Apis mellifera) is adapted to different life stages and environmental risks. PLoS ONE 2013;8(6): e66415. doi:10.1371/journal.pone.0066415. [ Links ]
31. Schlüns H, Crozier RH. Relish regulates expression of antimicrobial peptide genes in the honeybee, Apis mellifera, shown by RNA interference. Insect Mol Biol 2007;16(6):753-9. [ Links ]
32. Brutscher LM, Daughenbaugh KF, Flenniken ML. Antiviral defense mechanisms in honey bees. Curr Opin Insect Sci 2015;10:71-82. [ Links ]
33. Yi HY, Chowdhury M, Huang YW, Yu XQ. Insect antimicrobial peptides and their applications. Appl Microbiol Biotechnol 2014;98(13):5807-5822. doi:10.1007/s00253-014-5792-6. [ Links ]
34. Xu P, Shi M, Chen XX. Antimicrobial peptide evolution in the Asiatic honey bee Apiscerana. PLoS ONE 2009;4(1): e4239. doi:10.1371/journal.pone.0004239. [ Links ]
35. Rahnamaeian M, Cytryníska M, Zdybicka-Barabas A, Dobslaff K, Wiesner J, Twyman RM, et al. Insect antimicrobial peptides show potentiating functional interactions against Gram-negative bacteria. Proc R Soc B 2015;282: 20150293. http://dx.doi.org/10.1098/rspb.2015.0293. [ Links ]
36. Guzman-Novoa E. Integration biotechnologies. Genetic basis of disease resistance in the honey bee (Apis mellifera). In: Murray M-Y editor. Comprehensive biotechnology, Second ed. Elsevier. 2011;(4):763-767. [ Links ]
37. Stokes BA, Yadav S, Shokal U, Smith LC, Eleftherianos I. Bacterial and fungal pattern recognition receptors in homologous innate signaling pathways of insects and mammals. Frontiers in Microbiol 2015;6:19. doi:10.3389/fmicb.2015.00019. [ Links ]
38. Wang L, Weber ANR, Atilano ML, Filipe SR, Gay NR, Ligoxygakis P. Sensing of Gram-positive bacteria in Drosophila: GNBP1 is needed to process and present peptidoglycan to PGRP-SA. The EMBO J 2006;25,5005-5014. [ Links ]
39. Valanne S, Wang JH, Mika Rämet M. The Drosophila Toll signaling pathway. J Immunol 2011;186:649-656. doi:10.4049/jimmunol.1002302. [ Links ]
40. Evans JD. Beepath: An ordered quantitative-PCR array for exploring honey bee immunity and disease J Inv Pathol 2006;93:135-139. doi:10.1016/j.jip.2006.04.004. [ Links ]
41. Richard FJ, Holt HL, Grozinger CM. Effects of immunostimulation on social behavior, chemical communication and genome-wide gene expression in honey bee workers (Apis mellifera). BMC Genomics 2012;13:558 http://www.biomedcentral.com/1471-2164/13/558. [ Links ]
42. Gravely BR, Kaur A, Gunning D, Zipursky SL, Rowen L, Clemens JC. The organization and evolution of the Dipteran and Hymenopteran Down syndrome cell adhesion molecule (Dscam) genes. RNA (New York, NY) 2004;10:1499-1506. [ Links ]
43. Boncristiani H, Underwood R, Schwarz R, Evans JD, Pettis J, van Engelsdorp D. Direct effect of acaricides on pathogen loads and gene expression levels in honey bees Apis mellifera. J Insect Physiol 2012;58(5):613-20. doi: 10.1016/j.jinsphys.2011.12.011. [ Links ]
44. Salmela H, Amdam GV, Freitak D. Transfer of immunity from mother to offspring is mediated via egg-yolk protein vitellogenin. PLOS Pathogens 2015;11(7):e1005015. doi.org/10.1371/journal.ppat.1005015. [ Links ]
45. Hernandez Lopez J, Schuehly W, Crailsheim K, Riessberger-Galle U. Trans-generational immune priming in honeybees. Proc R Soc B 2014;281. doi.org/10.1098/rspb.2014.0454. [ Links ]
46. Harpur BA, Zayed. A. Accelerated evolution of innate immunity proteins in social insects: Adaptive evolution or relaxed constraint? Mol Biol Evol 2013; doi:10.1093/molbev/mst061. [ Links ]
47. Ryabov EV, Wood GR, Fannon JM, Moore JD, Bull JC, Chandler D, et al. A virulent strain of Deformed Wing Virus (DWV) of honeybees (Apis mellifera) prevails after Varroa destructor-mediated, or in vitro, transmission. PlosPathog 2014;10:e1004230. [ Links ]
48. Elsik CG, Worley KC, Bennett AK, Beye M, Camara F, Childers CP, et al. Finding the missing honey bee genes: lessons learned from a genome upgrade. BMC Genomics 2014;30;15:86, doi: 10.1186/1471-2164-15-86. [ Links ]
49. Adams MD, Celniker SE, Holt RA, Evans CA, Gocayne JD, Amanatides PG, et al. The genome sequence of Drosophila melanogaster. Science 2000;287:2185-2195. [ Links ]
50. Ammeux N, Housden BE, Georgiadis A, Hu Y, Perrimo N. Mapping signaling pathway cross-talk in Drosophila cells. Proc Nat Acad Sci. 2016;113(35):9940-5. doi: 10.1073/pnas.1610432113. [ Links ]
51. Cornman, RS, Chen YP, Schatz MC, Street C, Zhao Y, Desany B, et al. Genomic analyses of the microsporidian Nosemaceranae, an emergent pathogen of honey bees. PLoS Path 2009;5:4-8. doi: 10.1371/journal.ppat.1000466. [ Links ]
52. Galbraith DA, Yang X, Nino EL, Yi S, Grozinger C. Parallel epigenomic and transcriptomic responses to viral infection in honey bees (Apis mellifera). PloSPathog 2015;11(3):e1004713. [ Links ]
53. Yoshiga T, Georgieva T, Dunkov BC, Harizanova N, Ralchev K, Law JH. Drosophila melanogaster transferrin. Cloning, deduced protein sequence, expression during the life cycle, gene localization and up-regulation on bacterial infection. Eur J Biochem 1999;260(2):414-20. [ Links ]
54. Nichol H, Law JH, Winzerling JJ. Iron metabolism in insects. Annu Rev Entomol 2002;47:535-59. [ Links ]
55. Dunkov B, Georgieva T. Insect iron binding proteins: insights from the genomes. Ins Bioch Mol Biol 2006;36(4):300-309. [ Links ]
56. Blandin S, Levashina EA. Thioester-containing proteins and insect immunity. Molecular Immunol 2004;40:903-908. [ Links ]
57. Castillo JC, Creasy T, Kumari P, Shetty A, Shokal U, Tallon LJ, Eleftherianos I. Drosophila anti-nematode and antibacterial immune regulators revealed by RNA-Seq BMC Genomics 2015;16:519. doi: 10.1186/s12864-015-1690-2. [ Links ]
58. Zou Z, Lopez DL, Kanost MR, Evans JD, Jiang H. Comparative analysis of serine protease-related genes in the honey bee genome: possible involvement in embryonic development and innate immunity. Ins Molec Biol 2006;15(5),603-614. [ Links ]
59. Ross J, Jiang H, Kanost MR, Wang Y. Serine proteases and their homologs in the Drosophila melanogaster genome: an initial analysis of sequence conservation and phylogenetic relationships. Gene 2003;304(1-2):117-131. [ Links ]
60. Christophides GK, Zdobnov E, Barillas-Mury C, Birney E, Blandin S, Blass C, et al. Immunity-related genes and gene families in Anopheles gambiae. Science 2002;298:159-65. [ Links ]
61. Kanost MR, Clarke TE. Proteases. Comprehensive Molecular Insect Science 2005;4:247-265. doi: 10.1016/b0-44-451924-6/00057-0. [ Links ]
62. Schmid-Hempel P. Parasites in social insects. New Jersey, USA: Press Princeton Univ; 1998 [ Links ]
63. Starks PT, Blackie CA, Seeley TD. Fever in honeybee colonies. Naturwissenschaften 2000;87,229-231. [ Links ]
64. de Roode JC, Lefêvre T. Behavioral Inmunityin insects. Insects 2012;3:789-820. doi:10.3390/insects3030789. [ Links ]
65. Pritchard DJ. Grooming by honeybees as a component of varroa resistant behavior. J Apic Res 2016;55 (1):38-48. [ Links ]
66. Guzman-Novoa E, Emsen B, Unger P, Espinosa-Montaño LG, Petukhova T. Genotypic variability and relationships between mite infestation levels, mite damage, grooming intensity, and removal of Varroa destructor mites in selected strains of worker honey bees (Apis mellifera L.). J Invert Pathol 2012;110:314-320. [ Links ]
67. Guzman-Novoa E, Vandame R, Arechavaleta-Velasco ME. Susceptibility of European and Africanized honey bees (Apis mellifera L.) to Varroa jacobsoni Oud. in Mexico. Apidologie 1999;30:173-182. [ Links ]
68. Boecking O, Drescher W. The removal response of Apis mellifera L. colonies to brood in wax and plastic cells after artificial and natural infestation with Varroa jacobsoni Oud. and to freeze killed brood. Exp Appl Acarol 1992;16:321-329. [ Links ]
69. Rinderer TE, de Guzman LI, Delatte GT, Stelzer J, Lancaster V, Kuznetsov V. et al. Resistance to the parasitic mite Varroa destructor in honey bees from far-eastern Russia. Apidologie 2001;32(4):381-394. [ Links ]
70. Arechavaleta-Velasco ME, Alcala-Escamilla K, Robles-Rios C, Tsuruda JM, Hunt GJ. Fine-scale lingkage mapping reveals a small set of candidte genes influencing honey bee grooming behavior in response to varroa mites. PLoS One 2012;7:e47269. [ Links ]
71. Hamiduzzaman MH, Emsen B, Hunt GJ, Subramanyam S, Williams CE, Tsuruda JM, et al. Differential gene expression associated with honey bee grooming behavior in response to varroa mites. Behavior Gene tics 2017;47:335-344. doi: 10.1007/s10519-017-9834-6. [ Links ]
72. Gilliam M, Taber S, Richardson GV. Hygienic behavior of honey bees in relation to chalkbrood disease. Apidologie 1983;14:29-39. [ Links ]
73. Rothenbuhler W. Behaviour genetics of nest cleaning in honey bees. I. Responses of four inbred lines to disease-killed brood. Anim Behav 1964;12,578-583. [ Links ]
74. Lapidge KL, Oldroyd BP, Spivak M. Seven suggestive quantitative trait loci influence hygienic behavior of honey bees. Naturwissenschaften 2002;89:565-568. [ Links ]
75. Unger P, Guzman-Novoa E. Maternal effects on the hygienic behavior of Russian x Ontario hybrid honeybees (Apis mellifera L.). J Heredity 2010;101:91-96. doi:10.1093/jhered/esp092. [ Links ]
76. Simone M, Evans JD, Spivak M. Resin collection and social immunity in honey bees. Evolution 2009;63(11):3016-3022. [ Links ]
77. Rueppell O, Hayworth MK, Ross NP. Altruistic self-removal of health-compromised honey bee workers from their hive. J Evol Biol 2010;23:1538-1546. [ Links ]

Добавить комментарий