Аннотация
Глобализация способствовала распространению новых вредителей, таких как клещ Varroa destructor, что привело к почти глобальному распространению этого вредителя. У южноафриканских и бразильских медоносных пчел колонии, устойчивые к клещу, появились в течение десятилетия; в Европе колонии, устойчивые к клещу, встречаются редко, но некоторые из них демонстрируют высокий уровень поведения «повторного укупоривания». Мы изучили повторное укупоривание в популяциях, не зараженных варроа (Великобритания/Австралия) и устойчивых к варроа (Южная Африка и Бразилия), и обнаружили очень низкий и очень высокий уровень, соответственно, причем устойчивые популяции нацеливались на клетки, зараженные клещом. Более того, 54% искусственно зараженных рабочих клеток A. m. capensis были удалены через 10 дней, а 83% оставшихся зараженных клеток были повторно заселены. Подобного целенаправленного повторного закрытия клеток трутней не происходило. Мы предполагаем, что вскрытие клеток является фундаментальной чертой популяций, устойчивых к клещам, и что повторное укупоривание является точным показателем этого поведения.
1 Введение
За последние 70 лет эктопаразитический клещ «Варроа» (Varroa destructor) распространился по всему миру и стал самой большой угрозой для пчеловодства, уничтожая большое количество управляемых колоний медоносных пчел Apis mellifera (Rosenkranz et al. 48), одновременно уничтожая одичавшие и дикие популяции (Wenner et al. 56). Многие пчеловоды первоначально выступали за разведение выживших особей, но в подавляющем большинстве случаев их колонии в конечном итоге погибали, поскольку все существовавшие ранее защитные адаптации либо не были достаточно развиты, либо были подавлены огромным количеством клещей, изначально циркулировавших в популяции. Поэтому страны Северного полушария и те (например, Аргентина, Новая Зеландия), которые импортировали медоносных пчел из Северного полушария и впоследствии заразились варроа, были вынуждены использовать митициды для контроля численности клещей и защиты своих популяций пчел.
Напротив, хотя эволюция защитных механизмов может происходить быстро (< 100 лет), но редко наблюдается одновременно в аллопатрических популяциях (Thompson 52), в Южной Африке и Бразилии их медоносные пчелы быстро стали устойчивыми к Варроа (Rosenkranz 46). То есть, они не получали и не нуждались в применении каких-либо методов борьбы с клещами для обеспечения своего долгосрочного выживания, и не произошло потери колоний в масштабах всей популяции.
Западная медоносная пчела A. mellifera, состоящая примерно из 30 географических подвидов, зародилась в Африке и, по-видимому, дважды распространилась в Евразии, после чего последовала более поздняя антропогенная экспансия в Америку (включая Бразилию, см. ниже), Азию и Австралазию (Уитфилд и др. 57). Африканские медоносные пчелы устойчивы ко многим патогенам и паразитам, которые часто поражают (и с которыми необходимо бороться) другие регионы мира, о чем свидетельствует ограниченное количество методов борьбы с вредителями, практикуемых в Африке (Pirk et al. 42). Клещ Варроа прибыл в Африку в 1997 году в Капскую область Южной Африки (Allsopp 1). Поначалу это сопровождалось некоторыми потерями колоний, однако они были кратковременными: устойчивость к клещу проявилась через 3-5 лет у капской медоносной пчелы (A. m. capensis) и через 6-7 лет у саванной медоносной пчелы (A. m. scutellata) (Allsopp 1). Такая картина кратковременной потери колоний до появления устойчивости к клещу часто упоминается в других популяциях, устойчивых к клещу (например, Fries et al. 12; Mordecai et al. 33; Oddie et al. 37).
Африканизированная медоносная пчела (AHB) — это гибрид между A. m. scutellata из Южной Африки и Восточной Африки и различными европейскими расами, например, A. m. iberiensis и A. m. ligustica. В 1957 году 26 роев A. m. scutellata распространились на север Бразилии от Рио-Кларо, гибридизируясь с европейскими расами и образуя AHB, который достиг США в 1990 году (Winston 58). В 1971 году, во время этой экспансии, в Бразилию прибыл клещ Варроа (Moretto et al. 34) и быстро распространился как среди AHB, так и среди европейских медоносных пчел. Последующее распространение AHB по тропическим и субтропическим регионам Южной Америки было частично обусловлено естественной устойчивостью AHB к Варроа (Rosenkranz 46). Как у AHB (Camazine 8; Medina et al. 27; Mondragon et al. 32), так и у A. m. scutellata (Martin and Kryger 23; Nganso et al. 36) плохое размножение клещей ограничивает рост их популяции, хотя механизм(ы), с помощью которого это происходит, остается неизвестным.
Программы целенаправленного селекционного разведения пчел для борьбы с Варроа продолжаются уже несколько десятилетий как в Америке (Rinderer et al. 45), так и в Европе (Büchler et al. 7). Отбор по таким признакам, как гигиеническое поведение (основанное на удалении убитого запечатанного расплода), используется пчеловодами для сокращения режима обработки от клещей, а линия Varroa Sensitive Hygiene (VSH) (выведенная из линий подавления размножения клещей), направленная на удаление живого расплода, зараженного клещами (например, Harris 16), проходит дальнейший отбор на Гавайях, чтобы сделать ее пригодной для использования в работе пчеловодов. Между тем, популяции, устойчивые к клещам, отобранные естественным путем, поддерживаются без каких-либо мер борьбы с клещами в обширном диапазоне сред, т.е. в Африке, Южной и Центральной Америке.
Недавно в четырех европейских популяциях, устойчивых к клещу, были зарегистрированы низкие темпы размножения клещей, аналогичные тем, которые были обнаружены в Африке и AHB (Oddie et al. 37), что вызвало возможность возникновения аналогичного механизма в этих географически разных популяциях. Затем Одди и др. (38) связали низкое размножение клещей в этих европейских популяциях с высокой распространенностью поведения «повторного закрытия», когда ячейка, содержащая развивающуюся куколку, частично удаляется шелковой/восковой крышечкой рабочими пчелами, а затем снова закрывается воском, без удаления куколки. Хотя повторное запечатывание (даже зараженных клещами ячеек) не является новым явлением, например, как гигиеничные, так и негигиеничные колонии повторно запечатывают около 90% искусственно созданных отверстий в крышечках ячеек (Spivak and Gilliam 51), его важность, возможно, ранее упускалась из виду.
Целью данного исследования было изучить популяции, не подверженные клещам из Шотландии, острова Мэн и Австралии, а также хорошо зарекомендовавшие себя устойчивые к клещам популяции из Бразилии (AHB) и Южной Африки (A. m. scutellata и A. m. capensis), чтобы определить, является ли повторное укупоривание надежным показателем устойчивости к клещам и связано ли оно со снижением размножения клещей. Затем мы сосредоточились на A. m. capensis, у которого, как выяснилось, наблюдался самый высокий уровень целенаправленного повторного укупоривания зараженных клещами клеток.
2 Методы
2.1 Колонии, наивные в отношении варроа-клещей
В течение 2018 года образцы расплода, не зараженного варроа, были получены из трех колоний, каждая с отдельной пасеки, с острова Колонсей, Шотландия, Великобритания, и трех колоний с одной пасеки, принадлежащей Университету Западного Сиднея, кампус Хоксбери, Новый Южный Уэльс, Австралия. Четыре дополнительные колонии, не зараженные варроа, были отобраны в 2019 году с острова Мэн, Великобритания.
2.2 Устойчивые к клещам колонии AHB, Бразилия
Колонии AHB были расположены в Круз-дас-Алмас, штат Баия, северо-восток Бразилии. Повторное укупоривание и размножение клещей изучали в феврале 2018 года, используя шесть колоний (минимум 300 рабочих клеток на колонию). Показатели повторного укупоривания и данные о зараженности клещами были собраны из дополнительных десяти колоний (150-200 рабочих клеток на колонию), которые использовались в испытании по удалению расплода с помощью замораживания.
2.3 Южноафриканские колонии, устойчивые к клещам
Четыре колонии A. m. scutellata были исследованы в июле 2018 года и повторно в марте 2019 года, а 20 колоний A. m. capensis были исследованы в июле 2018 года (n = 3) и в марте 2019 года (n = 17) (Таблицы I и S1). Поскольку только одна колония A. m. scutellata и две колонии A. m. capensis содержали трутней, дополнительно было отобрано десять колоний A. m. capensis с трутневым расплодом. Все колонии содержатся в пределах 20 км от Стелленбоша, Западный Кейп, ЮАР, причем четыре колонии A. m. scutellata были перемещены на 800 км от их естественного распространения в эту область для проведения исследований. Поскольку ни в Бразилии, ни в Южной Африке нет колоний, восприимчивых к клещу, прямое сравнение с обработанными колониями из того же региона невозможно, хотя, поскольку африканские пчелы являются родоначальной популяцией, и устойчивые, и восприимчивые популяции происходят из Африки (Whitfield et al. 57).

2.4 Повторное укупоривание ячеек
Из каждой колонии удаляли одну рамку, содержащую в основном куколок с фиолетовыми глазами (например, 180-190 гпк) или более старый рабочий или трутневый расплод, и в среднем 300 ячеек на колонию (Таблица S1) исследовали на предмет повторного закрытия и размножения клещей. Чтобы определить, была ли ячейка повторно закрыта, тонким пинцетом аккуратно срезали край крышечки, которую затем переворачивали, чтобы рассмотреть нижнюю сторону под бинокулярным микроскопом (× 16). Если шелковый кокон, спряденный в течение первых 30 ч запечатанной стадии (Мартин 19), был частично удален и заменен воском, его классифицировали как повторно укупоренный. Диаметр повторно запечатанной зоны для рабочего расплода оценивался с точностью до мм.
2.5 Размножение клещей в рабочем расплоде
После определения статуса повторного закрытия ячейки, куколок осторожно извлекали и выдерживали в соответствии со стандартными методами (Dietemann et al. 11). Если клетка была заражена, то всех клещей, потомство и сброшенные шкурки (экзувиат) удаляли, а семью клещей реконструировали по методу и схеме развития Мартина (19). В репродуктивных расчетах использовали только 497 зараженных клеток, содержащих куколок с желтым тораксом или старше, т.е. более 190 ч с момента закрытия клетки (Таблица S2). Подсчитывали число спарившихся потомков взрослых самок, то есть клетка должна была содержать живого взрослого самца (о чем свидетельствовал экзувиат), сопровождаемого дочерьми на соответствующей стадии развития. В расплоде трутней определяли только количество подкидышей на ячейку. Для расчета среднего числа спаренных самок, произведенных за один репродуктивный цикл в каждой из трех исследуемых популяций, использовались два метода, поскольку не все образцы находятся на одной и той же стадии развития; следовательно, любая гибель клещей с момента отбора образцов до появления пчел не будет учтена. Поэтому, во-первых, мы подсчитали общее количество спарившихся самок и разделили его на количество инвазированных подкидышей. Во-вторых, мы подсчитали количество самок, которые будут спариваться и, как предполагается, созреют до появления пчел, но учли дальнейшую внутриклеточную смертность в ячейках моложе серых подушечек, умножив первую дочь на 0,94, вторую дочь на 0,38 и третью дочь на 0,13. Эти значения смертности были основаны на исследовании более 1000 семей клещей (Martin 19). Результаты обоих расчетов приведены (Таблица S2) и являются сходными.
2.6 Искусственное заражение клеток A. m. capensis клещами Варроа
Поскольку характер заражения варроа внутри рамок и между рамками неслучаен (Фукс 13), мы изучали способность пчел обнаруживать и удалять зараженных клещами куколок путем искусственного заражения ячеек клещами (Букинг 5; Розенкранц и др. 47), а не сравнивали относительные изменения в уровнях заражения за определенный период времени (Харрис 15). Поэтому 390 материнских клещей, собранных из выводковых ячеек трутней A. m. capensis, содержащих вытянутую личинку, были помещены в рабочие ячейки A. m. capensis, которые находились менее 1 дня после окрыления, на что указывало отсутствие завершенного кокона (Martin 19). Из этих клещей 325 были живыми, а 65 умерли после того, как были собраны в предыдущий день. Мертвые клещи также использовались для экспериментов по искусственному заражению, так как сравнение скорости обнаружения живых и мертвых клещей может помочь определить сигналы, используемые для обнаружения зараженных клеток, например, движение. Из каждой из 11 колоний A. m. capensis в течение нескольких дней удаляли рамки, содержащие ячейки, запечатанные в течение последних 24 ч, о чем свидетельствовали личинки, раскручивающие свои коконы. Свежие запечатанные ячейки открывали, и материнский клещ вставлялся в них с помощью тонкой кисточки, после чего ячейку снова запечатывали и записывали ее положение на ацетатном листе. После возвращения рамок в колонии, осмотр через 24 часа выявил все ячейки, удаленные пчелами в результате манипуляций. Через пять дней (6 дней после укупорки) регистрировали количество куколок, извлеченных из искусственно зараженных ячеек. Через 10 дней (11 дней после укупорки) каждую рамку вынимали, все оставшиеся искусственно зараженные ячейки осматривали на наличие клещей и регистрировали состояние крышечки ячейки (т.е. повторно укупоренная или нет) (табл. S3). Мы также проверили состояние крышечки аналогичного количества соседних незараженных контрольных клеток. Для проведения экспериментов по искусственному заражению в AHB имелось недостаточное количество клещей.
2.7 Тест на гигиеническое поведение с использованием замороженного расплода.
В десяти колониях AHB и 11 колониях A. m. capensis изучали их способность удалять убитых заморозкой куколок (классическое гигиеническое поведение) для сравнения с показателями повторного укупоривания. Участок с пурпурноглазыми куколками или старше (> 7 дней после укупорки) замораживали жидким азотом, а затем определяли количество удаленных куколок через 24 и 48 часов (Таблица S3). Данные за 48 часов не анализировались, так как несколько колоний в обеих популяциях к 48 часам вывели 100% убитого расплода.
2.8 Анализ данных
Все наборы данных были распределены ненормально, поэтому статистические тесты включали критерий хи-квадрат, Колмогорова-Симирнова, Манна-Уитли, Вилкоксона и ранговую корреляцию Спирмена. Статистика теста указывает, какой тест был использован, если он не указан в тексте.
3 Результаты
3.1 Повторное заселение клеток и репродуктивное поведение клещей в рабочих клетках
На основе 497 зараженных клеток мы подтвердили, что среднее число спаренных самок, произведенных на одну мать-найденыша в течение одного репродуктивного цикла (Wr), составляло от 0,8 до 0,9 в трех популяциях, устойчивых к клещам (Таблица I, Таблица S2), причем только 54-55% вторгшихся матерей размножались и производили от 1 до 3 спаренных самок каждая. В десяти колониях, не зараженных варроа, из трех разных популяций, только 0,5% (медиана) рабочих запечатанных расплодных ячеек были повторно запечатаны (Таблица I, Таблица S1, Рисунок S1). В отличие от этого, средние показатели повторного заселения в устойчивых к варроа AHB, A. m. scutellata и A. m. capensis составляли 35%, 20% и 27%, соответственно, хотя средний уровень заражения был < 10% в каждой устойчивой к клещу популяции. Скорость повторного укупоривания зараженных клеток всегда была значительно выше, чем незараженных (AHB U = 17, z = 2,46, p = 0,014; A. m. scutellata U = 0, z = 3,31, p < 0,001; и A. m. capensis U = 10,5, z = 4,41, p < 0,0001) (Таблица S1, Рисунок S1). Объединив данные по трем популяциям, мы обнаружили, что расчетное число жизнеспособного потомства в повторно закрытых (0,82) и ненарушенных (0,76) клетках было сходным (Таблица S2). Частотное распределение размера повторно закрытой области (диаметр отверстия, которое было повторно закрыто) в незараженных клетках во всех четырех популяциях имело одинаковую отрицательную тенденцию (рис. 1a-d). Напротив, у зараженных клеток распределение по размерам значительно отличалось (AHB, D = 0,2051, p = 0,002; A. m. scutellata D = 0,3406, p < 0,0001 и A. m. capensis, D = 1, p = 0,037), поскольку площадь повторного закрытия была больше, т.е. больше 3 мм, если клетка была заражена во всех трех популяциях (Рисунок 1e, f). Более того, все повторно заселенные клетки в популяциях, не зараженных варроа, были маленькими — от 1 до 3 мм. Зараженные клетки появлялись на ранних стадиях развития куколок, и их доля постоянно увеличивалась по мере развития куколок (Рисунок 1h). Мы заметили, что некоторые зараженные клетки были повторно закрыты более одного раза, так как они содержали два или три отчетливых отверстия, вырезанных в шелковой крышке.
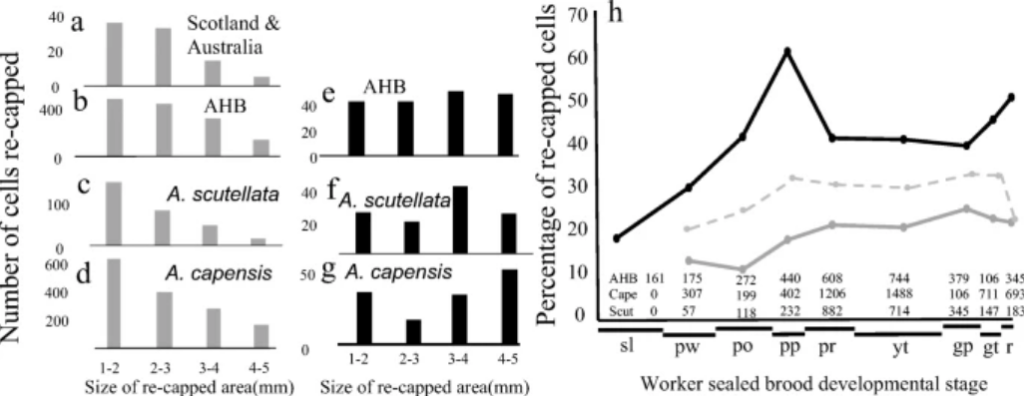
3.2 Повторное закрытие ячеек и зараженность клещей в трутневых ячейках A.m. capensis
Средний уровень зараженности трутневого расплода составил 31 ± 27% (Таблица I; S1), при этом в ячейках обычно присутствовало несколько найденышей. В общей сложности 330 зараженных ячеек (одиночные и множественные зараженные ячейки) были заселены 569 клещами-находками. Этот показатель значительно варьировал в зависимости от участка; только 5 ± 9% трутневых клеток были повторно заселены в девяти колониях в районе Стелленбош (Таблица S1-R* колонии), тогда как три колонии из района Пниэль (Таблица S1-PA* колонии) в соседней долине повторно заселили 65% всех трутневых клеток. Однако доля зараженных (66%) и незараженных (65%) клеток, повторно заселенных трутнями, была одинаковой. Таким образом, не было выявлено закономерности нацеливания на зараженные клещами клетки трутней (Таблица I; Рисунок S1). Одиночная рамка трутня из A. m. scutellata показала такую же картину: высокая степень заражения (57%), низкий уровень повторного укупоривания (2%) и множество находок в клетках (Таблицы I и S1).
3.3 Обнаружение и удаление искусственно зараженных клещами клеток у A. m. capensis
Из 392 рабочих куколок A. m. capensis, искусственно зараженных клещами (326 живых и 66 мертвых), только 3% были удалены в течение 24 ч, скорее всего, из-за экспериментального вскрытия и повторного запечатывания клетки (манипуляции). Через 10 дней мы обнаружили 21 (5%) клетку без клещей или со следами клещей, т.е. с фекалиями клещей на стенке клетки, которые, должно быть, улетучились во время процесса откупоривания/перезакупоривания, а еще 30 (8%) клещей впечатались в стенку клетки и погибли во время прядения куколочного кокона. Клещи, погибшие в результате манипуляций, процесса повторного укупоривания или запечатывания в стенке клетки, были удалены до анализа поведения при удалении. В 11 колониях через шесть дней было удалено 32% зараженных клеток, а через 10 дней этот показатель увеличился до 54% (Таблица S3). Процент мертвых (47%) и живых (46%) клещей, удаленных через 10 дней, существенно не отличался (U = 49,5, p = 0,75). Из оставшихся 152 искусственно зараженных клеток 83% были повторно укупорены, в то время как только 27% свободных от клещей «контрольных» клеток были повторно укупорены (Таблица S3). Опять же, как правило, в зараженных клетках были обнаружены более крупные повторно запечатанные области по сравнению с соседними незараженными контрольными клетками (Рисунок 2); однако не было обнаружено существенных различий в размерах повторно запечатанных областей как между незараженными контрольными клетками и клетками, содержащими мертвых клещей, застрявших в стенках, так и между зараженными клетками, содержащими живых или мертвых клещей (Рисунок 2).

3.4 Тест на гигиеническое поведение с использованием замороженного расплода
Среди десяти колоний AHB, протестированных на классическое гигиеническое поведение и поведение повторного укупоривания, ранговая корреляция Спирмена не выявила значительной корреляции (rs = 0,03, p = 0,93) между двумя видами поведения через 24 часа (Таблица S3), при этом 19-98% мертвого расплода было удалено за 24 часа, в то время как показатели повторного укупоривания колебались в пределах 4-50%. Аналогичный результат (rs = 0,356, p = 0,282) был также обнаружен в 11 колониях A. m. capensis (Таблица S3), где 48-100% убитого заморозкой расплода было удалено, а диапазон показателей повторного укупоривания составил 12-66%. Однако наблюдалась слабо выраженная положительная корреляция (rs = 0,67, p = 0,024) между скоростью удаления убитого замораживанием расплода и долей удаленных искусственно зараженных клеток (Таблица S3).
4 Обсуждение
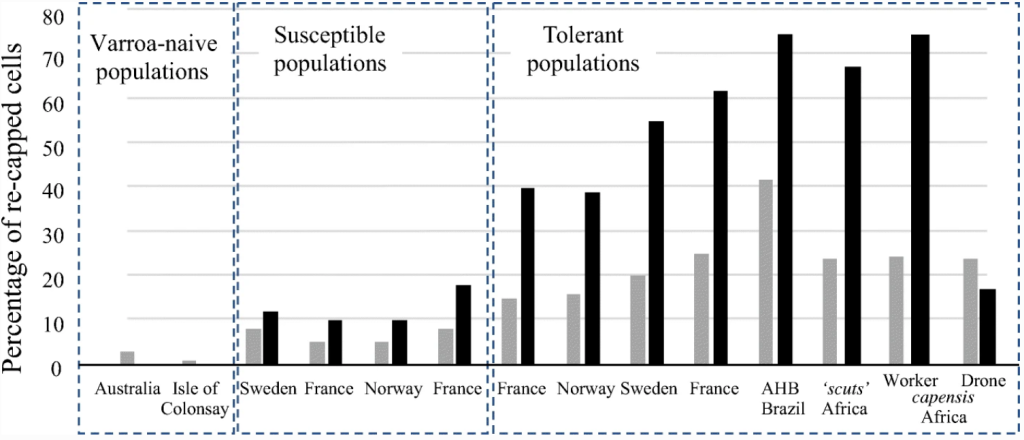
Хотя мы наблюдали повторное закрытие ячеек расплода во всех колониях, показатели повторного закрытия были самыми низкими в колониях, не зараженных варроа, и самыми высокими в рабочих расплодах устойчивых к клещу популяций из Бразилии (AHB) и Южной Африки (A. m. scutellata и A. m. capensis), а также Европы (Oddie et al. 38). Ключевым поведением во всех этих устойчивых к клещу популяциях, по-видимому, является способность пчел обнаруживать зараженные клещом ячейки, на что указывают постоянно более высокие показатели повторного укупоривания зараженных ячеек по сравнению с незараженными, особенно учитывая, что уровень заражения обычно ниже 10% (Рисунок 3; Рисунок S1). Первоначальное обнаружение возможной зараженной клетки приводит к открытию небольшого отверстия в крышке клетки, которое может обеспечить лучший доступ к любым летучим или нелетучим сигналам, т.е. к куколкам, внутри запечатанной клетки (см. ниже). Если незараженную ячейку открывают по ошибке, отверстие снова закрывают, и нарушенная область остается небольшой (1-2 мм), но если она заражена, отверстие увеличивают до 3-4 мм, чтобы получить лучший доступ (рис. 1). Второй триггер, или его отсутствие, приводит к тому, что зараженная клетка либо заново закрывается, либо куколка каннибализируется (рис. 4). Эта идея согласуется с предыдущими исследованиями (Gramacho 14; Arathi et al. 3), которые показали, что начальный этап обнаружения больного расплода не обязательно приводит к удалению расплода, а повторные откупоривания и перезакупоривания предшествуют удалению расплода. Удаление куколок, искусственно зараженных клещами, составило 54% у A. m. capensis (данное исследование), 33% у A. m. scutellata (Cheruiyot et al. 9), 10-25% у AHB (Aumeier et al. 4) и до 40% в одной устойчивой к клещам популяции в Нидерландах (Panziera et al. 40). Все значения намного ниже 99% удаления искусственно зараженных рабочих клеток в исходном хозяине клеща, A. cerana (Rath and Drescher 44).

Два недавних исследования предположили, что генетически обусловленные факторы хозяина в выводке препятствуют инициации оогенеза клещей, что объясняет увеличение количества невоспроизводящихся клещей в устойчивых колониях. Например, Broeckx и др. (6) предположили, что феромоны выводка падают до уровня, который препятствует размножению клещей, а Conlon и др. (10) предположили, что ген экдизона связан с устойчивостью к клещам, поскольку низкий уровень экдизона может препятствовать оогенезу клещей, следовательно, увеличивая невоспроизводство клещей. Однако большая доля нерепродуцирующих клещей, обнаруженная в устойчивых к клещам колониях (Martin et al. 25; Broeckx et al. 6), может быть просто объяснена поведенческой особенностью, заключающейся в усиленном нарушении размножения клещей. То есть удаление зараженных куколок снижает количество успешных репродуктивных циклов клещей, увеличивая долю нерепродуктивных клещей в последующих репродуктивных попытках. Последнее может частично объяснять более низкие репродуктивные показатели (Wr), обнаруженные в колониях, устойчивых к клещам, поскольку при постоянном 50% удалении 12,5-25% клещей никогда не размножатся из-за того, что были нарушены удалением куколок перед спариванием. Поскольку количество репродуктивных циклов клещей оценивается от 2 до 3 (Martin and Kemp 22), эти клещи могут все еще вторгаться в клетки и пытаться размножаться, но производить либо никакого потомства, либо только самцов (Martin et al. 25), обе категории распространены в Африке (Martin and Kryger 23), AHB (Medina et al. 27) и в данном исследовании. Это также объясняет, почему размножающихся и не размножающихся клещей невозможно отличить с помощью микросателлитов ДНК (Broeckx et al. 6), поскольку они не представляют два разных генотипа, а просто у не размножающихся клещей закончились либо сперматозоиды, либо яйца.
В данном исследовании репродуктивность клещей в повторно закрытых и ненарушенных зараженных клетках была сходной (Таблица S2), что также было обнаружено в предыдущих исследованиях (Harris et al. 17; Oddie et al. 38). Mondet и др. (30) и Oddie и др. (38) предположили, что пчелы чаще игнорируют ячейки, содержащие нерепродуцирующих клещей (смещение отбора), в то время как преимущественно удаляют ячейки, содержащие репродуцирующих клещей или с большим количеством потомства. Однако мы не нашли никаких доказательств этому у A. m. capensis, поскольку скорость удаления клеток с живыми (размножающимися) и мертвыми (не размножающимися) клещами была одинаковой, и Панзиера и др. (40) также не обнаружили связи между репродуктивным успехом клещей и удалением расплода.
Как у AHB (Мондрагон и др. 32), так и у африканских медоносных пчел (A. m. capensis и A. m. scutellata) (Таблицы I и S1) трутневый расплод часто сильно заражается, что может повлиять на репродуктивный успех колонии медоносных пчел и популяции. Это может привести к плотностно-зависимому контролю популяции клещей через трутневый расплод (Мартин и Медина 24), что происходит в A. cerana, либо через снижение выживаемости потомства клещей в многократно зараженном расплоде (Мартин 20), либо через увеличение неудач при выходе пчел (Rath 43). Недавние исследования показали, что кормление клещей вызывает гибель рабочего расплода A. cerana (Page et al. 39) через впрыскивание токсичного белка слюны клеща в куколок во время кормления (Zhang and Han 59), что может объяснить высокие показатели удаления, наблюдавшиеся ранее (Rath 43). Однако этот слюнный белок не оказывает никакого влияния на куколок A. mellifera (Zhang and Han 59).
Поскольку только около 27% (Рис. 3) незараженных рабочих клеток повторно закрываются крышкой, это говорит о том, что первоначальное обнаружение клеща происходит без нарушения крышки. Хотя способность обнаруживать зараженные клещом клетки высока почти во всех колониях, устойчивых к клещу (Рисунок S1 и Oddie et al. 38), именно триггер для удаления зараженной куколки остается подверженным ошибкам, поскольку только около 50% зараженных клеток, которые открываются, впоследствии удаляются у A. mellifera, и большая часть этих клеток закрывается повторно. Триггеры для первоначального обнаружения и последующего решения каннибализировать куколок в настоящее время неизвестны (рис. 4), хотя данное исследование показывает, что обоняние может быть ключевым фактором для первоначального обнаружения, как было предложено в нескольких предыдущих исследованиях (например, Rosenkranz et al. 47; Mondet et al. 29; Scannapieco et al. 49), поскольку мертвые клещи вызывают такое же поведение повторного укупоривания, как и живые клещи, о чем также сообщалось у A. cerana (Rath and Drescher 44). Это предполагает, что движение или связанные с ним изменения в куколке (запах или температура) могут не иметь значения, как ранее предполагали Аумайер и Розенкранц (3) и Вагонер с соавторами (54). Уровень олеиновой кислоты, которая, как известно, вызывает гигиеническое поведение (McAfee et al. 26), также не имеет значения, если только она не вырабатывается живыми клещами. Более того, поскольку клещи, запечатанные в клеточной стенке кукольного кокона, не вызывали повышенной реакции повторного укупоривания по сравнению с незараженными клетками (Рисунок 2), вероятным кандидатом является летучий запах. Например, Нацци и др. (35) обнаружили, что пентадекан (C15H30) присутствовал только в воздухе зараженных клеток, а применение Z-(6)-пентадецена увеличивало гигиеническое поведение, тогда как Z-(7)-пентадецен, Z-(8)-гептадецен и пентадекан не оказывали никакого эффекта. Более длинные кутикулярные углеводороды вряд ли могут быть запаховым сигналом из-за их недостаточной летучести, а профиль куколки точно имитируется клещом (Kather et al. 18). Rath и Drescher (44) также обнаружили, что мертвые клещи, промытые в этаноле, по-прежнему удаляются с высокой скоростью у A. cerana. Однако Вагонер и др. (55) предположили, что два длинных кутикулярных углеводорода (гептакозен [C27H54] и тритриаконтан [C33H66]), удаленные с поверхности куколки, были связаны с откреплением зараженного рабочего расплода. Кроме того, Mondet и др. (30) предположили, что изменения в феромоне расплода, состоящем из десяти этиловых и метиловых эфиров, могут быть обнаружены между зараженным и незараженным расплодом, хотя это было обнаружено с помощью дискриминантного анализа, который подвержен ошибкам, если отношение образца к переменной не велико (Martin и Drijfhout 21; Mitteroecker и Bookstein 28 [Рисунок 5]).
Почему поведение повторного укупоривания существует даже в популяциях, не зараженных варроа, неизвестно, но когда не зараженный расплод не удаляется, любые затраты на приспособленность колонии минимальны. Мы наблюдали, как в расплоде африканских медоносных пчел, зараженном малой восковой молью (Achroia grisella), ячейки часто заново закрывались, а не удалялись куколки. Аналогично, 57% незакрытых ячеек в колонии, сильно зараженной большой восковой молью (Galleria mellonella), были повторно закрыты в течение 24 часов после снятия крышечки (Villegas and Villa 53). Интересно, что три колонии A. m. capensis в Пниэле были уникальны тем, что в них было повторно закрыто большое количество трутней. Все они были колониями, выжившими после вспышки американского фолбруда (Paenibacillus larvae). Поэтому проделывание небольшого отверстия в крышке ячейки может быть общей реакцией, позволяющей более детально исследовать развивающуюся куколку (что может объяснить низкий уровень присутствия этого признака в популяциях, не подверженных варроа). После появления клещей, это поведение, по-видимому, было кооптировано и выбрано как часть защитного механизма против Варроа; следовательно, частота повторного закрытия ячеек повышена во всех зараженных колониях (рис. 3 и S1), достигая самых высоких уровней в колониях, устойчивых к клещам. Во всей Бразилии и Африке борьба с вредителями в пчеловодстве минимальна, поэтому селективное давление на такие признаки всегда было высоким. Постоянная борьба с широким спектром расплодных вредителей и патогенов в Северном полушарии снимает значительную часть этого селективного давления. В этом и предыдущих исследованиях (Oddie et al. 38) способность обнаруживать клещей (Рисунок S1) и удалять зараженный расплод (Таблица S3) сильно различается. Несомненно, состав колонии играет определенную роль, так как повторное заклещевание чаще всего происходило в смешанных колониях, а не в высокогигиеничных или высоконегигиеничных колониях (Arathi et al. 2).
Мондрагон и др. (31) предположили, что гигиеническое поведение по отношению к убитому заморозками расплоду может не коррелировать с гигиеническим поведением по отношению к клещам Варроа. Мы не обнаружили корреляции между уровнями повторного укупоривания и удаления расплода, убитого заморозкой. Однако мы обнаружили слабую положительную корреляцию между способностью колонии удалять расплод, уничтоженный заморозкой, и удалением искусственных клеток, зараженных клещами, что похоже на данные Спивака (50), где колонии, отобранные по способности удалять расплод, уничтоженный заморозкой, удалили значительно больше искусственных клеток, зараженных клещами, чем «негигиеничные» колонии в один год, но не в другой. Перес и Джонсон (41) указывают на то, что специализация в выполнении задач, например, гигиеническое поведение, может быть использована для прогнозирования специализации в других смежных задачах, что может помочь объяснить слабую связь между реакцией на убитый заморозкой расплод и удалением живого расплода, зараженного клещами.
Похоже, что устойчивость к клещам Varroa у A. cerana и A. mellifera идет по схожему пути, направленному на клещей, заселяющих рабочие клетки, а не трутневые, что в конечном итоге приведет к комбинированному эффекту снижения репродуктивного успеха клещей в рабочем расплоде и зависящего от плотности контроля в трутневом расплоде. Поскольку способность пчел обнаруживать клещей в рабочих ячейках, о чем свидетельствует увеличение повторного закрытия, возникла естественным образом у A. mellifera в пяти разных странах, это может оказаться отличным показателем устойчивости к клещам. Проблема будет заключаться в отборе по этим признакам (способности первоначально обнаруживать и впоследствии удалять зараженных куколок) при переходе от режима использования инсектицидов, особенно в крупных коммерческих пчеловодческих хозяйствах.
Электронный дополнительный материал
Ссылки:
1.Allsopp, M. H. (2006) Analysis of Varroa destructor infestation of southern African honey bee populations. MSc dissertation. University of Pretoria, Pretoria, South Africa.
Google Scholar
2.Arathi, H. S., Ho, G., Spivak, M. (2006) Inefficient task partitioning among nonhygienic honeybees, Apis mellifera L., and implications for disease transmission. Anim. Behav. 72, 431–438
Google Scholar
3.Aumeier, P., Rosenkranz, P. (2001) Scent or movement of Varroa destructor mites does not elicit hygienic behavior by Africanized and Carniolan honey bees. Apidologie 32, 253–263
4.Aumeier, P., Rosenkranz P., Goncalves, L. S. (2000) A comparison of the hygienic response of Africanized and European (Apis mellifera carnica) honey bees to Varroa-infested brood in tropical Brazil. Genet. Mol. Biol. 23, 4.
https://doi.org/10.1590/S1415-47572000000400013
Article Google Scholar
5.Boecking, O. (1992) Removal behavior of Apis mellifera colonies towards sealed brood cells infested with Varroa jacobsoni: techniques, extent and efficacy. Apidologie 23, 371–373
Google Scholar
6.Broeckx, B. J. G., De Smet, L., Blacquière, T., Maebe, K., Khalenkow, M., Van Poucke, M., et al. (2019) Honey bee predisposition of resistance to ubiquitous mite infestations. Sci. Rep. 9, 7794
PubMed PubMed Central Google Scholar
7.Büchler, R., Berg, S., Le Conte, Y. (2010) Breeding for resistance to Varroa destructor in Europe. Apidologie, 41, 393–408
Google Scholar
8.Camazine, S. (1986) Differential Reproduction of the Mite, Varroa jacobsoni (Mesostigmata: Varroidae), on Africanized and European Honey bees (Hymenoptera: Apidae). Annls. Entomol. Soc. Am. 79, 801–803
Google Scholar
9.Cheruiyot, S. K., Lattorff, H. M. G., Kahuthia-Gathu, R., Mbugi, J. P., Muli, E. (2018) Varroa-specific hygienic behavior of Apis mellifera scutella in Kenya. Apidologie, 49, 439–449
CAS Google Scholar
10.Conlon, B. H., Aurori, A., Giurgiu, A.-I., Kefuss, J., Dezmirean, D. S., Moritz, R. F. A., Routtu, J. (2019) A gene for resistance to the Varroa mite (Acari) in honey bee (Apis mellifera ) pupae. Mol. Ecol. (online first) https://doi.org/10.1111/mec.15080
11.Dietemann, V., Nazzi, F., Martin, S. J., Anderson, D., Locke, B. et al. (2013) Standard methods for Varroa research. In V. Dietemann; J. D. Ellis; P. Neumann (Eds) The COLOSS BEEBOOK, Volume II, standard methods for Apis mellifera pest and pathogen research. J. Apic. Res. 51, 1-54
Google Scholar
12.Fries, I., Imdorf, A., Rosenkranz, P. (2006) Survival of mite infested (Varroa destructor) honey bee (Apis mellifera) colonies in a Nordic climate. Apidologie, 37, 564–570
Google Scholar
13.Fuchs, S. (1989) The distribution of Varroa jacobsoni on honey bee brood combs and within brood cells as a consequence of fluctuating infestation rates. In: European Research on Varroatosis Control (Cavalloro R, ed), Balkema Rotterdam.
14.Gramacho, K. P. (1999) Fatores que interferem no comportamento higiênico das abelhas Apis mellifera. Ph.D. thesis, Faculdade de Filosofia, Ciênciase Letrasde Ribeirao Preto, Universidadede Sao Paulo, Brasil.
15.Harris, J. W. (2007) Bees with varroa sensitive hygiene preferentially remove mite infested pupae aged less than five days post capping. Bee World 46, 134-139
Google Scholar
16.Harris, J. W. (2008) Effect of brood type on Varroa-sensitive hygiene by worker honey bees (Hymenoptera: Apidae). Annls. Entomol. Soc. Am. 101, 1137-1144
Google Scholar
17.Harris, J. W., Danka, R. G., Villa, J. D. (2012) Changes in Infestation, Cell Cap Condition, and Reproductive Status of Varroa destructor (Mesostigmata: Varroidae) in Brood Exposed to Honey bees with Varroa Sensitive Hygiene. Annls. Entomol. Soc. Am. 105, 512-518.
Google Scholar
18.Kather, R., Drijfhout, F. P., Shemilt, S., Martin S. J. (2015) Evidence for Passive Chemical Camouflage in the Parasitic Mite Varroa destructor. J. Chem. Ecol. 41, 178-186
CAS PubMed Google Scholar
19.Martin, S. J. (1994) Ontogenesis of the mite Varroa jacobsoni Oud. in worker brood of the honey bee Apis mellifera L. under natural conditions. Exp. Appl. Acarol. 18, 87-100
Google Scholar
20.Martin, S. J. (1995) Reproduction of Varroa jacobsoni in cells of Apis mellifera containing one or more mother mites and the distribution of these cells, J. Apicul. Res. 34, 187-196
Google Scholar
21.Martin, S. J., Drijfhout, F. P. (2009) How reliable is the analysis of complex cuticular hydrocarbon profiles by multi-variate statistical methods? J. Chem. Ecol. 35, 375–382.
CAS PubMed Google Scholar
22.Martin, S. J., Kemp, D. (1997) Average number of reproductive cycles performed by the parasitic mite Varroa jacobsoni in Apis mellifera colonies. J. Apicul. Res. 36, 113-123
Google Scholar
23.Martin, S. J., Kryger, P. (2002) Reproduction of Varroa destructor in South African honey bees, does cell space influence Varroa male survivorship? Apidologie 33, 51-61
Google Scholar
24.Martin, S. J., Medina, L. M. (2004) Africanized honey bees possess unique tolerance to Varroa mites. Trends Parasitol. 20, 112-114
PubMed Google Scholar
25.Martin, S. J., Holland, K., Murray, M. (1997) Non-reproduction in the honeybee mite Varroa jacobsoni. Exp. Appl. Acarol. 21, 539-549
Google Scholar
26.McAfee, A., Chapman, A., Iovinella, I., Gallagher-Kurtzke, Y., Collins, T. F., Higo, H., Madilao, L. L., Pelosi, P., Foster, L. J. (2018) A death pheromone, oleic acid, triggers hygienic behavior in honey bees (Apis mellifera L.). Sci. Rep. 8, 5719
PubMed PubMed Central Google Scholar
27.Medina, M. L., Martin, S. J., Montaño, L., Ratnieks, F. L. W. (2002) Reproduction of Varroa destructor in worker brood of Africanized honey bee (Apis mellifera). Exp. Appl. Acarol. 27, 79-88
PubMed Google Scholar
28.Mitteroecker, P., Bookstein F. (2011) Linear Discrimination, Ordination, and the Visualization of Selection Gradients in Modern Morphometrics. Evol. Biol. 38, 100-114
Google Scholar
29.Mondet, F., Alaux, C., Severac, D., Rohmer, M., Mercer, A. R., Le Conte, Y. (2015) Antennae hold a key to Varroa-sensitive hygiene behaviour in honey bees. Sci. Rep. 5,10454
PubMed PubMed Central Google Scholar
30.Mondet, F., Kim, S. H., de Miranda, J. R., Beslay, D., Le Conte, Y., Mercer, A. R. (2016) Specific Cues Associated With Honey Bee Social Defence against Varroa destructor Infested Brood. Sci. Rep. 6, 25444
CAS PubMed PubMed Central Google Scholar
31.Mondragon, L., Spivak, M., Vandame R. (2005) A multifactorial study of the resistance of honey bees Apis mellifera to the mite Varroa destructor over one year in Mexico. Apidologie 36, 345–358
Google Scholar
32.Mondragon, M., Martin, S. J., Vandame, R. (2006) Mortality of mite offspring, a major component of Varroa destructor resistance in Africanized honey bees. Apidologie 37, 67-74
Google Scholar
33.Mordecai, G. J., Brettell, L., Martin, S. J., Dixon, D., Jones, I. M., Schroeder, D. C. (2016). Superinfection exclusion and the long-term survival honey bees in Varroa-infested colonies. ISEM J 10, 1182-1191
CAS Google Scholar
34.Moretto, G., Gonçalves, L. S., De Jong, D., Bichuette, M. Z. (1991) The effects of climate and bee race on Varroa jacobsoni Oud infestations in Brazil. Apidologie 22, 197-203
Google Scholar
35.Nazzi, F., Della Vedova, G., D’Agaro, M. (2004). A semiochemical from brood cells infested by Varroa destructor triggers hygienic behaviour in Apis mellifera. Apidologie, 35, 65–70
CAS Google Scholar
36.Nganso, B. T., Fombong, A. T., Yusuf, A. A., Pirk, C. W. W. (2018). Low fertility, fecundity and numbers of mated female offspring explain the lower reproductive success of the parasitic mite Varroa destructor in African honey bees. Parasitology 145, 1633-1639
PubMed Google Scholar
37.Oddie, M., Dahle, B., Neumann, P. (2017) Norwegian honey bees surviving Varroa destructor mite infestations by means of natural selection. PeerJ 5, e3956. https://doi.org/10.7717/peerj.3956
38.Oddie, M. A. Y., Büchler, R., Dahle, B., Kovacic, M., Le Conte, Locke, B., de Miranda, J., Mondet, F., Neumann, P. (2018). Rapid parallel evolution overcomes global honey bee parasite. Sci. Rep. 8, 7704
PubMed PubMed Central Google Scholar
39.Page, P., Lin, Z., Buawangpong, N., Zheng, H., Hu, F., Neumann, P., et al. (2016). Social apoptosis in honey bee superorganisms. Sci. Rep. 6, 27210
CAS PubMed PubMed Central Google Scholar
40.Panziera, D., van Langevelde, F., Blacquière, T. (2017) Varroa sensitive hygiene contributes to naturally selected varroa resistance in honey bees. J. Apic. Res. 56, 635–642
Google Scholar
41.Perez, A. A., Johnson, B. R. (2019) Task repertoires of hygienic workers reveal a link between specialized necrophoric behaviors in honey bees. Behav. Ecol. Sociobiol. 73, 123
Google Scholar
42.Pirk, C. W. W., Strauss, U., Yusuf, A. A., Démares, F., Human, H. (2015) Honey bee health in Africa—a review. Apidologie, 47, 276–300. https://doi.org/10.1007/s13592-015-0406-6
Article Google Scholar
43.Rath, W. (1999) Co-adaptation of Apis cerana Fabr. and Varroa jacobsoni Oud. Apidologie, 30, 97–110. https://doi.org/10.1051/apido:19990202
Article Google Scholar
44.Rath, W., Drescher W. (1990) Response of Apis cerana Fabr. towards brood infested with Varroa jacobsoni Oud. and infestation rate of colonies in Thailand, Apidologie 21, 311-321
Google Scholar
45.Rinderer, T. E., Harris, J. W., Hunt, G. J., de Guzman, L. I. (2010) Breeding for resistance to Varroa destructor in North America. Apidologie, 41, 409–424
Google Scholar
46.Rosenkranz, P. (1999) Honey bee (Apis mellifera L.) resistance to Varroa jacobsoni Oud. in South America. Apidologie 30,159-172
Google Scholar
47.Rosenkranz, P., Tewarson, N. C., Singh, A., Engels, W. (1993) Differential hygienic behaviour towards Varroa jacobsoni in capped worker brood of Apis cerana depends on alien scent adhering to the mites. J. Apicul. Res. 32, 89–93. https://doi.org/10.1080/00218839.1993.11101292
Article Google Scholar
48.Rosenkranz, P., Aumeier, P., Ziegelmann, B. (2010). Biology and control of Varroa destructor. J. Invert. Pathol. 103, S96–S119
Google Scholar
49.Scannapieco, A. C., Mannino, M. C., Soto, G., Palacio, M. A., Cladera, J. L., Lanzavecchia, S. B. et al. (2017) Expression analysis of genes putatively associated with hygienic behavior in selected stocks of Apis mellifera L. from Argentina. Insectes Soc. 64, 485–494
Google Scholar
50.Spivak, M. (1996) Honey bee hygienic behavior and defense against Varroa jacobsoni, Apidologie 27, 245–260
Google Scholar
51.Spivak, M., Gilliam, M. (1993) Facultative expression of hygienic behaviour of honey bees in relation to disease resistance. J. Apic. Res. 32, 147–157
Google Scholar
52.Thompson, J. N. (1998) Rapid evolution as an ecological process. Trends Ecol. Evol. 13, 329-332
CAS PubMed Google Scholar
53.Villegas, A. J., Villa, J. D. (2006) Uncapping of pupal cells by European bees in the United States as responses to Varroa destructor and Galleria mellonella. J. Apic. Res. 45, 203–206
Google Scholar
54.Wagoner, K. M., Spivak, M., Rueppell, O. (2018) Brood Affects Hygienic Behavior in the Honey Bee (Hymenoptera: Apidae). J. Eco. Entomol. 111, 2520–2530
CAS Google Scholar
55.Wagoner, K., Spivak, M., Hefetz, A., Reams, T., Rueppell, O. (2019) Stock-specific chemical brood signals are induced by Varroa and Deformed Wing Virus, and elicit hygienic response in the honey bee. Sci. Rep. 9, 8753
CAS PubMed PubMed Central Google Scholar
56.Wenner, A.M., Thorp, R. W., Barthell, J. F. (2009) Biological control and Eradication of Feral Honey bee colonies on Santa Cruz Island, California: A Summary. Pages 327–335 in Damiani, C.C. and D.K. Garcelon (eds.) pp. 327-335. Proceedings of the 7th California Islands Symposium. Institute for Wildlife Studies, Arcata, C. A.
Google Scholar
57.Whitfield, C. W., Behura, S. K., Berlocher, S. H., Clark, A. G., Johnston, J. S. et al. (2006) Thrice Out of Africa: Ancient and Recent Expansions of the Honey Bee, Apis mellifera. Science, 314, 642–645
CAS PubMed Google Scholar
58.Winston, M. L. (1992) The biology and management of Africanized honey bees. Annu. Rev. Entomol. 37, 173-93
Google Scholar
59.Zhang, Y., Han, R. (2018) A Saliva Protein of Varroa Mites Contributes to the Toxicity toward Apis cerana and the DWV Elevation in A. mellifera. Sci. Rep. 8, 3387
PubMed PubMed Central Google Scholar

Добавить комментарий