Простое резюме
Различные негативные факторы способствуют сокращению численности насекомых-опылителей. Целью данного исследования было оценить влияние коммерческого пробиотика EM® PROBIOTIC FOR BEES на медоносных пчел. Исследование проводилось в полевых и лабораторных контролируемых условиях. В полевых условиях сахарный сироп с 10% пробиотика вводился путем опрыскивания или кормления колоний медоносных пчел для оценки силы колоний и уровня заражения Nosema spp. В лаборатории взрослых рабочих особей кормили сахарным сиропом с добавлением 2,5, 5 и 10% EM® для пчел для биохимического и иммунологического анализа гемолимфы, а также 5 и 10% для измерения размера гипофарингеальных желез. Было установлено, что после применения ЭМ® для пчел количество спор Nosema spp. в колониях значительно снизилось, а сила колоний увеличилась. Результаты на индивидуальном уровне показали положительные физиологические изменения в обработанных группах взрослых пчел, но, в то же время, более высокий уровень смертности. Полученные нами результаты свидетельствуют о том, что ЭМ® для пчел является перспективной пищевой добавкой для борьбы с ноземозом. Поэтому необходимо уделить дополнительное внимание исследованиям, изучающим требования к питанию, необходимые для улучшения и поддержания здоровья колоний медоносных пчел.
Аннотация
Несколько негативных факторов способствуют снижению численности насекомых-опылителей. В качестве нового подхода в терапии мы предположили, что EM® для пчел потенциально может оказать важное терапевтическое и иммуномодулирующее действие на колонии медоносных пчел. Целью нашего исследования было оценить его воздействие на медоносных пчел на индивидуальном уровне и на уровне колонии. Это первое применение коммерческой пробиотической смеси EM® PROBIOTIC FOR BEES на медоносных пчелах как экономически важных социальных насекомых. Сахарный сироп с 10% пробиотика вводили путем опрыскивания или кормления колоний медоносных пчел в полевых условиях, чтобы оценить уровень заражения спорами Nosema spp. и силу колоний. Кроме того, в лабораторных условиях в клетках-хранилищах взрослых рабочих особей кормили сахарным сиропом с добавлением 2,5, 5 и 10% ЭМ® для пчел для биохимического и иммунологического анализа гемолимфы, а также 5 и 10% для измерения размера гипофарингеальных желез. Было установлено, что после применения ЭМ® для пчел количество спор Nosema spp. в колониях значительно снизилось, а сила колоний увеличилась. Результаты на индивидуальном уровне показали значительные положительные физиологические изменения в обработанных группах взрослых пчел, выявив в то же время более высокий уровень смертности при кормлении сахарным сиропом с добавлением пробиотика.
1.Введение
В последние годы во всем мире отмечается тревожное сокращение численности насекомых-опылителей [1,2,3]. Медоносные пчелы, среди них, вероятно, являются наиболее важными видами с экологической и экономической точек зрения [4]. Опыление медоносными пчелами стало важнейшим компонентом сельскохозяйственной технологии [5,6]. Предполагается, что несколько факторов окружающей среды оказывают негативное влияние на силу их колоний и вероятность их выживания. Считается, что множество причинных факторов способствуют потере колоний: паразиты и патогены как основные кандидаты [3,7], воздействие пестицидов [8,9,10,11], количество, качество и разнообразие рациона [12,13], а также неблагоприятные погодные и кормовые условия. Кроме того, на состояние здоровья колоний медоносных пчел большое влияние оказывают методы управления пчеловода [14,15]. Все эти факторы воздействуют на колонии медоносных пчел по отдельности или в различных сочетаниях [16], что может привести к серьезным нарушениям состава микробиоты медоносных пчел. Задняя кишка медоносной пчелы содержит высококонсистентное бактериальное сообщество из шести-девяти видовых кластеров, которые составляют ядро кишечных бактерий, интегрированных в физиологическую экосистему хозяина, и могут изменяться с возрастом взрослых медоносных пчел [17,18]. Дисбиоз взрослых медоносных пчел (дисбаланс микроорганизмов желудочно-кишечного тракта) связан с уменьшением массы тела, недостаточным развитием и ранней смертностью рабочих особей [19]. Более того, измененная микробиота связана с недостатками хозяина. В такой ситуации стрессовые факторы окружающей среды могут изменить баланс бактерий кишечника и привести к заметному проявлению оппортунистических заболеваний и других проблем, связанных с сокращением колоний медоносных пчел [20]. Среди них увеличение количества спор Nosema spp. в средней кишке, преждевременное старение фуражиров и подавление иммунитета, связанное с окислительным стрессом [21].
Пробиотические микроорганизмы конкурируют с патогенными микробами в желудочно-кишечном тракте пчел в адгезии к кишечному эпителию [22]; защите от патогенов [19]; влиянии на иммунный ответ и метаболизм [23,24,25,26,27,28], а также влиянии на рост, развитие и выживаемость [19,29]. Присутствие пробиотиков может привести к улучшению доступности и использования питательных веществ в организме медоносных пчел. Опубликованные исследования различаются в своих подходах относительно влияния коммерческих пробиотиков и пребиотиков на здоровье медоносных пчел. Некоторые данные показывают, что пробиотики увеличивают смертность медоносных пчел и патогенную нагрузку, в то время как другие предполагают, что применение пробиотиков оказывает отличное влияние на силу колоний медоносных пчел, развитие восковых желез, производство меда и защиту от болезней [30,31,32,33,34,35,36,37]. Штаммы пробиотических бактерий, которые чаще всего использовались в качестве нового варианта управления микробиомом медоносной пчелы, были Bifidobacterium spp. и Lactobacillus spp. [32,38].
Ноземоз типа С, вызываемый микроспоридиями Nosema ceranae, негативно влияет на здоровье медоносных пчел и может привести к полному краху колонии. Для борьбы с быстрым распространением этого опасного заболевания срочно требуются дальнейшие исследования потенциальных методов лечения или пчеловодства. Роль этого патогена в глобальной потере колоний остается спорной [39,40], но было отмечено сокращение продолжительности жизни из-за энергетического стресса отдельных взрослых пчел, последующее снижение силы колонии и даже возможные внезапные крахи [41,42]. Nosema spp. первично паразитирует и размножается в эпителии средней кишки и, следовательно, нарушает пищеварение и поглощение питательных веществ [43]. Результатом описанного паразитизма является усугубление пищевого стресса, когда возбудитель зависит от хозяина в обеспечении энергией для размножения и роста [44]. Недавно опубликованное исследование показало корреляцию между дисбиозом кишечных бактерий, связанным с питанием, у A. mellifera и заражением N. ceranae [19]. Негативное влияние указанных факторов на производство медоносной пчелы и управление пчеловодством или рентабельность в целом, побудило разработать устойчивые альтернативные стратегии лечения ноземоза типа С. Антибиотик фумагиллин широко использовался для лечения ноземоза в течение нескольких десятилетий [45]. Однако, как недавно сообщалось, фумагиллин может усугублять, а не подавлять инфекцию N. ceranae [46]. Кроме того, использование антибиотиков для лечения болезней обезьян в настоящее время не одобрено нормами Европейского Союза. На сегодняшний день не существует ни одного зарегистрированного разрешенного продукта ветеринарной медицины (VMP) для борьбы с ноземозом, поэтому потребность в альтернативных методах лечения велика как никогда.
EM®, коммерчески доступный как EM® PROBIOTIC FOR BEES (далее, EM® для пчел), является запатентованным пробиотическим составом, принадлежащим и управляемым EM Research Organization на Окинаве, Япония. Он содержит несколько видов молочнокислых бактерий, дрожжей и фотосинтезирующих бактерий. Как новый подход в терапии, мы предполагаем, что EM® для пчел может оказать важное терапевтическое и иммуномодулирующее действие на уровне отдельных особей и колоний. Целью настоящего исследования было оценить влияние многократного дополнительного кормления естественно больных колоний медоносных пчел в условиях пасеки на уровень заражения Nosema spp. Полученные результаты были связаны с силой экспериментальных колоний. В то же время, в лабораторных контролируемых условиях, несколько биохимических и иммунологических параметров были измерены в гемолимфе и гипофарингеальных железах (HPGs) вновь появившихся рабочих в клетках, после многократного дополнительного кормления. Это первое применение коммерческой пробиотической смеси EM® для пчел у медоносных пчел как экономически важных социальных насекомых.
2.Материалы и методы
2.1. Полевые испытания
2.1.1. Местоположение экспериментальных пасек и дизайн полевой дорожки
Полевая часть эксперимента проводилась в течение 40 последовательных дней (начиная с 1 июля 2019 года) на пасеке, расположенной в континентальной части Хорватии (45°56′54.71″ N, 16°37′46.06″ E), и в соответствии с национальными классификационными пространственными единицами для статистических нужд NUTS 2-HR04 и NUTS 3-HR045, после основного сезона сбора урожая. Для проведения полевых испытаний было отобрано около 12 однородных колоний медоносных пчел (Apis mellifera carnica, Pollmann, 1879), естественно зараженных Nosema spp. и размещенных в стандартных ульях с корнем Лангстрота (LR), приобретенных у одного и того же пчеловода, и разделенных на экспериментальную (2 × 4) и контрольную (2 × 2) группы. В начале исследования ни одна из колоний не имела клинических признаков заболеваний расплода, а последняя обработка против клеща Varroa destructor была проведена 20 июня 2019 года (CheckMite®, а.м. кумафос), чтобы избежать негативного влияния паразитирования клеща на здоровье колонии. Во время эксперимента инсектициды на прилегающей территории не использовались.
2.1.2. Обработка дополнительного корма и отбор проб взрослых медоносных пчел
Колонии медоносных пчел дополнительно кормили сахарным сиропом объемом 0,25 л (1:1 вода-сахар; Virosecer, Вировитица, Хорватия), дополненным экспериментальной концентрацией 10% EM® для пчел, каждый второй день. Добавленный сахарный сироп, как и чистый сахарный сироп, применяли в колониях пчел следующим образом: экспериментальные колонии (1-4) путем распыления непосредственно на рамки, покрытые взрослыми пчелами (а), и в кормушки, расположенные под крышей ульев (5-8) (б), последовательно в течение 21 дня. Контрольные группы (контроль a, b) получали только 0,25 л сахарного сиропа, приготовленного и предоставленного тем же описанным способом. Доза была подобрана в соответствии с инструкциями производителя. Во время клинического осмотра колоний медоносных пчел, приблизительно 60 пчел-фуражиров на колонию были собраны у входа в улей для микроскопического исследования на наличие спор Nosema spp. Образцы взрослых пчел собирали в чистые пластиковые емкости, ловя пчел перед входом в ульи непосредственно или с помощью длинного пинцета. Каждая проба состояла примерно из 60 особей (фуражиров), взятых на 10-й (контроль II, EM IIa/EM IIb), 20-й (контроль III, EM IIIa/EM IIIb), 30-й (контроль IV, EM IVa/EM IVb) и 40-й (контроль V, EM Va/EM Vb) день после первоначального отбора проб (проводился до первого кормления; контроль I, EM Ia/EM Ib).
2.1.3. Осмотр и оценка силы колоний медоносных пчел
Клинические признаки заболеваний, наличие маток и смертность пчел проверяли при каждом осмотре колоний медоносных пчел на экспериментальной пасеке. Для оценки силы колоний медоносных пчел использовали метод Либефельда для визуального определения количества взрослых пчел, а также количества расплода [47], для опытных и контрольных групп. Оценка силы колоний медоносных пчел проводилась на 1-й (I) и 40-й (II) день эксперимента, в утренние часы (с 9:00 до 10:00 утра), до первых массовых кормовых полетов пчел. Для более легкой оценки площади гребенок, покрытых пчелами или расплодом, использовали рамку для улья LR, разделенную пластиковой сеткой на квадранты 1 × 1 дм.
2.1.4. Определение уровня заражения Nosema spp.
Медоносных пчел подсчитывали в каждом образце; их брюшки отделяли, тщательно раздавливали и гомогенизировали в пластиковом контейнере с 1 мл чистой воды на один образец пчелы. Споры Nosema spp. подсчитывали в каждом образце с помощью гемоцитометра Malassez, а уровень заражения рассчитывали в соответствии с руководством Международного эпизоотического бюро (МЭБ) [48]. Каждая процедура подсчета повторялась три раза. Подсчетное оборудование тщательно промывали после каждого подсчета проб, чтобы избежать загрязнения спорами из предыдущей пробы.
2.2. Испытания в условиях лабораторного контроля
2.2.1. Схема испытаний в инкубаторах и отбор проб взрослых пчел
Для испытаний в лабораторных условиях мы взяли пять рамок с запечатанным расплодом из пяти колоний медоносных пчел (A. m. carnica), содержащихся в Сельскохозяйственном институте Словении в Любляне, Словения. Колонии были свободны от спор Nosema spp. и не имели клинических признаков какого-либо заболевания. Рамки помещали в инкубатор при температуре 34 °C и оставляли на ночь. Пластиковые коробки для хранения компакт-дисков (~8 см (В) × ~12 см (диам.)) были подготовлены путем сверления ~80 круглых вентиляционных отверстий (каждое шириной ~2 мм) в верхней крышке. Кроме того, два дополнительных отверстия (диаметром 12 мм) были добавлены в качестве держателей для пластиковых кормовых трубок. На следующий день мы собрали только что появившихся пчел и поместили их в ящики (~50 взрослых пчел в каждом ящике). Было три группы пчел, которых кормили сахарным сиропом с добавлением 2,5, 5 и 10% EM® для пчел, и контрольная группа, которую кормили чистым сахарным сиропом. Каждая группа имела пять повторов. Тростниковый сахар и питьевую воду смешивали 1:1 (w:v) и подогревали до 40 °C. Для обработанных групп в сахарный сироп добавляли 2,5, 5 или 10% пробиотика EM® для пчел (2,5, 5 или 10 г пробиотика/100 г сахарного сиропа). Пчел в клетках кормили свободно. Мы также поместили трубку с питьевой водой в каждый ящик. Потребление корма регистрировали ежедневно, а корм готовили свежим каждые два дня. Мертвых пчел подсчитывали ежедневно.
2.2.2. Сбор гемолимфы
Отбор проб гемолимфы проводился на 11 и 15 день для определения иммунологических параметров и на 13 и 22 дни для определения биохимических параметров. Гемолимфу собирали в виде пула от 3 до 5 взрослых пчел на группу, в соответствии с методом, описанным в Beebook [49]. Гемолимфу отдельно собирали в пробирки и пробирки Эппендорф для различных биохимических анализов (глюкоза, трегалоза, общие липиды, общие белки, вителлогенин). Все образцы до анализа хранились при температуре -80 °C.
2.2.3. Биохимические параметры
Концентрация глюкозы, трегалозы и липидов
Содержание сахара в гемолимфе определяли с помощью коммерчески доступного набора (Glucose (GO) Assay Kit, Sigma-Aldrich, Saint Louis, MO, USA). Вкратце, глюкоза в образце окисляется до глюконовой кислоты и перекиси водорода. Перекись водорода реагирует с о-дианизидином в присутствии пероксидазы с образованием окрашенного продукта. Интенсивность окраски пропорциональна концентрации глюкозы. Оптическая плотность измерялась при 540 нм с помощью спектрофотометра (Shimadzu, Marlborough, MA, США). Точное количество глюкозы рассчитывали по стандартной кривой и умножали на коэффициент разбавления. При количественном определении трегалозы молекула трегалозы гидролизовалась до двух молекул D-глюкозы в реакции, катализируемой ферментом трегалазой [49]. Концентрацию трегалозы рассчитывали как показания соответствующей реакции минус предварительно определенная концентрация глюкозы в том же образце. Полученные результаты умножали на молекулярный вес трегалозы (342,3 г/моль) и делили на 2× молекулярный вес глюкозы (180 г/моль), поскольку трегалоза расщепляется трегалазой на две молекулы глюкозы.
Общее количество липидов в образцах определяли сульфо-фосфо-ванилиновым методом [50]. Образец гемолимфы смешивали с 200 мкл серной кислоты (Sigma-Aldrich, St. Louis, MO, USA) и инкубировали (10 мин, 100 °C). После быстрого охлаждения на льду добавляли ванилин (2 мл, 13 мМ в 66,8% фосфорной кислоте) (Sigma-Aldrich, St. Louis, MO, USA). После 30 мин инкубации при комнатной температуре оптическую плотность измеряли при 546 нм с помощью спектрофотометра (Shimadzu, Marlborough, MA, США). Концентрацию общих липидов рассчитывали по стандартной калибровочной кривой, полученной из серийного разведения олеиновой кислоты.
2.2.4. Иммунологические параметры
Концентрация общего белка и вителлогенина в гемолимфе
Концентрацию общего белка в гемолимфе пчел измеряли по методу Брэдфорда (коммерческий набор от Bio-Rad Hercules, Беркли, Калифорния, США). Чтобы предотвратить меланизацию гемолимфы, образцы во время анализа держали на льду. Оптическую плотность измеряли при 595 нм с помощью спектрофотометра (Shimadzu, Marlborough, MA, США). Точное количество общего белка рассчитывали по стандартной калибровочной кривой, приготовленной из бычьего сывороточного альбумина (Sigma-Aldrich, St. Louis, MO, USA).
Концентрацию вителлогенина (ВГ) измеряли с помощью набора Vitellogenin Elisa kit (MyBioSource, San Diego, CA, USA) в соответствии с инструкциями производителя. Этот набор основан на взаимодействии антител VG с антигеном VG (иммуносорбция) и колориметрической системе детекции HRP. Оптическая плотность измерялась при 450 нм с помощью спектрофотометра (Shimadzu, Marlborough, MA, USA). Уровень вителлогенина в образце рассчитывали по калибровочной кривой.
Размер гипофарингеальных желез
На 11-й (I) и 15-й (II) день эксперимента медоносных пчел (N = 5 на диету: ЭМ 5%, ЭМ 10%, контроль) ненадолго (~5 мин) помещали в морозильную камеру, затем препарировали ГПЖ и готовили их для гистологического исследования и измерения диаметра ацинаров. В группе 2,5% ЭМ ГПГ не анализировали. Ткань ГПЖ фиксировали в 10% формальдегиде, обезвоживали через серию растворов этанола (70%, 80%, 90%, 100%; 24 ч каждый), затем 100% 2-пропанол (24 ч), 100% 2-пропанол (12 ч), 100% 2-пропанол (24 ч), 2-пропанол: Парафин (1:1, 24 ч), 3× парафин (по 24 ч), и встраивали в парафин. Парафиновые блоки разрезали микротомом (Leica RM2255, Biosystems Nussloch GmbH, Nussloch, Германия) на срезы толщиной 7 мкм и помещали на микроскопические предметные стекла. Затем микроскопические предметные стекла окрашивали гематоксилином и эозином [51]. Измерение ГПЖ проводили с помощью программы AxioVision 4.6 (Carl Zeiss, San Diego, CA, USA). Измерение диаметра ацинусов ГПЖ проводили на 5-24 ацинусах в каждой пчеле и рассчитывали средний диаметр по группе.
2.3. Статистический анализ
Для того чтобы оценить и проверить различия в данных по споровой нагрузке между группами в разные даты отбора проб, односторонний дисперсионный анализ (ANOVA) с Post Hoc тестом Индюка для множественных сравнений и U-тест Манна-Уитни были выполнены с использованием пакета статистических программ GraphPad Prism версии 7.00 для Windows (GraphPad Software, La Jolla, CA, США). Данные проверяли на нормальность с помощью теста Шапиро-Уилка. Результаты представлены в виде средних значений и стандартных отклонений. Для определения статистических различий был установлен уровень значимости α = 0,05 (доверительный интервал 0,95).
3.Результаты
3.1. Сила колоний медоносных пчел
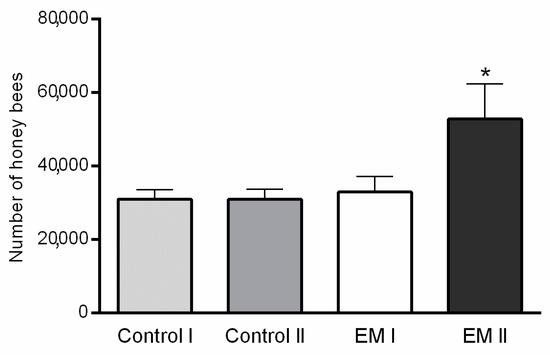
Изменения в среднем количестве медоносных пчел на группу в течение двух дат оценки показаны на рисунке 1. Статистически значимые различия в силе колоний медоносных пчел между контрольной и экспериментальной группами были определены на 40-й день (p < 0,001; F = 17,71). Более высокое количество пчел было оценено в группе ЭМ II по сравнению с контролем II, в то время как сила колоний в контроле I и группе ЭМ I была схожей.
3.2. Оценка уровней заражения Nosema spp.
Постоянное снижение уровня инфекции Nosema spp. в колониях медоносных пчел, получавших сахарный сироп с добавлением EM® для пчел в определенные даты (дни) отбора проб, было подтверждено статистически значимым тестом ANOVA (F = 10,12; p < 0,0001), как представлено на рисунке 2. Снижение количества спор Nosema spp. в образцах взрослых пчел, полученных из колоний медоносных пчел, подкармливаемых EM® для пчел (a, b) на второй день отбора проб (10 день) (p < 0,01), хотя уже наблюдалось статистически более низкое количество спор по сравнению с начальным днем полевого эксперимента. Снижение количества спор было подтверждено на каждую последующую дату отбора проб, на 20-й (только для a), 30-й и 40-й день (p < 0,001), соответственно.

Кроме того, в экспериментальной группе a было определено снижение количества спор по сравнению с исходным количеством спор в среднем на 47,91% на 10 день; 92,12% на 20 день; 93,49% на 30 день и 91,74% на 40 день. В экспериментальной группе b количество уменьшенных спор по сравнению с исходным количеством спор в среднем было следующим: 67,01% на 10 день; 85,3% на 20 день; 92,14% на 30 день и 95,66% на 40 день после первоначального отбора проб.
3.3. Смертность взрослых пчел и потребление диеты
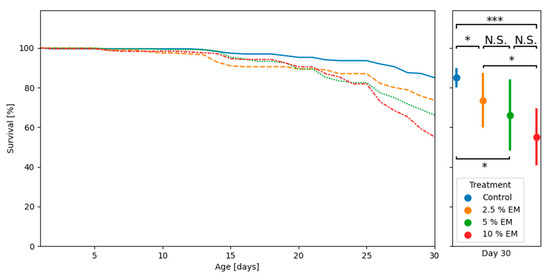
Анализ смертности взрослых медоносных пчел во время испытаний в лабораторных условиях выявил значительные различия в выживаемости между двумя группами с добавками (EM 2,5% и EM 10%), а также между указанными экспериментальными группами и контрольной группой (рис. 3).
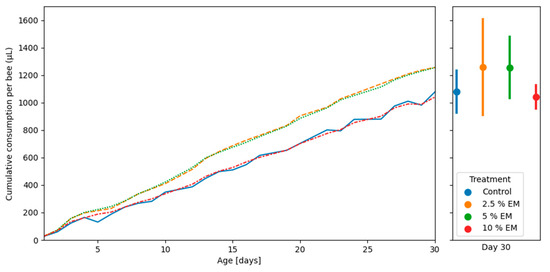
Медоносные пчелы не выявили существенной разницы в кумулятивном потреблении рациона во время испытаний в лабораторных контролируемых условиях, между тремя экспериментальными группами (EM 2,5%, EM 5%, EM 10%), а также между указанными экспериментальными группами и контрольной группой (Рисунок 4). Среднее кумулятивное потребление в контрольной группе составило 1077,58 мкл, а в экспериментальных группах (ЭМ 2,5%, ЭМ 5%, ЭМ 10%) — 1256,12, 1254,50 и 1040,54 мкл, соответственно.
3.4. Биохимические параметры
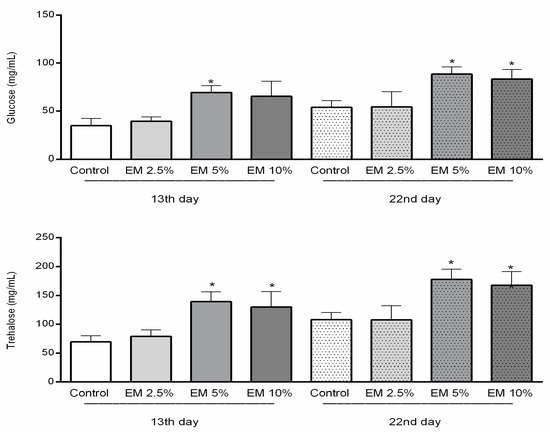
Концентрация углеводов была значительно выше в гемолимфе пчел опытных групп (рис. 5) (F = 14,23; p < 0,0001), по сравнению с контролем. Более того, концентрация глюкозы была значительно выше в опытных группах по сравнению с контролем: у 13-дневных пчел из группы EM 5% (p < 0,01), а также у 22-дневных пчел из групп EM 5% и EM 10%. Концентрация трегалозы в гемолимфе пчел, отобранной на 13-й и 22-й день, также была выше в группах ЭМ по сравнению с контролем (F = 16,55; p < 0,0001). Более подробно, концентрация трегалозы в экспериментальной группе ЭМ 5% была статистически выше, чем в контроле (p < 0,001; p < 0,0001), и аналогичные результаты были получены для экспериментальной группы ЭМ 10% (p < 0,01; p < 0,0001), в обоих наблюдаемых случаях. Концентрация углеводов (глюкоза, трегалоза), определенная в контрольной группе, была относительно стабильной в течение всего исследуемого периода.
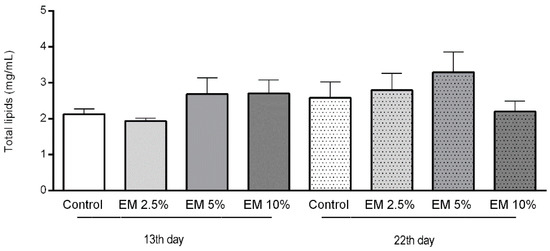
Концентрация общих липидов в гемолимфе взрослых пчел изменялась в течение всего периода наблюдения, и не было установлено существенных различий между контрольной и экспериментальной группами (рис. 6). Средняя концентрация липидов в гемолимфе 13-дневных пчел в контрольной группе составила 2,130 мг/мкл, а в экспериментальных группах EM 2,5%, EM 5% и EM 10% — 1,940, 2,690 и 2,705 мг/мкл, соответственно. При втором отборе проб концентрация липидов в контроле составила 2,585, а в экспериментальных группах ЭМ 2,5%, ЭМ 5% и ЭМ 10% варьировалась следующим образом: 2.800, 3.300 и 2.200 мг/мкл.
3.5. Иммунологические параметры
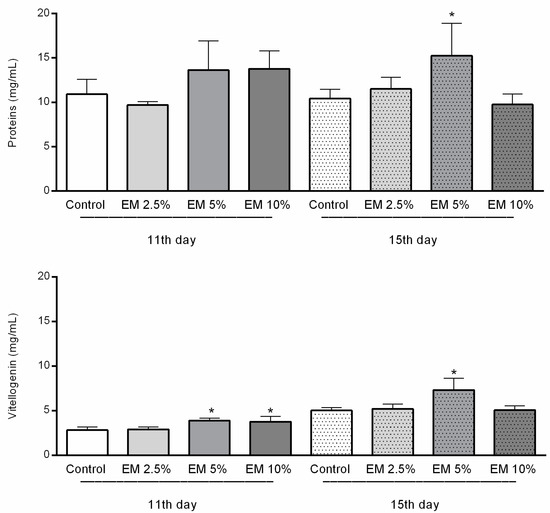
Концентрация общего белка в гемолимфе была значительно выше только в экспериментальной группе ЭМ 5% у 15-дневных пчел по сравнению с другими исследуемыми группами.
Концентрация вителлогенина была значительно выше в гемолимфе взрослых пчел в опытных группах ЭМ по сравнению с контролем, но только у тех, которых кормили с добавлением ЭМ 5% и ЭМ 10% в первую; и ЭМ 5% во вторую дату отбора проб (F = 23,29, p < 0,0001, рисунок 7). Концентрации вителлогенина в ЭМ 2,5% в первый и в ЭМ 10% во второй день отбора проб были аналогичны соответствующим контролям.
3.6. Влияние режима дополнительного питания ЭМ на размер гипофарингеальных желез
Диаметр ацинусов ГПЖ 11-дневных пчел из опытных групп, получавших ЭМ 5% и ЭМ 10%, был значительно больше, чем у пчел, которых кормили чистым сахарным сиропом, в том же возрасте (F = 17,41; p < 0,0001). У 15-дневных пчел различий между контрольной и экспериментальной группами установлено не было. Результаты показаны на рисунке 8.

2.Обсуждение
EM® для пчел успешно используется пчеловодами в Хорватии и соседних странах в течение последних нескольких лет. Научные отчеты о влиянии EM® for bees на жизнь и здоровье колоний медоносных пчел отсутствуют. В связи с этим мы посчитали, что крайне важно исследовать его потенциал как терапевтической и иммуномодулирующей пищевой добавки. Насколько нам известно, это первое исследование, целью которого является изучение влияния EM® for bees на состояние здоровья колоний медоносных пчел и устранение некоторых пробелов в знаниях о терапевтических, биохимических и иммунологических параметрах медоносных пчел, подвергшихся воздействию пробиотика, в полевых и лабораторных условиях. Кроме сообщений пчеловодов, которые не обязательно подразумевают положительный эффект, опубликованы противоречивые данные о неправильном применении белковых добавок [52,53,54], а также о побочных эффектах применения некоторых других коммерческих про- и пребиотиков [55]. В противоположность последним результатам [55], в нашем эксперименте, проведенном в комбинированных полевых и лабораторных условиях, добавка EM® для пчел вызвала значительное снижение уровня инфекции N. ceranae наряду с увеличением значений некоторых параметров реакции иммунной системы.
Изменения в динамике силы колоний медоносных пчел были различными между экспериментальной и контрольной группами, но в пределах ожидаемых диапазонов в условиях исследования и окружающей среды. В конце наблюдаемого периода были выявлены значительно более сильные колонии опытной группы. Эти результаты соответствовали ранее опубликованным научным данным о многократном кормлении сахарным сиропом с добавлением экстрактов трав [56,57] и использовании пробиотиков, в основном родов Lactobacillus и Bacillus, выделенных из кишечника A. mellifera, а также человеческих пробиотиков, стимулирующих королеву на откладку яиц [58,59,60,61].
Результаты данного исследования показали, что EM® для пчел, вводимый через сахарный сироп, значительно снижает развитие микроспоридий N. ceranae в кишечнике медоносной пчелы. Это проявилось в значительно меньшем количестве спор в опытных группах по сравнению с контрольной группой, начиная с начальной временной точки на 10-й, 20-й, 30-й и 40-й день полевого эксперимента (рис. 2). Известно, что пчелы, инвазированные N. ceranae и получающие натуральный пчелиный хлеб, демонстрируют более высокую стабильность микробиоты и более низкий уровень смертности, чем пчелы, получающие только сахарный сироп [62]. В связи с этим фактом мы выбрали полевой эксперимент, в котором колонии получали натуральные источники белковой пищи, за исключением дополнительного корма. Контрольные колонии медоносных пчел показали более низкое среднее снижение количества спор N. ceranae и находились на схожем уровне заражения в течение всего экспериментального периода. Немного лучшие результаты были получены в экспериментальной группе a, где применялся препарат EM® для пчел методом обливания, по сравнению с колониями, где корм предлагался в кормушках (b), что можно объяснить более эффективным распределением кормовой добавки за счет социального поведения взрослых пчел [63]. Другие научные отчеты, касающиеся способности различных штаммов бактерий подавлять уровень инфекции N. ceranae после перорального применения, также показали положительные результаты, например, действие Parasaccharibacter apium [64], штаммов Bifidobacterium и Lactobacillus [38] в лабораторных условиях; Bacillus subtilis и Lactobacillus johansonii в реальных полевых условиях [59,60]. Кроме хороших результатов по ингибированию роста ноземоза, сообщалось о благоприятных эффектах, связанных с производством маток, снижением численности клещей V. destructor [65], увеличением производства меда [59,65,66] и повышением жизнеспособности личинок и взрослых пчел [34,67]. Учитывая, что анализ процента кормовых пчел, зараженных спорами Nosema spp., был ранее продемонстрирован как более точный метод оценки уровня инфекции на уровне колонии [68], мы применили этот метод для изучения терапевтической способности EM® для пчел в качестве диетической добавки. Согласно результатам, представленным в данном исследовании, и отличным результатам других исследований биологических и терапевтических эффектов при различных заболеваниях у животных, растений и окружающей среды [69,70,71,72,73], следует признать, что EM® обладает значительным потенциалом для лечения ноземоза.
Анализ смертности взрослых медоносных пчел во время испытаний в лабораторных условиях выявил значительную разницу между контрольной и экспериментальной группами, особенно для 10% ЭМ. Результаты, связанные с выживаемостью пчел в лабораторных условиях, полученные Maistrello et al. [74] и Arredondo et al. [34], были более благоприятными, по сравнению с нашими результатами. Наблюдения в условиях пасеки свидетельствуют об отсутствии негативного воздействия EM® для пчел на здоровье и выживаемость расплода и взрослых пчел.
Мы обнаружили, что взрослые пчелы из опытных групп во время испытаний в лабораторных условиях потребляли одинаковое количество корма по сравнению с контрольными группами. Напротив, в предыдущих исследованиях сообщалось, что пчелы съедали большее количество добавленного корма [75].
В нашем исследовании уровни углеводов (глюкоза, трегалоза) были статистически выше в экспериментальных группах колоний медоносных пчел. Обычно концентрация углеводов стабильна в течение года, но при отборе проб гемолимфы на следующий день после осеннего введения сахарного сиропа в ульи она быстро возрастает [76]. Более того, некоторые авторы предполагают, что благодаря различным путям деградации сахара полезные микробы могут более успешно колонизировать богатую сахаром пищеварительную систему пчел [77]. В соответствии с этим, мы обнаружили, что содержание липидов было очень стабильным в течение обеих дат отбора проб гемолимфы без существенных различий между контрольной и экспериментальной группами, что неудивительно в связи с углеводной диетой пчел, содержащихся в клетках в лабораторных условиях. Эти результаты противоречат результатам Чакрабарти и др. [75].
Тем не менее, несмотря на тип диеты, концентрация белков была увеличена в экспериментальной группе EM 5% через 15 дней после начала эксперимента в контрольных лабораторных условиях. Эти результаты согласуются с предыдущими сообщениями о влиянии пищевых стеринов на различные признаки приспособленности у насекомых [75]. Хотя ключевая роль вителлогенина заключается в размножении, за исключением королевы, он может быть обнаружен в высоких концентрациях в гемолимфе стерильных рабочих [78]. Поскольку титры гемолимфы вителлогенина связаны с иммунитетом медоносной пчелы [79] и способны связываться с множеством патогенов [80], мы решили исследовать их концентрацию в гемолимфе взрослых пчел из опытных и контрольных групп. Кроме того, учитывая тот факт, что полезные микроорганизмы могут стимулировать иммунный ответ хозяина и повышать устойчивость к болезням [81], это особенно важно, поскольку заражение N. ceranae может угнетать иммунную систему медоносной пчелы [82]. В нашем исследовании концентрация вителлогенина в гемолимфе, отобранной на 11-й и 15-й день испытаний в лабораторных контролируемых условиях, показала значительное увеличение в группе EM 5% и EM 10% в первый и EM 5% в оба наблюдаемых случая, по сравнению с контролем. Несмотря на то, что увеличение размера ГПГ не всегда свидетельствует о хорошем физиологическом состоянии [13] или даже возникает в результате негативных последствий питательного стресса и дисбактериоза [19], мы заметили увеличение размера ГПГ и концентрации вителлогенина у молодых пчел, получавших корм с пробиотиком ЭМ. Эти результаты можно объяснить тем, что физиологический статус пчел положительно реагировал на присутствие полезных микробов в корме, учитывая, что бактериальные сообщества хозяев ГПЖ по-разному реагируют в зависимости от качества корма [19]. Кроме того, существуют изменения в бактериальной нагрузке и составе сообщества в различные сезоны и задачи пчел (кормилицы, фуражиры, зимние пчелы) из-за различных кормов [83], которые доступны в природе или хранятся в улье.
На практике пчеловоды лечат колонии медоносных пчел от варрооза с помощью ветеринарных препаратов. В случае заражения другим патогеном, включая Nosema spp., осторожное использование коммерческих пробиотиков с полезными микроорганизмами, учитывая производство их метаболитов, может представлять собой естественный инструмент для защиты или снижения нагрузки патогенами у медоносных пчел. По нашему мнению, данное исследование показывает возможную роль добавок полезных бактерий в поддержании здоровья медоносных пчел в качестве профилактической меры и нового инструмента для управления микробиомом пчел. Дальнейшие исследования необходимы для изучения эффективности пробиотика ЭМ на колониях медоносных пчел в разные сезоны и оценки возможного влияния на производство меда.
5.Выводы
В связи с тем, что многочисленные негативные факторы способствуют сокращению численности насекомых-опылителей, очень важно изучить все требования к питанию, необходимые для улучшения и поддержания здоровья колоний медоносных пчел. EM® для пчел является перспективной альтернативной пищевой добавкой для борьбы с ноземозом в колониях медоносных пчел, вызывая последовательное снижение количества спор после правильного применения в улье. В целом, это первое исследование, в котором сообщается о новых знаниях о пользе EM® for bees для усвоения и его роли в физиологии питания медоносных пчел.
Ссылки:
1.Cameron, S.A.; Lozier, J.D.; Strange, J.P.; Koch, J.B.; Cordes, N.; Solter, L.F.; Griswold, T.L. Patterns of widespread decline in North American bumble bees. Proc. Natl. Acad. Sci. USA 2011, 108, 662–667. [Google Scholar] [CrossRef] [PubMed][Green Version]
2.Potts, S.G.; Biesmeijer, J.C.; Kremen, C.; Neumann, P.; Schweiger, O.; Kunin, W.E. Global pollinator declines: Trends, impacts and drivers. Trends Ecol. Evol. 2010, 25, 345–353. [Google Scholar] [CrossRef] [PubMed]
3.Smith, K.M.; Loh, E.H.; Rostal, M.K.; Zambrana-Torrelio, C.M.; Mendiola, L.; Daszak, P. Pathogens, Pests, and Economics: Drivers of Honey Bee Colony Declines and Losses. EcoHealth 2013, 10, 434–445. [Google Scholar] [CrossRef] [PubMed]
4.Klein, A.M.; Vaissiere, B.E.; Cane, J.H.; Steffan-Dewenter, I.; Cunningham, S.A.; Kremen, C.; Tscharntke, T. Importance of pollinators in changing landscapes for world crops. Proc. R. Soc. B Biol. Sci. 2007, 274, 303–313. [Google Scholar] [CrossRef][Green Version]
5.Fontaine, C.; Dajoz, I.; Meriguet, J.; Loreau, M. Functional Diversity of Plant–Pollinator Interaction Webs Enhances the Persistence of Plant Communities. PLoS Biol. 2006, 4, e1. [Google Scholar] [CrossRef]
6.Rollin, O.; Benelli, G.; Benvenuti, S.; Decourtye, A.; Wratten, S.D.; Canale, A.; Desneux, N. Weed-insect pollinator networks as bioindicators of ecological sustainability in agriculture. A review. Agron. Sustain. Dev. 2016, 36, 8. [Google Scholar] [CrossRef][Green Version]
7.Genersch, E. Honey bee pathology: Current threats to honey bees and beekeeping. Appl. Microbiol. BioTechnol. 2010, 87, 87–97. [Google Scholar] [CrossRef]
8.Sandrock, C.; Tanadini, M.; Tanadini, L.G.; Fauser-Misslin, A.; Potts, S.G.; Neumann, P. Impact of chronic neonicotinoid exposure on honeybee colony performance and queen supersedure. PLoS ONE 2014, 9, e103592. [Google Scholar] [CrossRef][Green Version]
9.Godfray, H.C.; Blacquiere, T.; Field, L.M.; Hails, R.S.; Petrokofsky, G.; Potts, S.G.; Raine, N.E.; Vanbergen, A.J.; McLean, A.R. A restatement of the natural science evidence base concerning neonicotinoid insecticides and insect pollinators. Proc. R. Soc. B 2014, 281, 20140558. [Google Scholar] [CrossRef][Green Version]
10.Goulson, D.; Nicholls, E.; Botías, C.; Rotheray, E.L. Bee declines driven by combined stress from parasites, pesticides, and lack of flowers. Science 2015, 347, 6229. [Google Scholar] [CrossRef]
11.Tlak Gajger, I.; Sakač, M.; Gregorc, A. Impact of Thiamethoxam on Honey Bee Queen (Apis mellifera carnica) Reproductive Morphology and Physiology. Bull. Environ. Contam. Toxicol. 2017, 99, 297–302. [Google Scholar] [CrossRef] [PubMed]
12.Alaux, C.; Brunet, J.L.; Dussaubat, C.; Mondet, F.; Tchamitchan, S.; Cousin, M.; Brillard, J.; Baldy, A.; Belzunces, L.P.; Le Conte, Y. Interactions between Nosema microspores and a neonicotinoid weaken honeybees (Apis mellifera). Environ. Microbiol. 2010, 12, 774–782. [Google Scholar] [CrossRef] [PubMed][Green Version]
13.Di Pasquale, G.; Salignon, M.; Le Conte, Y.; Belzunces, L.P.; Decourtye, A.; Kretzschmar, A.; Suchail, S.; Brunet, J.-L.; Alaux, C. Influence of Pollen Nutrition on Honey Bee Health: Do Pollen Quality and Diversity Matter? PLoS ONE 2013, 8, e72016. [Google Scholar] [CrossRef] [PubMed][Green Version]
14.Gilioli, G.; Sperandio, G.; Hatjina, F.; Simonetto, A. Towards the development of an index for the holistic assessment of the health status of a honey bee colony. Ecol. Indic. 2019, 101, 341–347. [Google Scholar] [CrossRef]
15.Sperandio, G.; Simonetto, A.; Carnesecchi, E.; Costa, C.; Hatjina, F.; Tosi, S.; Gilioli, G. Beekeeping and honey bee colony health: A review and conceptualization of beekeeping management practices implemented in Europe. Sci. Total Environ. 2019, 696, 133795. [Google Scholar] [CrossRef]
16.Becher, M.A.; Osborne, J.L.; Thorbeck, P.; Kennedy, P.J.; Grimm, V. Towards a systems approach for understanding honeybee decline: A stocktaking and synthesis of existing models. J. Appl. Ecol. 2013, 50, 868–880. [Google Scholar] [CrossRef][Green Version]
17.Hroncova, Z.; Havlik, J.; Killer, J.; Doskocil, I.; Tyl, J.; Kamler, M.; Titera, D.; Hakl, J.; Mrazek, J.; Bunesova, V.; et al. Variation in Honey Bee Gut Microbial Diversity Affected by Ontogenetic Stage, Age and Geographic Location. PLoS ONE 2015, 10, e0118707. [Google Scholar] [CrossRef][Green Version]
18.Raymann, K.; Moran, N.A. The role of the gut microbiome in health and disease of adult honey bee workers. Curr. Opin. Insect. Sci. 2018, 26, 97–104. [Google Scholar] [CrossRef]
19.Maes, P.W.; Rodrigues, P.A.P.; Oliver, R.; Mott, B.M.; Anderson, K.E. Diet-related gut bacterial dysbiosis correlates with impaired development, increased mortality and Nosema disease in the honeybee (Apis mellifera). Mol. Ecol. 2016, 25, 5439–5450. [Google Scholar] [CrossRef]
20.Anderson, K.E.; Ricigliano, V.A. Honey bee gut dysbiosis: A novel context of disease ecology. Curr. Opin. Insect Sci. 2017, 22, 125–132. [Google Scholar] [CrossRef]
21.Morimoto, T.; Kojima, Y.; Toki, T.; Komeda, Y.; Yoshiyama, M.; Kimura, K.; Nirasawa, K.; Kadowaki, T. The habitat disruption induces immune-suppression and oxidative stress in honey bees. Ecol. Evol. 2011, 1, 201–217. [Google Scholar] [CrossRef] [PubMed]
22.Powell, J.E.; Martinson, V.G.; Urban-Mead, K.; Moran, N.A. Routes of Acquisition of the Gut Microbiota of the Honey Bee Apis mellifera. Appl. Environ. Microbiol. 2014, 80, 7378–7387. [Google Scholar] [CrossRef] [PubMed][Green Version]
23.Engel, P.; Bartlett, K.D.; Moran, N.A. The bacterium Frischella perrara causes scab formation in the gut of its honeybee host. MBio 2015, 6, e00193-15. [Google Scholar] [CrossRef] [PubMed][Green Version]
24.Kwong, W.K.; Medina, L.A.; Koch, H.; Sing, K.-W.; Soh, E.J.Y.; Ascher, J.S. Dynamic microbiome evolution in social bees. Sci. Adv. 2017, 3, e1600513. [Google Scholar] [CrossRef] [PubMed][Green Version]
25.Palmer-Young, E.C.; Raffel, T.R.; McFrederick, Q.S. pH-mediated inhibition of a bumble bee parasite by an intestinal symbiont. Parasitology 2019, 146, 380–388. [Google Scholar] [CrossRef]
26.Emery, O.; Schmidt, K.; Engel, P. Immune system stimulation by the gut symbiont Frischella perrara in the honey bee (Apis mellifera). Mol. Ecol. 2017, 26, 2576–2590. [Google Scholar] [CrossRef]
27.Lee, F.J.; Rusch, D.B.; Stewart, F.J.; Mattila, H.R.; Newton, I.L.G. Saccharide breakdown and fermentation by the honey bee gut microbiome. Environ. Microbiol. 2015, 17, 796–815. [Google Scholar] [CrossRef]
28.Zheng, H.; Powell, J.E.; Steele, M.I.; Dietrich, C.; Moran, N.A. Honeybee gut microbiota promotes host weight gain via bacterial metabolism and hormonal signaling. Proc. Natl. Acad. Sci. USA 2017, 114, 4775–4780. [Google Scholar] [CrossRef][Green Version]
29.Corby-Harris, V.; Maes, P.; Anderson, K.E. The bacterial communities associated with honey bee (Apis mellifera) foragers. PLoS ONE 2014, 9, e95056. [Google Scholar] [CrossRef][Green Version]
30.Pătruică, S.; Mot, D. The effect of using prebiotic and probiotic products on intestinal micro-flora of the honeybee (Apis mellifera carpatica). Bull. Entomol. Res. 2012, 102, 619–623. [Google Scholar] [CrossRef]
31.Pătruică, S.; Dumitrescu, G.; Stancu, A.; Bura, M.; Dunea, I.B. The Effect of Prebiotic and Probiotic Feed Supplementation on the Wax Glands of Worker Bees (Apis Mellifera). Anim. Sci. Biotechnol. 2012, 45, 268–271. [Google Scholar]
32.Pătruică, S.; Hutu, I. Economic benefits of using prebiotic and probiotic products as supplements in stimulation feeds administered to bee colonies. Turk. J. Vet. Anim. Sci. 2013, 37, 259–263. [Google Scholar]
33.Andrearczyk, S.; Kadhim, M.J.; Knaga, S. Influence of a probiotic on mortality, sugar syrup ingestion and infection of honeybees with Nosema spp. under laboratory assessment. Med. Weter. 2014, 70, 762–765. [Google Scholar]
34.Arredondo, D.; Castelli, L.; Porrini, M.P.; Garrido, P.M.; Eguaras, M.J.; Zunino, P.; Antunez, K. Lactobacillus kunkeei strains decreased the infection by honey bee pathogens Paenibacillus larvae and Nosema ceranae. Benef. Microbes 2018, 9, 279–290. [Google Scholar] [CrossRef]
35.Ptaszyńska, A.A.; Borsuk, G.; Mułenko, W.; Wilk, J. Impact of vertebrate probiotics on honeybee yeast microbiota and on the course of nosemosis. Med. Weter. 2016, 72, 430–434. [Google Scholar] [CrossRef]
36.Daisley, B.A.; Pitek, A.P.; Chmiel, J.A.; Al, K.F.; Chernyshova, A.M.; Faragalla, K.M.; Burton, J.P.; Thompson, G.J.; Reid, J. Novel probiotic approach to counter Paenibacillus larvae infection in honey bees. ISME J. 2020, 14, 476–491. [Google Scholar] [CrossRef][Green Version]
37.Stephan, J.G.; Lamei, S.; Pettis, J.S.; Riesbeck, K.; De Miranda, J.R.; Forsgren, E. Honeybee-specific lactic acid bacterium supplements have no effect on American Foulbrood-infected honeybee colonies. Appl. Environ. Microbiol. 2019, 85, e00606-19. [Google Scholar] [CrossRef][Green Version]
38.Baffoni, L.; Gaggìa, F.; Alberoni, D.; Cabbri, R.; Nanetti, A.; Biavati, B.; Di Gioia, D. Effect of dietary supplementation of Bifidobacterium and Lactobacillus strains in Apis mellifera L. against Nosema ceranae. Benef. Microbes 2016, 7, 45–51. [Google Scholar] [CrossRef]
39.Paxton, R.J. Does infection by Nosema ceranae cause “Colony Collapse Disorder” in honeybees (Apis mellifera). J. Apic. Res. 2010, 49, 80–84. [Google Scholar] [CrossRef]
40.Higes, M.; Meana, A.; Bartolome, C.; Botias, C.; Martin-Hernandez, R. Nosema ceranae (Microsporidia), a controversial 21st century honeybee pathogen. Environ. Microbiol. Rep. 2013, 5, 17–29. [Google Scholar] [CrossRef]
41.Mayack, C.; Naug, D. Energetic stress in the honey bee Apis mellifera from Nosema ceranae infection. J. Invertebrat. Pathol. 2009, 100, 185–188. [Google Scholar] [CrossRef] [PubMed]
42.Botías, C.; Martin-Hernandez, R.; Meana, A.; Higes, M. Screening alternative therapies to control Nosemosis type C in honey bee (Apis mellifera iberiensis) colonies. Res. Vet. Sci. 2013, 95, 1041–1045. [Google Scholar] [CrossRef] [PubMed]
43.Dussaubat, C.; Brunet, J.-L.; Higes, M.; Colbourne, J.K.; López, J.; Choi, J.-H.; Martin-Hernandez, R.; Botías, C.; Cousin, M.; Mcdonnell, C.; et al. Gut pathology and responses to the microsporidium Nosema ceranae in the honey bee Apis mellifera. PLoS ONE 2012, 7, e37017. [Google Scholar] [CrossRef][Green Version]
44.Holt, H.L.; Aronstein, K.A.; Grozinger, C.M. Chronic parasitization by Nosema microsporidian causes global expression changes in core nutritional, metabolic and behavioral pathways in honey bee workers (Apis mellifera). BMC Genom. 2013, 14, 799. [Google Scholar] [CrossRef] [PubMed][Green Version]
45.Higes, M.; Nozal, M.J.; Alvaro, A.; Barrios, L.; Meana, A.; Martín-Hernández, R.; Bernal, J.L.; Bernal, J. The stability and effectiveness of fumagillin in controlling Nosema ceranae (Microsporidia) infection in honey bees (Apis mellifera) under laboratory and field conditions. Apidologie 2011, 42, 364–377. [Google Scholar] [CrossRef][Green Version]
46.Huang, W.-F.; Solter, L.F.; Yau, P.M.; Imai, B.S. Nosema ceranae escapes fumagillin control in honey bees. PLoS Pathog. 2013, 9, e1003185. [Google Scholar] [CrossRef][Green Version]
47.Delaplane, K.S.; Van Der Steen, J.; Guzman-Novoa, E. Standard methods for estimating strength parameters of Apis mellifera colonies. J. Apic. Res. 2013, 52, 1–12. [Google Scholar] [CrossRef]
48.OIE—Office International des Epizooties. Chapter 2.2.4., Nosemosis of Honey Bees. In Manual of Diagnostic Tests and Vaccines for Terrestrial Animals; OIE: Pairs, France, 2013; Available online: http://www.oie.int/international-standard-setting/terrestrial-manual/access-online (accessed on 20 February 2020).
49.Hartfelder, K.; Bitondi, M.M.G.; Brent, C.S.; Guidugli Lazzarini, K.R.; Simões, Z.L.P.; Stabentheiner, A.; Tanaka, E.D.; Wang, Y. Standard methods for physiology and biochemistry research in Apis mellifera. J. Apic. Res. 2013, 52, 1–48. [Google Scholar] [CrossRef][Green Version]
50.Zollner, E.; Kirs, I.K. Uber die quantitative Bestimmung yon Lipoiden (Mikromethode) mittels der vielen natiirliehen Lipoiden (allen bekannten Plasmalipoiden) gemeinsamen Sulfophosphovanillin-Reaktion. Z. Gesamte Exp. Med. 1962, 135, 545–561. [Google Scholar] [CrossRef]
51.Romeis, B. Mikroskopische Technik; Oldenbourg Verlag: München-Wien, Germany, 1968; pp. 174–185. [Google Scholar]
52.Pajuelo, A.G.; Torres, C.; Bermejo, F.J.O. Colony losses: A double-blind trial on the influence of supplementary protein nutrition and preventative treatment with fumagillin against Nosema ceranae. J. Apic. Res. 2008, 47, 84–86. [Google Scholar] [CrossRef]
53.Saffari, A.; Keva, P.G.; Atkinson, J.L. Palatability and consumption of patty-formulated pollen and pollen substitutes and their effects on honeybee colony performance. J. Apic. Sci. 2010, 54, 63–71. [Google Scholar]
54.Glavinic, U.; Stankovic, B.; Draskovic, V.; Stevanovic, J.; Petrovic, T.; Lakic, N.; Stanimirovic, Z. Dietary amino acid and vitamin complex protects honey bee from immunosuppression caused by Nosema ceranae. PLoS ONE 2017, 12, e0187726. [Google Scholar] [CrossRef]
55.Ptaszyńska, A.A.; Borsuk, G.; Zdybicka-Barabas, A.; Cytryńska, M.; Malek, W. Are commercial probiotics and prebiotics effective in the treatment and prevention of honeybee nosemosis C? Parasitol. Res. 2016, 115, 397–406. [Google Scholar] [CrossRef] [PubMed][Green Version]
56.Tlak Gajger, I.; Vugrek, O.; Pinter, L.; Petrinec, Z. “Nozevit patties” treatment of honeybees (Apis mellifera) for the control of Nosema ceranae disease. Am. Bee J. 2009, 149, 1053–1056. [Google Scholar]
57.Tlak Gajger, I.; Kozaric, Z.; Berta, D.; Nejedli, S.; Petrinec, Z. Effect of the herbal preparation Nozevit on the mid-gut structure of honeybees (Apis mellifera) infected with Nosema spp. spores. Vet. Med. 2011, 56, 343–350. [Google Scholar] [CrossRef][Green Version]
58.Audisio, M.C.; Benítez-Ahrendts, M.R. Lactobacillus johnsonii CRL1647, isolated from Apis mellifera L. bee-gut, exhibited a beneficial effect on honeybee colonies. Benef. Microbes 2011, 2, 29–34. [Google Scholar] [CrossRef]
59.Sabate, D.C.; Cruz, M.S.; Benitez-Ahrendts, M.R.; Audisio, M.C. Beneficial effects of Bacillus subtilis subsp. subtilis Mori2, a honey-associated strain, on honeybee colony performance. Probiotics Antimicrob. Proteins. 2012, 4, 39–46. [Google Scholar] [CrossRef]
60.Audisio, M.C.; Sabate, D.C.; Benitez-Ahrendts, M.R. Effect of Lactibacillus johansonii CRL1647 on different parameters of honeybee colonies and bacterial populations of the bee gut. Benef. Microbes 2015, 25, 1–10. [Google Scholar]
61.Alberoni, D.; Baffoni, L.; Gaggìa, F.; Ryan, P.M.; Murphy, K.; Ross, P.R.; Stanton, C.; Di Gioia, D. Impact of beneficial bacteria supplementation on the gut microbiota, colony development and productivity of Apis mellifera L. Benef. Microbes 2018, 9269–9278. [Google Scholar] [CrossRef] [PubMed]
62.Huang, S.K.; Ye, K.T.; Huang, W.F.; Ying, B.H.; Li, X.S.; Lin, H.; Li, J.H.; Chen, Y.P.; Li, J.L.; Bao, X.L.; et al. Influence of Feeding Type and Nosema ceranae Infection on the Gut Microbiota of Apis cerana Workers. mSystems 2018, 3, e00177-18. [Google Scholar] [CrossRef][Green Version]
63.Tlak Gajger, I. Nozevit aerosol application for Nosema ceranae disease treatment. Am. Bee J. 2011, 151, 1087–1090. [Google Scholar]
64.Corby-Harris, V.; Snyder, L.; Meador, C.; Naldo, R.; Mott, B.; Andersom, K. Parasaccharibacter apium, gen. Nov., sp. Nov., improves honey bee (Hymenoptera: Apidae) resistance to Nosema. J. Econ. Entomol. 2016, 109, 537–543. [Google Scholar] [CrossRef][Green Version]
65.Audisio, M.C. Gram-positive bacteria with probiotic potential for the Apis mellifera L. honey bee: The experiance in the northwest of Argentina. Probiotics Antimicrob. Proteins. 2017, 9, 22–31. [Google Scholar] [CrossRef] [PubMed]
66.Fanciotti, M.N.; Tejerina, M.; Benítez Ahrendts, M.; Audisio, M.C. Honey yield of different commercial apiaries treated with Lactobacillus salivarius A3iob, a new bee-probiotic strain. Benef. Microbes 2018, 9, 291–298. [Google Scholar] [CrossRef]
67.Yoshiyama, M.; Wu, M.; Sugimura, Y.; Takaya, N.; Kimoto-Nira, H.; Suzuki, C. Inhibition of Paenibacillus larvae by lactic acid bacteria isolated from fermented materials. J. Invertebr. Pathol. 2013, 112, 62–67. [Google Scholar] [CrossRef]
68.Goblirsch, M.; Huang, Z.Y.; Spivak, M. Physiological and Behavioral Changes in Honey Bees (Apis mellifera) Induced by Nosema ceranae Infection. PLoS ONE 2013, 8, e58165. [Google Scholar] [CrossRef]
69.Laskowska, E.; Jarosz, L.; Grądzki, Z. Effect of Multi-Microbial Probiotic Formulation Bokashion Pro- and Anti-Inflammatory Cytokines Profilein the Serum, Colostrum and Milk of Sows, and in a Culture of Polymorphonuclear Cells Isolated from Colostrum. Probiotics Antimicrob. Proteins. 2019, 11, 220–232. [Google Scholar] [CrossRef][Green Version]
70.Pinoargote, G.; Flores, G.; Cooper, K.; Ravishankar, S. Effects on survival and bacterial community composition of the aquaculture water and gastrointestinal tract of shrimp (Litopenaeus vannamei) exposed to probiotic treatments after an induced infection of acute hepatopancreatic necrosis disease. Aquac. Res. 2018, 49, 1–19. [Google Scholar] [CrossRef][Green Version]
71.Rozaik, E.; Safwat, S. Growth Inhibition of Various Pathogenic Microorganisms Using Effective Microorganisms (EM). Int. J. Appl. Eng. Res. 2018, 4, 283–286. [Google Scholar] [CrossRef][Green Version]
72.Zaman, A.; Ahmed, M.; Gogoi, P. Effect of bokashi on plant growth, yield and essential oil quantity and quality in patchouli (Pogostemon Cablin Benth.). Biosci. Biotech. Res. Asia 2010, 7, 383–387. [Google Scholar]
73.Olle, M.; Williams, I. The Influence of Effective Microorganisms on the Growth and Nitrate Content of Vegetable Transplants. J. Adv. Agric. Technol. 2015, 2, 1. [Google Scholar] [CrossRef]
74.Maistrello, L.; Lodesani, M.; Costa, C.; Leonardi, F.; Marani, G.; Caldon, M.; Mutinelli, F.; Granato, A. Screening of natural compounds for the control of nosema disease in honeybees (Apis mellifera). Apidologie 2008, 39, 436–445. [Google Scholar] [CrossRef][Green Version]
75.Chakrabarti, P.; Lucas, H.M.; Sagili, R.R. Evaluating effects of a critical micronutritient (24-methylenecholesterol) on honeybee physiology. Ann. Entomol. Soc. Am. 2020, 113, 176–182. [Google Scholar] [CrossRef][Green Version]
76.Kunc, M.; Dobeš, P.; Hurychová, J.; Vojtek, L.; Poiani, S.B.; Danihlík, J.; Havlík, J.; Titěra, D.; Hyršl, P. The Year of the Honey Bee (Apis mellifera L.) with Respect to Its Physiology and Immunity: A Search for Biochemical Markers of Longevity. Insects 2019, 10, 244. [Google Scholar] [CrossRef][Green Version]
77.Cariveau, D.P.; Powell, J.E.; Koch, H.; Winfree, R.; Moran, N.A. Variation in gut microbial communities and its association with pathogen infection in wild bumble bees (Bombus). ISME J. 2014, 8, 2369–2379. [Google Scholar] [CrossRef]
78.Engels, W.; Kaatz, H.; Zillikens, A.; Simões, Z.L.P.; Truve, A.; Engels, W.; Zillikens, M.C.; Truve, K. Honey bee reproduction: Vitellogenin and caste-specific regulation of fertility. In Advances in Invertebrate Reproduction; Hoshi, M., Yamashita, O., Eds.; Elsiever: Amsterdam, The Netherlands, 1990; pp. 495–502. [Google Scholar]
79.Dainat, B.; Evans, J.D.; Chen, Y.P.; Gauthier, L.; Neumann, P. Predictive Markers of Honey Bee Colony Collapse. PLoS ONE 2012, 7, e32151. [Google Scholar] [CrossRef]
80.Li, Z.; Zhang, S.; Liu, Q. Vitellogenin Functions as a Multivalent Pattern Recognition Receptor with an Opsonic Activity. PLoS ONE 2008, 3, e1940. [Google Scholar] [CrossRef] [PubMed][Green Version]
81.vans, J.D.; Lopez, D.L. Bacterial Probiotics Induce an Immune Response in the Honey Bee (Hymenoptera: Apidae). J. Econ. Entomol. 2004, 97, 752–756. [Google Scholar] [CrossRef]
82.Antúnez, K.; Martín-Hernández, R.; Prieto, L.; Meana, A.; Zunino, P.; Higes, M. Immune suppression in the honey bee (Apis mellifera) following infection by Nosema ceranae (Microsporidia). Environ. Microbiol. 2009, 11, 2284–2290. [Google Scholar] [CrossRef]
83.Kešnerová, L.; Emery, O.; Troilo, M.; Liberti, J.; Erkosar, B.; Engel, P. Gut microbiota structure differs between honeybees in winter and summer. ISME J. 2020, 14, 801–814. [Google Scholar] [CrossRef][Green Version]

Добавить комментарий