Аннотация
Эктопаразитический клещ Varroa destructor, безусловно, является основной причиной смертности медоносных пчел (Apis mellifera) во всем мире благодаря своей роли переносчика смертельных вирусов, в частности, штаммов вируса деформации крыла (DWV) и вируса острого паралича пчел (ABPV). Такая многоуровневая система взаимодействия хозяин-паразит-патоген затрудняет изучение влияния клеща или вируса на выживание естественного хозяина. Цель данного исследования состояла в том, чтобы устранить сбивающее влияние варроа и изучить роль восприимчивости к вирусу в повышении выживаемости естественно адаптированной шведской популяции медоносных пчел, устойчивых к клещу (MR), по сравнению с медоносными пчелами, восприимчивыми к клещу (MS). Взрослые пчелы в клетках и выращенные в лаборатории личинки из колоний, свободных от варроа, были инокулированы DWV и ABPV в серии экспериментов по заражению кормом, в то время как контрольные группы получали корм без вирусов. Вирусные инфекции отслеживались с помощью RT-qPCR анализов у особей, отобранных в течение определенного времени. Динамика заражения DWV и ABPV как взрослых особей, так и личинок была практически одинаковой в группах MR и MS, но смертность взрослых особей MS была значительно выше, чем взрослых особей MR. Результаты показывают, что толерантность к вирусам, а не снижение восприимчивости или устойчивости к вирусам, является важным компонентом естественного выживания этой популяции медоносных пчел.
Введение
Несмотря на нынешнее внимание общественности и ученых к возможной роли воздействия агрохимикатов на здоровье диких и управляемых пчел (1,2), эктопаразитический клещ Varroa destructor вместе с сопутствующими вирусами остается неоспоримо ведущей причиной гибели колоний медоносных пчел (Apis mellifera) во всем мире (3,4,5). В частности, два комплекса вирусов, комплекс вируса деформированного крыла (DWV) (включая основные штаммы DWV-A, DWV-B и DWV-C (6)) и комплекс вируса острого паралича пчел (ABPV) (включая основные штаммы ABPV, вирус кашмирской пчелы (KBV) и израильский вирус острого паралича (IAPV)(7)), передаются клещами варроа с высокой эффективностью и приводят к разрушительным, хотя и различным последствиям (8). Из двух комплексов вирусов DWV стал наиболее распространенным и широко распространенным вирусом (9) благодаря его превосходной адаптации к комбинированному давлению отбора, связанному с передачей вируса варроа, борьбой с клещами пчеловода и выживанием колоний в зимний период(8). И DWV, и ABPV являются одноцепочечными РНК-вирусами, которые заражают все стадии развития медоносной пчелы (7,10). В отсутствие клещей варроа они поддерживаются в колонии на низком уровне как в основном безвредные инфекции через различные горизонтальные и вертикальные пути передачи (11,12,13,14,15,16). Характерными симптомами DWV являются тяжелые деформации крыльев, приводящие к появлению бесполетных взрослых особей, которые погибают вскоре после появления на свет (10). Однако эти симптомы почти исключительно связаны с передачей DWV через варроа, когда клещ питается пчелами на стадии развития куколки (10,17). ABPV, передаваемый клещами варроа, характеризуется в основном тяжелой кукольной смертностью, а при повышенных титрах у взрослых особей — дрожью, параличом и поведенческими отклонениями (7).
Популяция клещей в зараженной колонии медоносных пчел может расти с экспоненциальной скоростью, быстро приводя к эпидемии ABPV и/или DWV, что в конечном итоге приводит к гибели колонии (8,14). По этой причине пчеловоды нуждаются в активных стратегиях борьбы с клещами для поддержания жизни колоний медоносных пчел почти во всех частях мира, где существует этот клещ (3). Однако различные популяции медоносных пчел естественным образом по-разному реагируют на давление этого паразита. Хотя большинство медоносных пчел восприимчивы к паразитизму клеща варроа и обычно погибают в течение нескольких лет после неконтролируемого заражения клещом (3), некоторые популяции, согласно документам, выживают без мер борьбы с клещом и без вредных последствий, обычно связанных с заражением клещом варроа (18). Например, борьба с клещами не требуется в Африке или в некоторых районах Южной Америки, где местные популяции или подвиды A. mellifera эффективно устойчивы к клещам и поддерживают более низкий уровень заражения клещами, чем их сородичи в других частях света (18,19). В Европе и Северной Америке также есть несколько уникальных популяций медоносных пчел, которые выжили в течение длительного времени без борьбы с клещами (18,20). Одна из наиболее хорошо изученных популяций медоносных пчел, выживших в условиях клеща варроа, находится на острове Готланд, Швеция (21,22,23,24). В процессе естественного отбора эта популяция адаптировала устойчивые к клещу признаки, которые снижают репродуктивный успех клеща (22,24).
Популяции медоносных пчел также могут по-разному реагировать на вирусные инфекции, переносимые клещом. Недавнее исследование устойчивой к клещу готландской популяции зафиксировало ее выживание при высоком уровне заражения DWV, в то время как местные колонии медоносных пчел, восприимчивые к клещу, при таком же высоком уровне заражения DWV погибли (23). Кроме того, эта популяция, по-видимому, также устойчива на уровне колонии к другим вирусам, которые не обязательно передаются непосредственно клещами варроа, но, тем не менее, наносят вред здоровью медоносных пчел и снижают долгосрочное выживание (23).
Устойчивость — это способность хозяина уменьшить паразитарное/патогенное бремя, тогда как толерантность определяется как способность хозяина уменьшить вред, наносимый паразитом/патогеном (в данном случае смертность, вызванная болезнью) (25). Медоносные пчелы, клещ варроа и инфицирующие медоносную пчелу вирусы, которые также переносятся клещом, образуют сложную многоуровневую систему взаимодействия хозяин-паразит-патоген, что затрудняет выделение специфических эффектов на хозяина, когда все три фактора встречаются вместе. Для лучшего понимания механизмов выживания естественного хозяина в условиях неконтролируемого заражения клещами важно определить, в какой степени они обусловлены устойчивостью/толерантностью к клещу, вирусам, передаваемым клещом, или тем и другим.
Целью данного исследования было оценить возможный вклад устойчивости/толерантности к вирусам в повышение выживаемости Готландской популяции медоносных пчел, устойчивой к клещам (MR), независимо от сбивающего влияния паразитизма клещей варроа. Мы исключили прямое влияние варроа на титры вирусов и сравнили восприимчивость отдельных личинок и вновь появившихся взрослых пчел из Готландской популяции, устойчивой к клещам (MR), к пероральному заражению ABPV или DWV по сравнению с пчелами из восприимчивой к клещам популяции (MS) в лабораторных исследованиях с временными циклами заражения вирусами. Восприимчивость к вирусу определялась путем сравнения титров вируса у пчел, инокулированных вирусом, относительно фоновых титров вируса до эксперимента и естественного развития инфекции у неинокулированных контрольных пчел в течение всего временного цикла. Это послужило основой для сравнения восприимчивости к вирусу популяций MR и MS, каждая из которых была представлена пчелами из нескольких независимых колоний. Для эксперимента по заражению взрослых особей регистрировалась смертность пчел с течением времени, а также титры вируса в мертвых пчелах.
Результаты
Эксперимент по заражению личинок
Не было обнаружено различий между личинками MR и MS в восприимчивости к DWV или ABPV в любое время в течение экспериментального периода (рис. 1; табл. 1; рис. S1). Кроме того, не было обнаружено существенных различий между личинками MR и MS в уровнях фоновой инфекции DWV или ABPV в 0 ч до начала эксперимента (рис. 1; табл. 2). Как при инокуляции DWV, так и при инокуляции ABPV инфекция развивалась успешно, поскольку титр вируса увеличивался после нулевой временной точки и был значительно повышен на протяжении всего временного цикла по сравнению с неинокулированным контролем (рис. 1; табл. 1). В эксперименте по заражению DWV наблюдалось небольшое увеличение титров со временем после 24 ч (рис. 1), что свидетельствует о том, что инфекция еще не достигла фазы плато. В эксперименте по заражению ABPV не наблюдалось дальнейшего увеличения титров ABPV после 24 ч (рис. 1), что говорит о том, что инфекция достигла максимального верхнего предела в этой временной точке.

| Идентификатор модели | Стадия жизни | Переменная ответа | Объясняющие переменные | Χ2 | Df | AICc | кон.R2 | p-value |
| 5 | Личинки | DWV | История колонии | 1.37 | 1 | 332.10 | 0.98 | 0.24 |
| 6 | Личинки | ABPV0.125 | История колонии | 0.59 | 1 | 59.44 | 0.06 | 0.44 |
| 7 | Взрослые | DWV−0.025 | История колонии | 0.67 | 1 | −6.08 | 0.06 | 0.41 |
| 8 | Взрослые | ABPV0.375 | История колонии | 0.76 | 1 | 165.89 | 0.07 | 0.38 |
Таблица 2 Таблицы анализа дисперсии (тест типа III) линейных смешанных моделей, изучающих влияние истории колоний (MR, MS) на титры DWV и ABPV до заражения. Необходимые преобразования переменной отклика указаны.
Кроме того, не было обнаружено существенной разницы в титрах DWV между неинокулированными контрольными личинками и личинками, инокулированными ABPV (рис. 1; табл. S1). И наоборот, не было обнаружено существенной разницы в титрах ABPV между неинокулированными контрольными личинками и личинками, инокулированными DWV (рис. 1; табл. S1). Это говорит о том, что оба вируса не влияют на динамику заражения друг друга и эффективно ведут себя независимо.
Последнее наблюдение заключается в том, что как для DWV, так и для ABPV титры в неинокулированных контролях (и в личинках, инокулированных альтернативным вирусом) снижаются со временем от нулевой временной точки, с минимумом после 72 ч, после чего они снова повышаются, более заметно для DWV, при 120 ч (рис. 1). Именно это снижение уровня фоновой инфекции со временем, а также инокуляция/инфекция являются причиной значительной разницы во времени между инокулированными личинками и неинокулированными/инокулированными альтернативным вирусом контролями (рис. 1; табл. 1; рис. S1).
Эксперимент по заражению взрослых особей
Если в экспериментах по заражению личинок фоновые титры DWV и ABPV в неинокулированных/инокулированных альтернативным вирусом контролях имели тенденцию к снижению со временем (с поздним подъемом), то в экспериментах по заражению взрослых особей наблюдалась обратная тенденция: фоновые титры DWV и ABPV в контролях имели тенденцию к повышению в начальной части временного цикла с небольшим последующим снижением (рис. 1). Фоновые титры DWV в только что вылупившихся взрослых пчелах до инокуляции, в 0 часов, были довольно высокими как у пчел MR, так и у пчел MS, что затрудняет определение того, оказала ли инокуляция DWV какое-либо дополнительное влияние на титры DWV (рис. 1; табл. 1; табл. 2). Только начиная с 72 часа, пчелы, инокулированные DWV, начинают отличаться в большую сторону от неинокулированных/ABPV-инокулированных контролей и демонстрируют незначительные доказательства того, что инокуляция DWV действительно привела к развитию инфекции (рис. 1). Эксперимент по инокуляции ABPV показывает гораздо более раннее и более четкое разделение в титрах ABPV между пчелами, инокулированными ABPV, и неинокулированными/DWV-инокулированными контрольными пчелами, чему в немалой степени способствовали очень низкие начальные фоновые титры ABPV у только что вылупившихся пчел в 0 часов, что свидетельствует о развитии инфекции в результате инокуляции (Рис. 1; Таблица 1; Таблица 2).
Как и в экспериментах по заражению личинок, не было обнаружено существенной разницы между пчелами MR и MS ни в одной из этих временных моделей, ни для эксперимента по заражению DWV, ни для эксперимента по заражению ABPV (Рис. 1; Таблица 1; Рис. S1), ни для инокулированных пчел и неинокулированных/альтернативно инокулированных вирусом контрольных пчел (Рис. 1; Таблица 1; Таблица S1). Титры DWV и ABPV не отличались между историями колоний до начала экспериментов (Таблица 2). Также, как и в экспериментах по заражению личинок, не было обнаружено существенных различий в динамике развития DWV между неинокулированными и инокулированными ABPV, а также в динамике развития ABPV между неинокулированными и инокулированными DWV пчелами, что еще раз говорит о том, что эти два вируса оказывают незначительное влияние на динамику заражения друг друга (рис. 1; табл. S1; рис. S2). Не было обнаружено различий в титрах DWV между мертвыми и живыми взрослыми пчелами (рис. 2; табл. 2). Аналогичный результат наблюдался и для ABPV, за исключением того, что в точке отбора проб через 72 часа титры ABPV были немного выше у мертвых взрослых особей, чем у живых (рис. 2; табл. 2).

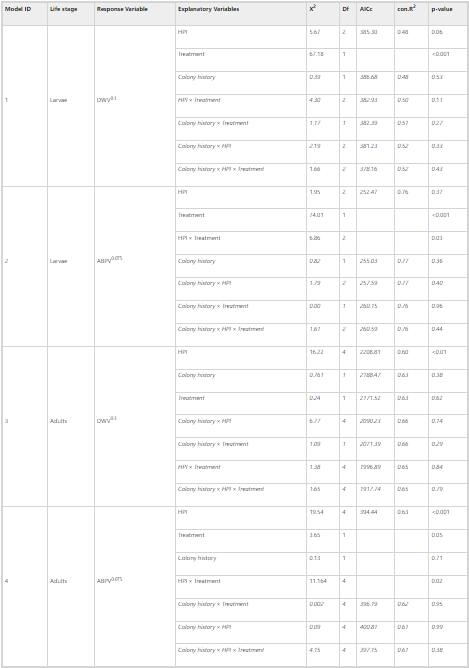
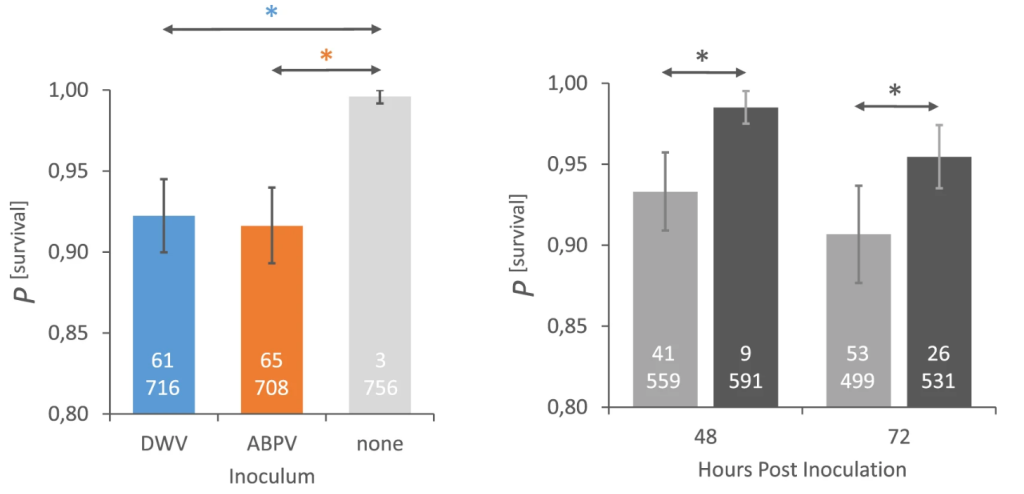
Единственный аспект в этих вирусных экспериментах, где существует четкое различие между пчелами MR и MS, — это выживаемость взрослых пчел, инокулированных вирусом (рис. 3; табл. 3; табл. S2). Как у пчел, инокулированных DWV, так и ABPV, выживаемость пчел MR значительно выше, чем у пчел MS, как через 48 ч, так и через 72 ч (рис. 3). Разница в вероятности выживания пчел, инокулированных DWV или ABPV, в обеих популяциях пчел вместе взятых незначительна (рис. 3), но очень четко прослеживается снижение вероятности выживания инокулированных DWV/ABPV пчел по сравнению с неинокулированными контрольными пчелами (рис. 3).
| Идентификатор модели | Стадия жизни | Переменная ответа | Объясняющие переменные | Χ2 | Df | AICc | кон.R2 | p-value |
| 9 | Взрослые | Выживаемость (жив/мертв) | HPI | 9.50 | 1 | 152.48 | 0.45 | <0.01 |
| 9 | Взрослые | Выживаемость (жив/мертв) | Лечение | 28.86 | 2 | <0.001 | ||
| 9 | Взрослые | Выживаемость (жив/мертв) | История колонии | 16.53 | 1 | <0.001 | ||
| 9 | Взрослые | Выживаемость (жив/мертв) | История колонии × HPI | 3.11 | 1 | 152.09 | 0.46 | 0.07 |
| 9 | Взрослые | Выживаемость (жив/мертв) | История колонии × Лечение | 0.01 | 2 | 156.53 | 0.96 | 0.99 |
| 9 | Взрослые | Выживаемость (жив/мертв) | HPI × Лечение | 0.79 | 2 | 162.65 | 0.96 | 0.67 |
| 9 | Взрослые | Выживаемость (жив/мертв) | История колонии × HPI × Лечение | 0.60 | 2 | 169.85 | 0.96 | 0.73 |
Обсуждение
Основным результатом этих экспериментов является отсутствие разницы в восприимчивости к DWV или ABPV инфекции между пчелами из популяции MR и пчелами из популяции MS, как для взрослых пчел, так и для личинок. Однако смертность инфицированных вирусом взрослых особей из популяции MR значительно ниже, чем инфицированных вирусом взрослых особей из популяции MS, без существенных различий между пчелами, инфицированными ABPV или DWV. Разницы в смертности между неинфицированными пчелами из популяций MR и MS не было. Выживаемость личинок оценить не удалось, поскольку экспериментальная доза вируса была оптимизирована для предотвращения гибели личинок, чтобы можно было отслеживать динамику инфекции и наблюдать любые различия в восприимчивости к вирусу.
Другим важным результатом этих экспериментов является то, что пероральная инокуляция DWV не влияет на динамику фоновой инфекции ABPV и наоборот, как для личинок, так и для взрослых особей, т.е. вирусы не конкурируют и не мешают друг другу. Это подтверждает результаты более ранних исследований, показавших, что различные пчелиные вирусы вызывают совершенно разные транскрипционные реакции и биологические процессы после оральной инокуляции (26), и что различные вирусы одинаково хорошо развиваются как в изоляции, так и при коинокуляции с другими вирусами (26). Многие пчелиные вирусы также демонстрируют высокую тканеспецифичность (27) , поэтому любая временно-пространственная изоляция вирусов снижает прямую конкуренцию на молекулярном уровне. Возможные генетические изменения инокулированных вирусов в течение времени, а также любые молекулярные взаимодействия с хозяином или другими инокулированными или фоновыми вирусами являются предметом продолжающихся исследований.
Последним важным результатом является форма кривых заражения неинокулированных и инокулированных вирусами контролей. Они сильно отличаются для личинок и взрослых особей, а также немного отличаются для пчел, привитых DWV или ABPV, но очень похожи для различных популяций и между неинокулированными и альтернативными группами, привитыми вирусом, кроме того, данные получены от многих различных колоний. Хотя во временном интервале наблюдались различия в уровнях экспрессии мРНК нашего внутреннего референсного гена RP49, они были незначительными по сравнению с логарифмическими колебаниями в титрах вируса за тот же период времени, и поэтому не влияли на форму кривых. Поскольку они представляют собой инфекции наименее подверженных манипуляциям пчел, они представляют особый интерес для выявления естественного взаимодействия между вирусами и их хозяевами. В настоящее время у нас нет объяснения, почему естественные титры DWV и ABPV у личинок должны снижаться, а затем повышаться, или почему у взрослых пчел они должны повышаться, затем снижаться, а затем выравниваться. Этот материал в настоящее время является предметом дальнейшего исследования. Последний момент, который требует разъяснения, это относительно высокий начальный титр DWV в только что вылупившихся взрослых пчелах популяций MR и MS, или, если на то пошло, вообще любой фоновый DWV и ABPV, учитывая, что исходные колонии были получены из свободных от варроа Аландских островов (28,29) и предположительно были свободны от DWV и ABPV, учитывая Аландскую историю без вирусов (Doublet и др. неопубликованные данные). Поскольку материал 0 hpi никогда не подвергался воздействию вируса в лаборатории, наше лучшее объяснение заключается в том, что эти колонии стали зараженными в течение 2 месяцев, которые были необходимы для переворота популяций пчел после введения маток MR и MS. Учитывая их происхождение (23,30), эти матки, несомненно, были заражены по крайней мере DWV, который эффективно передается через яйца полученному потомству (12,13,31), а также остальным членам колонии через уход за личинками и социальные взаимодействия (32,33). Тем не менее, любые приобретенные таким образом вирусные инфекции были бы сходными для всех пчел и экспериментальных групп в нашем исследовании и являлись бы частью молекулярного фона, на который накладываются экспериментальные прививки. Взрослых пчел с симптомами DWV не наблюдали во время экспериментов, поскольку симптомы DWV развиваются во время фазы куколки, как правило, в результате передачи вируса варроа. Однако некоторые из взрослых пчел, которым орально инокулировали APBV, были замечены дрожащими, что является симптомом инфекции APBV.
Различия в вирулентности DWV были связаны с разными основными генотипами DWV, причем генотип DWV-A является более распространенным, но менее вирулентным, чем генотип DWV-B (34). Лабораторные эксперименты показали, что генотип DWV-B преимущественно передается варроа и через инъекции по сравнению с генотипом DWV-A (35). Сохранение обоих штаммов в природных колониях свидетельствует о важности других путей передачи, таких как оральный и половой, для поддержания этого баланса (13,36), а также о различных последствиях вирулентности на уровне отдельных пчел и колонии. Подобные различия в вирулентности и инфекционности также были описаны для членов ABPV-комплекса (ABPV, KBV, IAPV) в связи с различными путями передачи и различными последствиями для индивидуальной смертности и смертности на уровне колонии (10). Хотя мы не можем исключить возможное взаимодействие инокулированных вирусов с фоновыми вирусными инфекциями или молекулярным состоянием хозяина (что будет предметом отдельного исследования), основное внимание в данном исследовании уделяется тому, как эти экспериментальные вирусные инфекции по-разному влияют на пчел из колоний MR и MS, как через временной цикл инфекции, так и через смертность взрослых особей.
Повышенная выживаемость зараженных вирусом взрослых пчел из готландской популяции MR по сравнению с пчелами из популяции MS, несмотря на практически одинаковую восприимчивость к вирусным инфекциям в течение всего периода заражения DWV и ABPV, позволяет предположить, что толерантность хозяина, а не устойчивость, является важным компонентом естественно адаптированных механизмов выживания этой популяции, и что их индивидуальная реакция толерантности на вирусные инфекции дополняет более ранние работы, демонстрирующие толерантность колонии к DWV (23). В животноводстве толерантность является высокоэффективным механистическим ответом на болезнь, но часто игнорируется, особенно при наличии резистентности (25). Адаптации толерантности не наносят вреда паразиту, в отличие от резистентности, поэтому ожидается, что они закрепятся в популяции, а не вызовут бессрочную антагонистическую коэволюцию, как в случае с эволюцией резистентности (25). Толерантность к вирусным инфекциям была продемонстрирована на предыдущих поколениях в популяции медоносной пчелы Gotland MR и в различных географических регионах (23), поэтому, по-видимому, она имеет генетический наследуемый компонент. Неясно, существуют ли затраты на приспособленность хозяина, связанные с этой устойчивостью к вирусу, и в какой степени эта устойчивость к вирусу влияет на общее долгосрочное выживание популяции по сравнению с механизмами устойчивости, которые ограничивают рост популяции клещей варроа.
Хозяин медоносной пчелы имеет уникальную социальную организацию, которая представляет свою собственную сложность в этой системе с несколькими уровнями возможных взаимодействий хозяин-паразит и адаптации к паразитам и инфекциям болезни. Устойчивость на индивидуальном уровне может переходить в толерантность на уровне колонии и наоборот (37). Например, несмотря на устойчивость на индивидуальном уровне, заключающуюся в подавлении размножения клещей, уровень заражения варроа на уровне колонии в готландской популяции медоносных пчел может оставаться высоким (22,23), что говорит о том, что другие факторы могут способствовать естественному долгосрочному выживанию популяции. Результаты этого исследования показывают, что толерантность, а не резистентность, играет важную роль в защите от вирусных инфекций, переносимых варроа, на обоих уровнях организации колоний этой популяции (23). В отличие от нашего исследования, снижение восприимчивости к вирусным инфекциям наблюдалось у саванных медоносных пчел в Африке (38) и у селекционно выведенных клещеустойчивых медоносных пчел по сравнению с неселекционными линиями в США (39). Однако в этих исследованиях не исключалось влияние клеща-переносчика вируса варроа на вирусные инфекции, что, вероятно, могло повлиять на их результаты. Различия между этими исследованиями лишь демонстрируют возможность различной адаптивной реакции популяций медоносных пчел на вирусные инфекции, что можно было бы ожидать при различных условиях окружающей среды (40,41). В настоящее время ведутся работы по изучению устойчивости к вирусам и защитного механизма толерантности в других уникальных популяциях, естественно адаптированных к клещам, а также по оценке возможности включения механизмов реагирования на вирусы в селекционные программы для улучшения здоровья пчел и устойчивого пчеловодства.
В заключение следует отметить, что особи готландской популяции пчел MR выживают лучше, чем пчелы MS, имея более высокий порог для вирусных инфекций, прежде чем здоровье пчел будет подорвано. Эта повышенная устойчивость к вирусам у пчел MR на индивидуальном уровне подтверждает ранее предполагаемую устойчивость к вирусам на уровне колоний (23,30), но без учета сбивающего влияния заражения клещом варроа и факторов окружающей среды, например, различной динамики развития колоний между пчелами MR и MS (22). Более того, наблюдаемая толерантность к вирусу в равной степени и одинаково применима к DWV- или ABPV-инфицированным пчелам, что позволяет предположить, что механизм толерантности может быть в основном общим, а не специфичным для вируса.
Материалы и методы
Происхождение и управление колониями медоносных пчел
Устойчивые к клещам (MR) пчелы произошли от изолированной популяции на острове Готланд, Швеция, которая выживала без обработки против клещей с 1999 года. Эта популяция была создана в качестве эксперимента по селекции на выживание медоносных пчел с новым инвазивным паразитом (21) и продемонстрировала целый ряд адаптаций, которые позволяют им выживать в условиях заражения клещом варроа (22,23). Восприимчивые к клещу (MS) медоносные пчелы происходили из местной неизбирательной популяции медоносных пчел вблизи Упсалы, которая нуждалась в регулярных мерах борьбы с клещом варроа, чтобы избежать гибели колонии. Шесть открытых маток из каждой популяции были помещены в небольшие 6-рамочные экспериментальные колонии, заселенные равным количеством медоносных пчел с Аландских островов, группы островов между Швецией и Финляндией. Аландские острова до сих пор полностью свободны от клещей варроа (28,29) и имеют необнаруженные уровни как DWV, так и ABPV в общих исследованиях (Doublet et al. неопубликованные данные), поэтому эти пчелы обеспечили идеальный экспериментальный фон для экспериментов по заражению вирусом, поскольку они никогда не подвергались воздействию вируса или переносчика. Эксперименты не начинались до тех пор, пока все особи в каждой колонии не стали потомством интродуцированных маток; примерно через 2 месяца после интродукции маток.
Подготовка и оптимизация вирусного материала
Инокуляты DWV и ABPV для экспериментов по оральному заражению были подготовлены путем размножения эталонных запасов вирусов DWV-A и ABPV в пятидесяти белоглазых куколках из колоний Аландских островов, свободных от варроа (см. выше). Каждой куколке вводили 1 микролитр разведения 1/10000 очищенной концентрированной вирусной массы (эквивалентно примерно 103 копиям вирусного генома на пчелу) в соответствии со стандартной процедурой размножения куколок (15). Из этих 50 куколок был получен осветленный неочищенный экстракт путем гомогенизации куколок в блендере с 10 мл 0,5 М фосфатного буфера, pH 8,0 (DWV) или 10 мл 0,01 М фосфатного буфера, pH 7,0 (ABPV), и хранился в 50 мкл аликвотах при -80 °C (15). Эти неочищенные экстракты использовались для экспериментов по заражению вирусами. Вирусологический состав размноженных запасов вирусов был определен с помощью RT-qPCR анализов для семи распространенных вирусов пчел, которые могут быть размножены путем инъекции (13): DWV-A, DWV-B, ABPV, IAPV, KBV, вирус сакбуд (SBV) и вирус черной маточной клетки (BQCV). Используя набор кДНК MuMLV 1st strand (ThermoFisher, Waltham, MA, USA), случайная гексамер-праймированная кДНК была приготовлена из 1 мкг РНК, выделенной из размноженного инокулята, к которому добавили 25 нг РНК250 (ThermoFisher, Waltham, MA, USA) в качестве экзогенной референсной РНК для нормализации относительных титров вирусов относительно общего фиксированного стандарта. Из каждой кДНК была сделана серия шестиступенчатых 10-кратных разведений, которые использовались в качестве шаблонов для реакций qPCR, специфичных для вирусов. Серии разведений использовались для получения эффективности реакции различных анализов. Эти эффективности реакции затем использовались для оценки относительного количества каждого вируса в каждом разведении кДНК по отношению к общему фиксированному стандарту РНК250 (42). Для построения круговых диаграмм на Дополнительном рис. S3 использовали среднее значение этих множественных оценок относительного количества каждого вируса в каждом инокуляте.
Инфекционность этих неочищенных экстрактов была проверена в экспериментах по оптимизации, чтобы определить оптимальную дозу для экспериментов, используя показатели смертности личинок и взрослых особей в качестве критериев оптимизации. Оптимальная доза вируса определялась как наибольшая доза одного вируса, которая не вызывала гибели личинок или взрослых пчел до 96 часов после инокуляции (hpi). Этот критерий выбора дозы использовался для того, чтобы можно было изучить динамику заражения вирусом на ранних (нелетальных) стадиях, а также возможную последующую дифференциальную смертность между устойчивыми к клещу и восприимчивыми к клещу пчелами. Оптимальная доза однократной инокуляции для личинок составила 1,5 ± × 108 эквивалентов генома DWV и 5,4 ± × 107 эквивалентов генома ABPV, а для взрослых особей — 6,0 ± × 108 эквивалентов генома DWV и 2,1 ± × 108 эквивалентов ABPV, как было определено с помощью RT-qPCR анализа сырых экстрактов. Эти уровни соответствуют предыдущим оценкам инфекционных доз для этих вирусов (15,17,43,44).
Схема эксперимента
Эксперименты по заражению проводились отдельно на только что появившихся взрослых пчелах и на только что вылупившихся личинках. Каждый эксперимент по заражению состоял из нескольких повторных опытов по заражению для каждой колонии MR и MS, включенной в эксперимент (Таблица S3). По возможности, одни и те же колонии MR и MS использовались для экспериментов с личинками и взрослыми особями. Каждое инфекционное испытание состояло из одной когорты пчел, инокулированных DWV, одной когорты пчел, инокулированных ABPV, и одной когорты неинокулированных контрольных пчел. Стратегия инокуляции состояла в том, что пчел кормили одной инфекционной дозой в течение короткого периода, а затем незараженным кормом в течение оставшегося времени. Такая стратегия заражения гарантирует, что любое увеличение титра вируса в течение времени представляет собой вновь возникшую инфекцию, а не пассивное накопление инокулята вируса, как это было бы в случае непрерывной инокуляции. Из каждой когорты пчел в каждом инфекционном испытании отбирали образцы взрослых пчел через 0, 12, 24, 48, 72 и 120 часов после инокуляции (hpi) и образцы личинок через 0, 24, 72 и 120 hpi, представляя временной ход. Эксперименты проводились в июле-августе 2016 года (личинки) и августе-сентябре 2016 года (взрослые особи).
Эксперименты по заражению личинок in-vitro
Эксперименты по заражению личинок проводились на личинках из 4 колоний MR и 4 колоний MS. Каждый эксперимент по заражению повторяли не менее двух раз, в зависимости от наличия личинок из соответствующей колонии. Личинки аналогичного возраста были получены путем помещения маток из экспериментальных колоний в одну рамку на 24 часа для откладки яиц. Личинок первого возраста (в возрасте 24-36 часов) прививали с помощью китайского прививочного инструмента (Bienenzuchtgeräte, Graze, Weinstadt, Германия) в отдельные лунки 48-луночных планшетов для культуры тканей (Falcon™ Polystyrene Microplates), Каждая лунка содержала 10 мкл предварительно подогретого корма для личинок, состоящего из 50% маточного молочка (Vceli Produkty, Недасов, Чешская Республика) и 50% водного раствора D-глюкозы (12%), D-фруктозы (12%) и дрожжевого экстракта (2%) (45), в соответствии со стандартными методами выращивания личинок (46). В каждую ячейку прививали дополнительных личинок, чтобы компенсировать любую смертность в результате процедуры прививки. Личинок предварительно инкубировали в течение 24 часов при температуре 35 °C и относительной влажности 96%, после чего все мертвые и лишние личинки были удалены, так что для эксперимента по заражению было оставлено 48 живых личинок, по одной на лунку. Смертность личинок в результате процедуры прививки обычно не превышала 20%. Жизнеспособные личинки (возрастом около 48 часов) затем кормились личиночным кормом. Для когорт личинок, которые должны были быть инокулированы вирусом, в корм для личинок добавляли оптимальную разовую инфекционную дозу DWV или ABPV, как было определено выше. Личинок кормили ежедневно в соответствии с установленными протоколами (46) , и все мертвые личинки удалялись. При каждом отборе проб (см. выше) по 4 живых личинки из каждой когорты заражения собирали в микроцентрифужные пробирки и хранили при -20 °C до дальнейшего анализа (47).
Эксперименты по заражению взрослых пчел в клетках
Эксперименты по заражению взрослых пчел проводились на только что появившихся взрослых пчелах из 5 колоний MR и 3 колоний MS. Каждый опыт по заражению повторяли от 1 до 4 раз, в зависимости от наличия только что вылупившихся взрослых пчел из соответствующей колонии. Пчел выводили на клетках в инкубаторе при постоянной температуре 35 °C и относительной влажности 96% (48). Для каждой когорты инокуляции пятьдесят недавно появившихся взрослых особей из каждой колонии помещали в отдельные клетки для маток Lyson (Łyson, Клеча Дольна, Польша) и в течение 24 часов кормили оптимальной дозой DWV и ABPV при инокуляции (как описано выше) в 2 мл Bifor®, 66%-ного сахарного раствора для коммерческих медоносных пчел с соотношением сахарозы/фруктозы/глюкозы 2/1/1 (Nordic Sugar A/S, Копенгаген, Дания), а контрольные пчелы получали только Bifor®. После инокуляции все когорты пчел кормили незагрязненным Bifor® ad libitum в течение оставшегося периода времени. При каждом отборе проб (см. выше) и для каждой когорты инфекции все мертвые пчелы были подсчитаны и удалены, оставив 5 пчел для анализа, а 5 живых пчел также были отобраны. Образцы живых и мертвых пчел хранились при температуре -20 °C до дальнейшего анализа.
Обработка образцов и анализы RT-qPCR
Каждый экспериментальный образец, содержащий либо 4 личинки, либо 5 взрослых пчел, помещали в сетчатый мешок и измельчали в порошок с помощью жидкого азота и пестика. Первичный гомогенат был получен путем добавления 200 мкл/пчелу стерильной воды к каждому измельченному образцу и энергичного перемешивания (47). Тотальную РНК выделяли из 100 мкл этого гомогената с помощью робота QiaCube, следуя протоколу RNAeasy для растений (Qiagen). РНК элюировали в 50 мкл воды, не содержащей РНК, концентрацию РНК оценивали с помощью NanoDrop, а очищенную РНК хранили при -80 °C до дальнейшей обработки.
Количество РНК DWV и ABPV, а также мРНК RP49 (внутренний референсный ген медоносной пчелы, обычно используемый для нормализации различий между образцами по количеству и качеству РНК (15)) определяли с помощью количественной ПЦР с обратной транскрипцией (RT-qPCR), используя набор iScript One Step RT-PCR kit (Bio-Rad) с SYBR Green в качестве детектирующей химии и термоциклер Bio-Rad CFX connect. Реакции проводили в объемах 20 мкл, содержащих 0,2 мкМ прямого и обратного праймеров (Таблица S4), 3 мкл РНК, 10 мкл SYBR Green RTmix и 0,4 мкл обратной транскриптазы iScript. Профиль термоциклирования для обоих анализов был следующим: 10 мин при 50 °C для синтеза кДНК, 5 мин при 95 °C для инактивации обратной транскриптазы, затем 40 циклов по 10 сек. при 95 °C для денатурации и 30 сек. при 58 °C для отжига/экстензии и сбора данных. За амплификацией немедленно следовал анализ кривой плавления для подтверждения идентичности продуктов амплификации путем инкубации при 60 сек: 95 °C, 60 сек. 65 °C и считывания флуоресценции с шагом 0,5 °C между 65 °C и 95 °C. Для каждого анализа на каждом реакционном планшете проводили серию 10-кратных серийных разведений положительного клонированного (плазмидного) контроля с известной концентрацией, а также отрицательного (водного) контроля для создания калибровочных кривых для абсолютного количественного определения, что выполнялось с помощью программного обеспечения BioRad CFX. Перед включением в количественный анализ все положительные ПЦР-амплификации проверялись на идентичность продуктов путем визуального осмотра их характерных кривых плавления.
Преобразование данных и статистический анализ
Для каждого отдельного образца необработанные титры DWV и ABPV делились на конкретное расчетное количество мРНК RP49 в образце и умножались на среднее количество мРНК RP49 для всего эксперимента. Это было сделано для личиночной или взрослой инфекции соответственно, чтобы нормализовать данные с учетом специфических для образца различий в качестве и количестве РНК (49,50). В ходе всего эксперимента не было обнаружено последовательной связи между наблюдаемыми титрами вируса и эталонными уровнями мРНК RP49, что подтверждает использование мРНК RP49 для нормализации титров вируса (рис. S4). Затем это значение умножали на различные коэффициенты разбавления, возникающие при обработке и анализе, чтобы получить расчетные нормализованные титры DWV и ABPV для каждой отдельной пчелы. Эти нормализованные титры DWV и ABPV со временем колебались на пять (DWV) и восемь (ABPV) порядков величины, что является нормальным для фазы роста быстро реплицирующегося (вирусного) патогена (15). Нормализованные титры вирусов были проанализированы с помощью линейных смешанных моделей с использованием программного обеспечения R (51) и пакета lme4. История колонии (MR или MS), обработка (инокулированная или неинокулированная, с соответствующим вирусом) и часы после инокуляции (hpi) были включены в качестве категориальных фиксированных эффектов. Время использовалось в качестве категориальной переменной для проведения парных сравнений и потому, что титры не просто увеличивались/уменьшались в ходе экспериментов. Для учета иерархической структуры данных (несколько выборок одной колонии), выборка была включена как случайный эффект, вложенный в каждую колонию. В анализе использовался тест типа III, поскольку выборка была несбалансированной (разное количество колоний с разным количеством репликаций внутри колоний). Для получения нормально распределенных остатков (проверялось визуально) использовалась функция transformTukey из пакета rcompanion, которая перебирает экспоненты, максимизирующие/минимизирующие статистику Шапиро-Уилкса/Андерсона-Дарлинга. После выполнения статистики с рекомендуемым преобразованием (Таблица 1) значения были обратно преобразованы в исходную шкалу, а затем преобразованы в шкалу log10 для иллюстративных целей. Поскольку титры вируса в нулевой временной точке были взяты до распределения по методам лечения, они были проанализированы отдельно с учетом истории колонии как фиксированного и колонии как случайного эффектов.
Взаимосвязь между количеством мертвых и живых взрослых пчел использовалась для расчета вероятности выживания с помощью биномиального правдоподобия (функция связи logit) и обобщенной линейной смешанной модели с использованием пакета lme4. Масштабные остатки проверялись с помощью пакета DHARMa. Мы проверили, влияют ли история колонии, инокуляция одним из вирусов или время после инокуляции на вероятность выживания.
Для всех моделей использовался тест типа III с функцией Anova из пакета car для пошагового удаления незначимых переменных до получения минимальной адекватной модели. Парные сравнения с поправкой на метод Тьюки (также для моделей, которые все еще включали интересующие взаимодействия) проводились с помощью пакета multcomp. Для получения предсказанных предельных средних по каждой модели использовали пакет lsmeans. Далее рассчитывали условное значение R2, учитывающее фиксированную и случайную части модели, и AIC второго порядка.
Доступность данных
Наборы данных, полученных в ходе настоящего исследования и/или проанализированных в ходе него, можно получить у соответствующего автора по обоснованному запросу.
Ссылки
1.Rundlöf, M. et al. Seed coating with a neonicotinoid insecticide negatively affects wild bees. Nature 521, 77–80 (2015).Article ADS Google Scholar
2.Osterman, J. et al. Clothianidin seed-treatment has no detectable negative impact on honeybee colonies and their pathogens. Nat. Commun. 10, 692 (2019).Article ADS Google Scholar
3.Boecking, O. & Genersch, E. Varroosis — The ongoing crisis in bee keeping. J. fur Verbraucherschutz und Leb. 3, 221–228 (2008).Article Google Scholar
4.Le Conte, Y., Ellis, M. & Ritter, W. Varroa mites and honey bee health: can Varroa explain part of the colony losses? Apidologie 41 (2010).
5.Schroeder, D. C. & Martin, S. J. Deformed wing virus. Virulence 3, 589–591 (2012).Article Google Scholar
6.Mordecai, G. J., Wilfert, L., Martin, S. J., Jones, I. M. & Schroeder, D. C. Diversity in a honey bee pathogen: first report of a third master variant of the Deformed Wing Virus quasispecies. ISME J. 10, 1264–1273 (2016).Article CAS Google Scholar
7.de Miranda, J. R., Cordoni, G. & Budge, G. The Acute bee paralysis virus–Kashmir bee virus–Israeli acute paralysis virus complex. J. Invertebr. Pathol. 103, S30–S47 (2010).Article Google Scholar
8.Martin, S. The role of Varroa and viral pathogens in the collapse of honeybee colonies: a modeling approach. J. Appl. Ecol. 38 (2001).Article Google Scholar
9.Wilfert, L. et al. Deformed wing virus is a recent global epidemic in honeybees driven by Varroa mites. Science (80-.). 351, 594–597 (2016).Article ADS CAS Google Scholar
10.de Miranda, J. R. & Genersch, E. Deformed wing virus. J. Invertebr. Pathol. 103, 48–61 (2010).Article Google Scholar
11.Bowen-Walker, P. L., Martin, S. J. & Gunn, A. The transmission of deformed wing virus between honeybees (Apis mellifera L.) by the ectoparasitic mite Varroa jacobsoni Oud. J. Invertebr. Pathol. 73, 101–6 (1999).Article CAS Google Scholar
12.Yue, C., Schroeder, M., Gisder, S. & Genersch, E. Vertical-transmission routes for deformed wing virus of honeybees (Apis mellifera). J. Gen. Virol. 88 (2007).
13.de Miranda, J. R. & Fries, I. Venereal and vertical transmission of deformed wing virus in honeybees (Apis mellifera L.). J. Invertebr. Pathol. 98, 184–189 (2008).Article Google Scholar
14.Genersch, E. & Aubert, M. Emerging and re-emerging viruses of the honey bee (Apis mellifera L). Vet. Res. 41 (2010).
15.de Miranda, J. R. et al. Standard methods for virus research in Apis mellifera. J. Apic. Res. 52, 1–56 (2013).Article ADS Google Scholar
16.Amiri, E. et al. Quantitative patterns of vertical transmission of deformed wing virus in honey bees. PLoS One 13, e0195283 (2018).Article Google Scholar
17.Moeckel, N., Gisder, S. & Genersch, E. Horizontal transmission of deformed wing virus: pathological consequences in adult bees (Apis mellifera) depend on the transmission route. J. Gen. Virol. 92 (2011).
18.Locke, B. Natural Varroa mite-surviving Apis mellifera honeybee populations. Apidologie 47, 467–482 (2016).Article Google Scholar
19.Rosenkranz, P., Aumeier, P. & Ziegelmann, B. Biology and control of Varroa destructor. J. Invertebr. Pathol. 103, S96–S119 (2010).Article Google Scholar
20.Oddie, M. et al. Rapid parallel evolution overcomes global honey bee parasite. Sci. Rep. 8, 7704 (2018).Article ADS Google Scholar
21.Fries, I., Imdorf, A. & Rosenkranz, P. Survival of mite infested (Varroa destructor) honey bee (Apis mellifera) colonies in a Nordic climate. Apidologie 37, 564–570 (2006).Article Google Scholar
22.Locke, B. & Fries, I. Characteristics of honey bee colonies (Apis mellifera) in Sweden surviving Varroa destructor infestation. Apidologie 42, 533–542 (2011).Article Google Scholar
23.Locke, B., Forsgren, E. & de Miranda, J. R. Increased Tolerance and Resistance to Virus Infections: A Possible Factor in the Survival of Varroa destructor-Resistant Honey Bees (Apis mellifera). PLoS One 9, e99998 (2014).Article ADS Google Scholar
24.Locke, B. Inheritance of reduced Varroa mite reproductive success in reciprocal crosses of mite-resistant and mite-susceptible honey bees (Apis mellifera). Apidologie 47, 583–588 (2016).Article Google Scholar
25.Råberg, L., Graham, A. L. & Read, A. F. Decomposing health: tolerance and resistance to parasites in animals. Philos. Trans. R. Soc. B 364, 37–49 (2009).Article Google Scholar
26.Ryabov, E. V., Fannon, J. M., Moore, J. D., Wood, G. R. & Evans, D. J. The Iflaviruses Sacbrood virus and Deformed wing virus evoke different transcriptional responses in the honeybee which may facilitate their horizontal or vertical transmission. PeerJ 4, e1591 (2016).Article Google Scholar
27.Fievet, J. et al. Localization of deformed wing virus infection in queen and drone Apis mellifera L. Virol. J. 3, 16 (2006).Article Google Scholar
28.European Commission. Commission Implementing Decision of 11 October 2013 recognising parts of the Union as free from varroosis in bees and establishing additional guarantees required in intra-Union trade and imports for the protection of their varroosis-free status. Off. J. Eur. Union 273 (2013).
29.More, S. et al. Assessment of listing and categorisation of animal diseases within the framework of the Animal Health Law (Regulation (EU) No 2016/429): infestation with Varroa spp. (varroosis). EFSA J. 15 (2017).
30.Thaduri, S., Locke, B., Granberg, F. & de Miranda, J. R. Temporal changes in the viromes of Swedish Varroa-resistant and Varroa-susceptible honeybee populations. PLoS One 13, e0206938 (2018).Article Google Scholar
31.Amiri, E., Meixner, M. D. & Kryger, P. Deformed wing virus can be transmitted during natural mating in honey bees and infect the queens. Sci. Rep. 6, 33065 (2016).Article ADS CAS Google Scholar
32.Yue, C. & Genersch, E. RT-PCR analysis of Deformed wing virus in honeybees (Apis mellifera) and mites (Varroa destructor). J. Gen. Virol. 86, 3419–3424 (2005).Article CAS Google Scholar
33.Chen, Y., Evans, J. & Feldlaufer, M. Horizontal and vertical transmission of viruses in the honey bee, Apis mellifera. J. Invertebr. Pathol. 92, 152–159 (2006).Article Google Scholar
34.McMahon, D. P. et al. Elevated virulence of an emerging viral genotype as a driver of honeybee loss. Proc. R. Soc. B Biol. Sci. 283, 20160811 (2016).Article Google Scholar
35.Ryabov, E. V. et al. A virulent strain of deformed wing virus (DWV) of honeybees (Apis mellifera) prevails after Varroa destructor-mediated, or in vitro, transmission. PLoS Pathog. 10, e1004230 (2014).Article Google Scholar
36.Locke, B., Semberg, E., Forsgren, E. & de Miranda, J. R. Persistence of subclinical deformed wing virus infections in honeybees following Varroa mite removal and a bee population turnover. PLoS One 12, e0180910 (2017).Article Google Scholar
37.Kurze, C., Routtu, J. & Moritz, R. F. A. Parasite resistance and tolerance in honeybees at the individual and social level. Zoology 119, 290–297 (2016).Article Google Scholar
38.Strauss, U., Human, H., Gauthier, L., Crewe, R. & Dietemann, V. Seasonal prevalence of pathogens and parasites in the savannah honeybee (Apis mellifera scutellata). J. Invertebr. Pathol. 114 (2013).
39.Khongphinitbunjong, K. et al. Responses of Varroa -resistant honey bees (Apis mellifera L.) to Deformed wing virus. J. Asia. Pac. Entomol. 19, 921–927 (2016).Article Google Scholar
40.Locke, B., Le Conte, Y., Crauser, D. & Fries, I. Host adaptations reduce the reproductive success of Varroa destructor in two distinct European honey bee populations. Ecol. Evol. 2, 1144–1150 (2012).Article Google Scholar
41.Thompson, J. N. The evolution of species interactions. Science 284, 2116–8 (1999).Article CAS Google Scholar
42.Pfaffl, M. W., Horgan, G. W. & Dempfle, L. Relative expression software tool (REST(C)) for group-wise comparison and statistical analysis of relative expression results in real-time PCR. Nucleic Acids Res. 30, 36e–36 (2002).Article Google Scholar
43.Meeus, I., de Miranda, J. R., de Graaf, D. C., Wäckers, F. & Smagghe, G. Effect of oral infection with Kashmir bee virus and Israeli acute paralysis virus on bumblebee (Bombus terrestris) reproductive success. J. Invertebr. Pathol. 121, 64–69 (2014).Article Google Scholar
44.Carrillo-Tripp, J. et al. In vivo and in vitro infection dynamics of honey bee viruses. Sci. Rep. 6, 22265 (2016).Article ADS CAS Google Scholar
45.Aupinel, P. et al. Improvement of artificial feeding in a standard in vitro method for rearing Apis mellifera larvae. Bull. Insectology 58, 107–111 (2005).Google Scholar
46.Crailsheim, K. et al. Standard methods for artificial rearing of Apis mellifera larvae. J. Apic. Res. 52, 1–16 (2013).Article Google Scholar
47.Forsgren, E., Locke, B., Semberg, E., Laugen, A. T. & Miranda, J. Rde Sample preservation, transport and processing strategies for honeybee RNA extraction: Influence on RNA yield, quality, target quantification and data normalization. J. Virol. Methods 246, 81–89 (2017).Article CAS Google Scholar
48.Williams, G. R. et al. Standard methods for maintaining adult Apis mellifera in cages under in vitro laboratory conditions. J. Apic. Res. 52, 1–36 (2013).Article Google Scholar
49.Locke, B., Forsgren, E., Fries, I. & de Miranda, J. R. Acaricide treatment affects viral dynamics in Varroa destructor-infested honey bee colonies via both host physiology and mite control. Appl. Environ. Microbiol. 78, 227–235 (2012).Article CAS Google Scholar
50.Lourenco, A. P., Mackert, A., Cristino, A., dos, S. & Simoes, Z. L. P. Validation of reference genes for gene expression studies in the honey bee, Apis mellifera, by quantitative real-time RT-PCR. Apidologie 39, 372–385 (2008).Article CAS Google Scholar
51.R Core Team. R: A language and environment for statistical computing (2017).
Благодарности
Авторы выражают благодарность Эмилии Семберг, Еве Форсгрен и различным ассистентам в полевых и лабораторных условиях за поддержку в ходе проекта. Эти эксперименты были профинансированы грантами FORMAS, предоставленными Дж.М. и Б.Л. (Днр. 2013-1225) и БЛ (Днр. 2016-00481).
Информация об авторах
Авторы и аффилиации
Кафедра экологии, Шведский университет сельскохозяйственных наук, 75007, Упсала, Швеция
Шринивас Тадури, Йорг Г. Стефан, Йоахим Р. де Миранда и Барбара Лок
Вклад
Разработка концепции: С.Т., Дж.М. и Б.Л.; методология: Дж.М., С.Т.; валидация: Дж.М., С.Т. и Б.Л.; исследование: С.Т.; формальный анализ: Дж.С.; обработка данных: С.Т., Дж.М.; написание: С.Т., Б.Л., Дж.С. и Дж.М.; редактирование: все; визуализация: Дж.М., Дж.С.; руководство: Дж.М., Б.Л.; администрирование проекта: Дж.М.; получение финансирования: J.M., B.L. Все авторы прочитали и одобрили окончательный вариант рукописи.
Автор-корреспондент
Переписка с Барбарой Лок.
Этические декларации
Конкурирующие интересы
Авторы заявляют об отсутствии конкурирующих интересов.
Дополнительная информация
Примечание издателя: Springer Nature сохраняет нейтралитет в отношении юрисдикционных претензий в опубликованных картах и институциональной принадлежности.
Дополнительная информация
Thaduri et al. 2019. Дополнительные рисунки и таблицы
Права и разрешения
Открытый доступ Эта статья лицензирована на условиях международной лицензии Creative Commons Attribution 4.0, которая разрешает использование, совместное использование, адаптацию, распространение и воспроизведение на любых носителях и в любом формате при условии, что вы отдаете должное оригинальному автору (авторам) и источнику, даете ссылку на лицензию Creative Commons и указываете, были ли внесены изменения. Изображения или другие материалы третьих лиц в этой статье включены в статью по лицензии Creative Commons, если иное не указано в кредитной строке к материалу. Если материал не включен в лицензию Creative Commons статьи, а предполагаемое вами использование не разрешено законом или выходит за рамки разрешенного использования, вам необходимо получить разрешение непосредственно у правообладателя. Чтобы ознакомиться с копией этой лицензии, посетите сайт http://creativecommons.org/licenses/by/4.0/.

Добавить комментарий