Аннотация
Молочнокислые бактерии (МКБ) являются хорошо известными полезными ассоциированными с хозяином членами микробиоты человека и животных. Однако LAB-ассоциации беспозвоночных были плохо охарактеризованы, и их функции остаются неясными. Здесь мы показываем, что медоносные пчелы обладают обильной, разнообразной и древней LAB-микробиотой в своей медовой культуре, которая оказывает благотворное влияние на здоровье пчел, защищая их от микробных угроз. Наши исследования LAB у всех существующих видов медоносных пчел и родственных им апидных пчел выявили одну из самых больших коллекций новых видов из родов Lactobacillus и Bifidobacterium, когда-либо обнаруженных у одного насекомого, и предполагают длительную (>80 млн лет назад) историю ассоциации. Микробиота, связанная с пчелами, выделяет Lactobacillus kunkeei в качестве доминирующего члена LAB. Эти бактерии, обладающие мощными антимикробными свойствами, приобретаются молодыми работниками медоносных пчел от сородичей и сохраняются в культуре в биопленках, хотя методы управления пчеловодством могут негативно влиять на эту микробиоту. Профилактические методы, повышающие уровень LAB, или дополнительное кормление LAB могут использоваться в комплексных подходах к устойчивому предоставлению услуг опылителей. Мы ожидаем, что эта микробиота займет центральное место в исследованиях здоровья медоносных пчел, включая распад колоний, и станет образцовым примером симбиоза насекомых и микробов.
Введение
Симбиоз широко распространен в природе, в которой симбионты как комменсалы или мутуалисты эволюционировали, чтобы приносить пользу друг другу. Культурно-независимые исследования микробиоты человека недавно выявили сложную симбиотическую среду с более чем 1 000 бактериальных филотипов, представляющих более 7 000 штаммов [1]. Предполагается, что состав этой микробиоты является результатом высоко коэволюционного симбиоза и комменсализма под влиянием питания, физиологии и иммунологических факторов [2], [3].
Кишечник насекомых был описан как самый большой неисследованный резервуар микробиологического разнообразия [4]. Рю и коллеги [5] установили важность нормальной флоры в кишечнике плодовой мушки для поддержания здоровья. Эта небольшая микробиота была достаточной для подавления роста патогенов. Хотя насекомые имеют меньшее количество симбионтов по сравнению с человеком, они могут быть даже более важными [6]. Исследования показали, что симбиоз между социальными насекомыми и микробными видами часто имеет высокую степень коэволюции [7] и что эти симбионты эволюционно формируются иначе, чем симбионты одиночных организмов, которые обычно не имеют гомеостатической крепостной среды [8].
Молочнокислые бактерии (МКБ) встречаются в качестве комменсалов в организме человека, насекомых и животных [9]. Они представляют собой важную группу бактерий для пищевой промышленности и ферментации молочных продуктов. Кроме того, штаммы LAB признаны безопасными (GRAS) пищевыми микроорганизмами и используются в качестве пробиотиков, укрепляющих здоровье человека [10], [11]. Роды LAB функционально связаны между собой по фенотипическим характеристикам [12] и считаются полезными организмами, которые обычно встречаются как экзогенные, так и эндогенные микробы у здоровых людей. Известно, что LAB, обитающие в организме человека и животных в качестве комменсалов, защищают своих хозяев посредством антимикробных метаболитов и модуляции иммунного ответа хозяина [13], [14]. Одним из наиболее важных родов LAB является Lactobacillus, который постоянно обсуждается в рамках таксономических исследований и в настоящее время включает 175 видов [15].
Мы обнаружили довольно специфическую симбиотическую микробиоту молочнокислых бактерий (LAB) в медовом урожае западной медоносной пчелы Apis mellifera [16]. Урожай — это центральный орган в производстве пищи медоносной пчелы, расположенный между пищеводом и желудочком, используемый для сбора и транспортировки нектара в улей. Микробиота роев A. mellifera состоит из 13 видов бактерий, относящихся к родам Lactobacillus и Bifidobacterium [16], [17], [18] и играет ключевую роль в производстве меда [16] и пчелиного хлеба [19], долго хранящегося корма как для взрослых медоносных пчел, так и для личинок. Наши недавние исследования подвидов A. mellifera также продемонстрировали, что микробиота LAB является единой в родном и интродуцированном ареале [17].
Метагеномика была использована для выявления богатого разнообразия микробов в организме медоносных пчел, страдающих от распада колоний (ПЗК) [20], включая новые патогены (например, Nosema ceranae и вирусы) [21], а недавние исследования выявили новые роды бактерий в кишечном тракте пчел независимыми от культуры методами [20], [22], [23]. Некоторые из них могут представлять собой важные симбионты для поддержания здоровья пчел; однако эти описательные методы не дают информации о функциональной роли или важности микробиоты пчелиной культуры или отдельных симбионтов в этой нише.
Мы продемонстрировали исследованиями in vitro и in vivo, что микробиота LAB в A. mellifera ингибирует один важный патоген медоносной пчелы — бактериальный расплодный патоген Paenibacillus larvae, который является причиной расплодной болезни американской плодожорки (AFB) [24]. В данном исследовании мы изучаем, является ли микробиота LAB одинаковой у всех девяти признанных видов медоносных пчел (Apini) и видов безжалостных пчел (Meliponini), филогенетически близких таксонов, которые, как и медоносные пчелы, являются эусоциальными, живут в колониях, состоящих из одной королевы и от 100 до 10 000 рабочих, хранят большое количество меда и пчелиного хлеба и используются в коммерческих целях или эксплуатируются этническими группами в тропиках.
Функциональная характеристика эндогенной микробиоты сельскохозяйственных культур имеет важное значение для понимания ее роли в здоровье и болезни пчел. Здесь мы исследуем разнообразие, поддержание и динамику LAB в медоносной культуре и ключевую роль, которую они играют в здоровье пчел, с серьезными последствиями для исследований снижения численности пчел и устойчивого управления опылителями.
Результаты
Разнообразие LAB
Все 9 видов Apis и 3 вида Meliponini обладают сходной микробиотой, включающей в себя около 50 новых видов LAB в родах Lactobacillus и Bifidobacterium (рис. 1), с использованием порога, используемого для определения вида бактерий на основе секвенирования генов рРНК — <97% сходства [25] (<98,5% часто считается, что это возможно новые виды).

Рисунок 1. Филогенетическое дерево LAB в пчеловодческих культурах.
Филогенетическое дерево, основанное на матрице расстояний позиций 56-1470 (нумерация Escherichia coli) в гене 16S рРНК бактерий Lactobacillus и Bifidobacterium spp. из Apis species (красный) и безжалостных пчел Melipona beechii (бирюзовый), Meliponula bocandeii (зеленый) и Trigona sp (синий). Ранее охарактеризованные бактериальные филотипы из Apis mellifera выделены жирным шрифтом (красный). Штаммы бактериального типа выделены жирным шрифтом (черный). Филотипы в рамке (справа) представляют собой различные кластеры, принадлежащие к охарактеризованному или, возможно, новому виду. Группа Bifidobacterium является аут-группой. Штрих: 5 изменений пар оснований. Последовательности генов 16S рРНК, депонированные в GenBank HM534742-HM534842 (в скобках).
Одна конкретная LAB была распространена и доминировала в микробиоте Apis spp: L. kunkeei (44% из 750 изолятов были L. kunkeei). Однако многие Lactobacillus и Bifidobacterium оказались общими для всех видов пчел (рис. 1), включая L. kunkeei у безжалостных пчел из Центральной Америки (M. beecheii) и Африки (M. bocandei), но не у Trigona sp. из Борнео и Таиланда, где она является симпатриком пяти местных видов Apis. Из наших предыдущих исследований [16], [19] мы знаем, что пчелы добавляют микробиоту LAB в мед и пыльцу корбикулы. В данном исследовании мы обнаружили самую высокую концентрацию жизнеспособных LAB (108 на грамм меда) в непальском меде A. laboriosa и аналогичное количество в меде A. mellifera из Африки (Таблица 1).

Онтогенез и поддержание LAB
Результаты были однозначными: при вылуплении культуры были пусты и лишены LAB, но в течение нескольких минут после вылупления микробиота постепенно формируется за счет трофаллактического обмена с птенцами (Таблица 2). L. kunkeei доминировала в микробиоте посевов во всех случаях отбора проб. В ходе исследования было обнаружено только шесть членов LAB урожая медоносных пчел. Пчелы, содержавшиеся в одиночной камере с момента вылупления (n = 10), сохранили стерильные культуры.
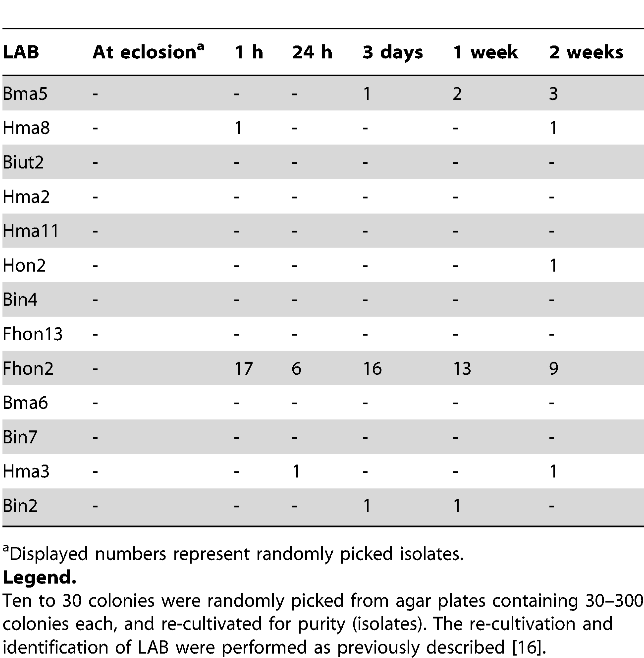
Микробиота LAB остается жизнеспособной внутри пчел и в высокой концентрации добавляется в их продукты питания (Таблица 1), когда симбионты отделяются от своей ниши — медовой культуры. Исследуя симбионты LAB с помощью SEM и флуоресцентной микроскопии in vitro и in vivo, мы обнаружили, что микробиота образует биопленки и сети (рис. 2 и рис. 3; видео S1 и видео S2), с помощью которых они прикрепляются к стенке культуры, используя структуры, напоминающие внеклеточные полимерные вещества (EPS) (рис. 2).

Визуализация лактобацилл, прикрепленных к стенке культуры медоносной пчелы, с помощью SEM. A, B и C показывают различные участки медовой культуры при аналогичном увеличении с видимыми структурами прикрепления, напоминающими внеклеточные полимерные вещества (EPS). D — большая часть культуры с прикрепленными бактериями. Фотограф Леннарт Нильссон.
Красная флуоресценция показывает живые окрашенные бактерии в биопленке LAB, прикрепленной к медовой культуре. Зеленая флуоресценция показывает ядра клеток культуры медоносной пчелы. Визуализированная ткань представляет собой проекцию 112 конфокальных z-секций (через z-глубину 37,6 мкм, охватывающих xy-область 246×246 мкм).
Функциональная характеристика
Был исследован микробный состав 15 цветков, часто посещаемых A. mellifera в Швеции (Таблица S1). Всего из цветов было выделено шестьдесят переходных микроорганизмов, которые были идентифицированы до видового уровня (Accession nr: JN167926-JN167985). Мы проверили ингибирующие свойства всех LAB медовых культур, выращенных по отдельности и вместе, против 55 штаммов бактерий и 5 штаммов дрожжей, выделенных из цветков. Наблюдалось четкое общее ингибирование всех переходных микроорганизмов цветка отдельными представителями микробиоты LAB медовой культуры (Таблица S1). L. kunkeei, наиболее распространенный вид среди всех пчел (рис. 1), был также самым мощным, ингибируя все протестированные микроорганизмы.
Микробиота LAB частично ингибировала пчелиный патоген M. plutonius in vivo (рис. 4) и полностью in vitro, L. kunkeei и тринадцать LAB вместе показали лучшие ингибирующие свойства. Общий эффект от добавления смеси LAB в корм для личинок пчел заключался в значительном снижении количества мертвых личинок (Рисунок 4, X24 = 24,27, двуххвостовой P: <0,001). Общая смертность неинфицированных контрольных групп (с добавлением или без добавления LAB) составила <7% в обоих повторах. Результаты показывают, что добавление LAB в пищу молодых личинок медоносной пчелы, подверженных воздействию M. plutonius, снижает количество личинок, погибающих от инфекции EFB.
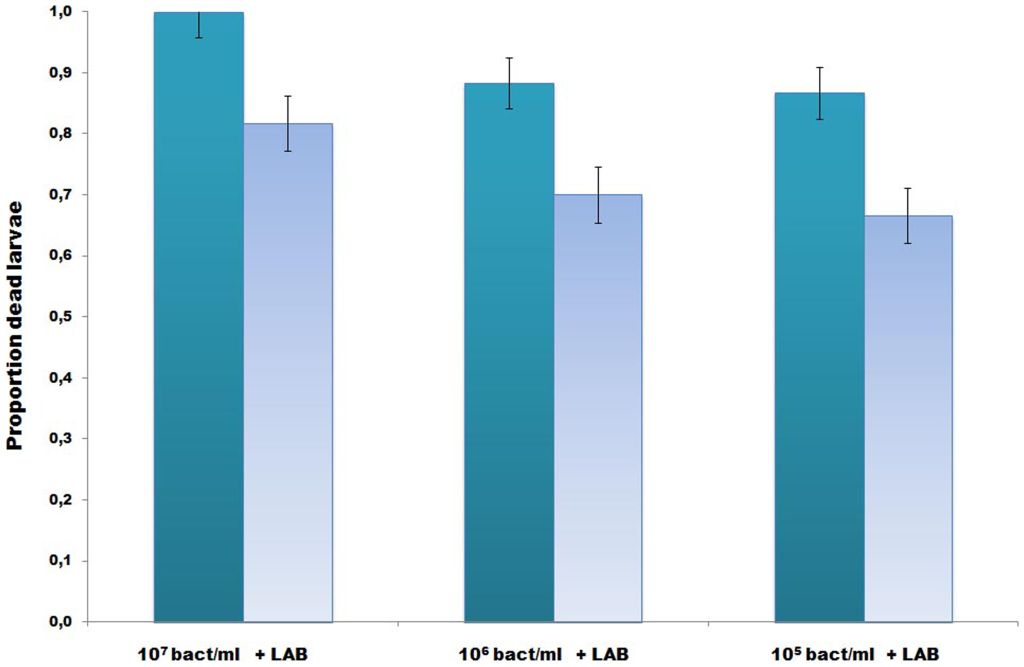
Доля погибших личинок в обеих копиях (общее число погибших через 21 день). Данные представлены как среднее значение для трех групп, которым скармливали M. plutonius (107, 106 и 105 бактерий мл-1), и трех групп, которым скармливали M. plutonius и LAB. Независимо от дозы заражения, общий эффект от добавки LAB заключался в значительном снижении смертности в обработанных группах. Смертность в неинфицированных контрольных группах составляла <7%.
LAB и антибиотики
Культивирование in vitro 13 отдельных представителей LAB с двумя антибиотиками (окситетрациклином и тилозином), используемыми в пчеловодстве для борьбы с бактериальными заболеваниями AFB и EFB, показало высокую чувствительность всех представителей LAB к тилозину, наиболее недавно применяемому антибиотику в практике пчеловодства в США [26]. Тем не менее, штаммы L. kunkeei Fhon2 и Lactobacillus Fhon13, Hma11, Hma8 и Hon2 показали устойчивость к окситетрациклину.
Номера акцессоров
Последовательности генов 16S рРНК, полученные в данном исследовании, доступны в GenBank под номерами доступа: HM534742-HM534842, JN167926-JN167985 и JN689233.
Обсуждение
Наши результаты свидетельствуют об одной из самых больших коллекций новых видов из родов Lactobacillus и Bifidobacterium, когда-либо обнаруженных в пределах одного насекомого. Обнаружение около 50 новых видов в этих бактериальных родах окажет огромное влияние на их современную таксономию. Обнаружение L. kunkeei в качестве общих симбионтов Apis и жалящих пчел подчеркивает важность этого организма. Ранее мы уже показывали постоянное присутствие и доминирование этой лактобациллы в наших исследованиях A. mellifera (25% из 158 изолятов в Швеции [16], [17], [19]; 40% из 42 изолятов в США [18]; 28% из 50 изолятов в Африке [17], а теперь во всех Apis spp. и у пчел без жала. Самый недавний общий предок медоносных и безжалостных пчел датируется >80 млн. лет назад [27], что позволяет предположить, что флора L. kunkeei-доминирующая LAB является древней ассоциацией пчел. Однако неизменность последовательностей гена 16S рРНК L. kunkeei в разных видах хозяев и географической локализации (рис. 1) предполагает возможный горизонтальный перенос членов LAB между видами хозяев. Однако на Борнео пять симпатрических видов Apis кормятся вместе с Trigona spp. на одних и тех же цветках, но L. kunkeei не был найден ни в одном из исследованных видов Trigona spp., что свидетельствует против горизонтального переноса.
Наше исследование показывает, как эта микробиота приобретается (Таблица 2) и поддерживается внутри пчел (Рисунок 2 и Рисунок 3; Видео S1 и Видео S2). Интересно, что LAB накапливается постепенно путем трофаллактического обмена с сородичами, а L. kunkeei Fhon2 доминировала в микробиоте культур во всех случаях отбора проб, что еще раз отражает ее важность (Таблица 2). Однако то, что в ходе исследования было обнаружено только шесть членов LAB урожая медоносных пчел, может отражать либо недостаток подсчета бактерий при использовании жизнеспособных количеств, которые отображают доминирующие бактерии, либо количественные различия между сезонами. Из наших предыдущих исследований мы знаем, что число членов LAB в культуре меняется по сезонам в зависимости от цветов, посещаемых пчелами, и от состояния здоровья пчел [16]. С другой стороны, мы знаем, что микробиота разных видов Apis также довольно постоянна. На первый взгляд, удивительно, как эта микробиота поддерживается в медоносной культуре при интенсивном приливе и отливе сахаров, ферментов, воды и постоянном вторжении чужеродных микробов после поглощения цветочного нектара во время кормежки. Визуализация культуры и прикрепленных LAB показывает, как эта микробиота сохраняется (Рисунок 2 и Рисунок 3; Видео S1 и Видео S2) в сетях и биопленках. Свойство образования биопленок известно у видов LAB, обитающих в кишечнике и влагалище человека [28], [29], [30]. В дополнение к хорошо описанному свойству LAB вырабатывать экзополисахариды, другие вероятные механизмы образования биопленки и адгезии включают выработку белков, углеводов, ферментов, нуклеиновых кислот, липидов или мембранно-связанных рецепторов. Экзополисахариды являются основным компонентом внеклеточных полимерных веществ (EPS) и, выделяясь в окружающую среду, обеспечивают защиту бактерий; они также участвуют в колонизации хозяина и распознавании клеток [31]. Предполагается, что экзополисахариды, производимые организмами, пригодными для употребления в пищу (GRAS), в частности LAB, могут приносить пользу здоровью человека [32], [33], [34]; то же самое может быть справедливо и для медоносных пчел. Сложность прикрепления и образования биопленки этим симбиотическим сообществом включает в себя пока неизвестные механизмы действия. К ним могут относиться свойства мембраны симбионтов избегать отторжения хозяином, а также выработка мощных антимикробных веществ.
Во время кормежки чужеродные микробы попадают в пчел и в их колонию через медоносные культуры, с собранным нектаром и через пыльцу (Таблица S1). Когда цветок распускается в первый раз, его нектар и пыльца стерильны, но со временем в них проникают микроорганизмы, находящиеся в воздухе, и микробы от насекомых. Состав и численность этой переходной микробиоты могут меняться со временем, а также в зависимости от типа цветка, посещающих его насекомых, температуры и питательного состава пыльцы и нектара. Члены LAB в культуре различаются численно [16], но постоянны в пределах одного вида Apis [17]. Разнообразие LAB может быть объяснено различиями в содержании питательных веществ в различных нектарах и пыльце, а также различиями в микробах, которым подвергаются цветы. Переходные цветочные микробы могут вызвать рост резидентной микробиоты LAB у пчел и выработку ими антимикробных веществ, механизм, известный для штаммов LAB в других нишах (например, Lactobacillus reuteri при выработке реутерина [35], [36], [37].
Мы выдвинули гипотезу, что ЛАБ медоносной пчелы обладает антимикробными свойствами против микроорганизмов, присутствующих в нектаре и на пыльце, чтобы защитить свою нишу (медоносная культура) и предотвратить порчу меда и пчелиного хлеба во время их производства, которое может занимать от нескольких дней до нескольких недель. Наши результаты показывают предварительное общее ингибирование переходных экологических микробов, обнаруженных в цветках (Таблица S1). И снова L. kunkeei, наиболее распространенный вид у всех пчел Apis (рис. 1), был выделен как самый мощный, ингибирующий все протестированные микроорганизмы. Эта бактерия была первоначально описана как организм, портящий вино, поскольку она ингибирует дрожжи при производстве вина [38], [39]. Интересно, что степень ингибирования отдельными членами LAB значительно варьировалась в зависимости от тестируемых микробов. Однако микробиота LAB, по-видимому, действует синергично [24] (Таблица S1); они производят антимикробные агенты, включая обычные органические кислоты, белки, пептиды, ферменты и бактериоцины, которые мы сейчас изучаем.
Микробиота LAB медоносной культуры A. mellifera добавляется пчелами в корм для расплода и пыльцу корбикулы и играет важную роль в производстве меда и пчелиного хлеба [16], [19]. Хорошо известно, что виды Lactobacillus и Bifidobacterium подавляют патогены; они веками использовались в консервировании продуктов питания для предотвращения микробной порчи [40]. Коммерческие пробиотические продукты для потребления человеком с жизнеспособными LAB содержат примерно одинаковое количество (108) в основном одной единственной LAB в г-1 продукта [41], [42]. Мы предположили, что штаммы Lactobacillus и Bifidobacterium, обитающие в меде, могут функционировать подобно LAB для сохранения продуктов питания или защиты от микроорганизмов, вторгающихся в организм человека.
Мед, собранный из управляемых или диких колоний Apis spp. или безжалостных пчел, независимо рассматривался как терапевтическое средство многими культурами на протяжении всей истории, от майя в Мексике до фараонов в Египте [43], возможно, отражая благотворное влияние жизнеспособной микробиоты медоносной пчелы при употреблении или нанесении на раны. Можно считать, что свежий мед представляет собой пробиотический продукт естественного происхождения, с большим разнообразием и концентрацией видов LAB (Таблица 1), что может отражать огромное количество полезных свойств каждого конкретного представителя LAB в медовой культуре.
Мы считаем, что антимикробные механизмы LAB развивались в синергии с пчелами для защиты себя и своих хозяев от угроз окружающей среды, таких как микробы, содержащиеся в нектаре и пыльце, и, возможно, для защиты от специфических патогенов медоносных пчел. Эти древние симбиотические отношения между LAB и пчелами, по-видимому, приносят большую пользу пчелам и могут быть названы колонизационной устойчивостью. Такое же явление описано для нормальной флоры в кишечнике плодовой мухи [6]. Расплод медоносных пчел кормят пчелиным хлебом, содержащим жизнеспособные LAB и их антимикробные вещества. Таким образом, наши результаты убедительно свидетельствуют о том, что LAB, связанные с культурой медоносной пчелы, имеют важное значение для патологии медоносной пчелы, особенно для бактериальных заболеваний расплода, таких как AFB и EFB. Считается, что у медоносных пчел имеется лишь около трети генов врожденного иммунитета по сравнению с другими насекомыми [44], [45]. В дополнение к социальным защитным мерам, присущим социальным насекомым [46], отдельные медоносные пчелы могут также получать преимущества от своих LAB-симбионтов, которые, вероятно, имеют большое значение в защите от патогенов, что, возможно, еще больше снижает зависимость от врожденной иммунной системы.
Для обеспечения опыления пчелами A. mellifera пчеловоды заменяют собранный мед на сахарные растворы, иногда смешанные с антибиотиками для профилактического контроля специфических для медоносных пчел бактериальных заболеваний расплода, таких как АФБ и микроспоридии [47]. Известно, что восприимчивость LAB к антибиотикам варьирует [48], [49]. Культивирование in vitro 13 отдельных представителей LAB Apis с двумя антибиотиками, используемыми в пчеловодстве (окситетрациклин и тилозин), показало высокую чувствительность всех штаммов к тилозину, наиболее часто используемому антибиотику в пчеловодческой практике в США [26]. Тем не менее, штаммы L. kunkeei Fhon2 и Lactobacillus Fhon13, Hma11, Hma8 и Hon2 показали устойчивость к окситетрациклину, что может отражать длительное использование этого антибиотика в пчеловодстве или их длительное воздействие микробов из окружающей среды, вырабатывающих аналогичные вещества. Негативные последствия для здоровья медоносных пчел, вызванные повреждением микробиоты медоносных культур в результате использования этих антибиотиков, требуют дальнейшего изучения.
Перспективы
Экономическая ценность коммерческого опыления медоносными пчелами оценивается более чем в 14 миллиардов долларов США только в США и более 220 миллиардов долларов США во всем мире [50]. Однако продолжающаяся гибель колоний в США и Европе не поддается причинному объяснению, несмотря на интенсивные исследования [51], [52] и выявление новых и экзотических патогенов [20]. Обнаруженная нами разнообразная и новая микробиота LAB медовых культур, общая для всех признанных видов медоносных пчел и 3 видов безжалостных пчел, может быть недостающим звеном в этой всемирной проблеме. Поскольку родственные микробиоты встречаются у всех видов пчел, это свидетельствует о тесной эволюционной связи между бактериями и хозяевами, а также подчеркивает важность симбионтов LAB для пчел. Симбионты LAB не только участвуют в производстве и сохранении пищи медоносной пчелы, но и играют важную роль в защите хозяина от патогенов и переходных микробов, перехваченных во время кормежки. Важность этой микробиоты культур для медоносных пчел дополнительно усиливается тем фактом, что она немедленно переносится в стерильную культуру только что появившихся пчел путем трофаллактического обмена с сородичами.
Любой полезный эффект от этой микробиоты может быть сведен на нет, если практикуется профилактическое использование антибиотиков (например, в США) или если их естественные корма, мед и пыльца, дополняются пчеловодом синтетическими сахарами и заменителями пыльцы, в которых отсутствуют LAB или их полезные вещества. Отсутствие LAB особенно проблематично, когда пчелы пытаются производить и сохранять пищу для себя и расплода, когда кормят расплод пыльцой, не содержащей LAB или антимикробных веществ, полученных из LAB, когда сородичи создают LAB-микробиоту в каллусах путем трофаллактического обмена, или когда патогены вторгаются в улей. В настоящее время особое внимание необходимо уделить выяснению механизмов действия LAB против патогенов и микробов, портящих продукты питания, и тому, как их можно использовать для решения проблемы текущих потерь колоний медоносных пчел, в которых LAB может быть важным недостающим звеном. Необходимы изменения в практике пчеловодства, способствующие развитию LAB, или прямые манипуляции путем дополнительного кормления отдельных или составных членов LAB и их продуктов могут помочь облегчить ПЗС. Дальнейший функциональный анализ LAB у пчел, безусловно, обогатит наше понимание симбиозов насекомых с микробами и их эволюционной динамики в сложных эусоциальных сообществах насекомых.
Материалы и методы
Этика
Для проведения описанных полевых исследований не требовалось никаких специальных разрешений. Местные коллеги (их имена указаны в примечаниях) собирали образцы там, где разрешение не требовалось, т.е. не в заповедниках и не в местах, находящихся в частной собственности. В полевых исследованиях не участвовали виды, находящиеся под угрозой исчезновения или охраняемые.
Разнообразие LAB в пчелах
Мы отобрали образцы микробиоты LAB медовых культур всех 9 хорошо известных видов медоносных пчел (Apini) и 3 видов безжалостных пчел (Meliponini). Apis andreniformis (n = 3 колонии), Apis cerana (n = 2 колонии), Apis koschevnikovi (n = 3 колонии), Apis nuluensis (n = 1 колония) и Apis dorsata (n = 1 колония) были собраны с Борнео (Малайзия), Apis laboriosa (n = 2 колонии) из Непала, Apis florea (n = 1 колония) из Таиланда, Apis nigrocincta (n = 1 колония) из Индонезии, и A. mellifera (n = 25 колоний) из Швеции и Кении. Образцы пчел рода Trigona были собраны из Таиланда (n = 1 колония) и Борнео (n = 1 колония) (Малайзия), Meliponula bocandeei (n = 2 колонии) из Кении и Melipona beecheii (n = 2 колонии) из Мексики. Для каждого вида пчел было проанализировано содержание LAB в медовых культурах 10-20 пчел. Для A. nuluensis и A. dorsata мы проанализировали только содержимое медовых культур и пыльцу коробочек пчел, собранных в полевых условиях, поскольку мы не смогли отобрать колонии этих свободно живущих пчел. Изоляция LAB из медовых культур, свежего меда, пыльцы коробочек и пчелиного хлеба проводилась, как описано ранее [16], [19]. ПЦР-амплификацию изолятов для секвенирования гена 16S рРНК, идентификацию и филогенетический анализ проводили согласно Олофссону и Васкесу [16]. Кроме того, последовательности генов 16S рРНК проверяли по программному обеспечению RDP (Ribosomal Database Project II), доступному на домашней странице (http://rdp.cme.msu.edu/). Всего в данном исследовании было получено 750 изолятов молочнокислых бактерий.
Онтогенез LAB
Чтобы определить, как приобретается микробиота культур, мы пометили западных медоносных пчел (A. mellifera) при выходе из ячеек воскового расплода (n = 30), вернули их в улей, собрали их в разном возрасте, культивировали содержимое их культур и идентифицировали LAB (культивирование и идентификация описаны ранее [16]).
Поддержание микробиоты медовых культур
Мы провели in vitro и in vivo исследования симбионтов с помощью SEM и флуоресцентной микроскопии. Образцы для СЭМ были подготовлены методом сублимационной сушки [53], а снимки сделаны фотографом Леннартом Нильссоном (Швеция).
Подготовка и конфокальная флуоресцентная микроскопия бактерий в медовой культуре осуществлялась следующим образом. Медоносных пчел кормили смесью меда и воды, содержащей (Sytox®, зеленый краситель и BacLight™, красный бактериальный краситель, Molecular Probes), чтобы отличить клетки пчелы от живых бактерий. После инкубации в течение примерно 15 минут медовую культуру вскрывали при комнатной температуре. Урожай вскрывали одним продольным разрезом. Чтобы предотвратить сокращение мышц стенки культуры, культуру промывали в фосфатно-буферном солевом растворе (PBS), дополненном 1 мМ ЭДТА, и монтировали на предметное стекло. Слайды исследовали с помощью лазерного конфокального микроскопа TCS SP5, оснащенного белым лазером непрерывного спектра (Leica, Мангейм, Германия). Изображения получали с помощью 63× объектива с масляной иммерсией (NA 1,4 HCX PL APO CS) с фильтром, настроенным на двухцветную подсветку FITC и Texas Red. Необработанные изображения были обработаны в программе ImageJ (NIH, Бетесда, США) с использованием медианной фильтрации. Z-стеки визуализировали с помощью плагина ImageJ 3D-viewer. 3D-фильмы (Видео S1 и Видео S2) показывают проекцию 90 конфокальных z-срезов через z-глубину 45,3 мкм, охватывающих область 246×246 мкм в xy-направлении.
Биопроба на Melissococcus plutonius
Мы исследовали возможное ингибирующее воздействие микробиоты LAB на европейскую плодожорку (EFB), основного бактериального патогена личиночных медоносных пчел, используя тесты in vitro и in vivo, как описано ранее [24]. Поскольку взрослые медоносные пчелы кормят личинок содержимым зерновых культур, это представляет собой типичный способ, с помощью которого личиночный корм приобретает LAB. Бактериальные суспензии Melissococcus plutonius (предоставленные доктором Жан-Даниэлем Шаррьером, Agaroscope, Швейцария, Accession nr: JN689233) готовились свежими для каждого эксперимента и разводились в личиночном корме до конечных концентраций 107, 106 и 105 бактерий на мл. Смесь из тринадцати ранее описанных LAB медоносной пчелы [16], [17], [18] в приблизительно равных пропорциях разводили в корме для личинок для конечной общей концентрации 107 LAB на мл. Рабочие личинки A. mellifera были привиты и выращены in vitro [24]. Вкратце, рабочие личинки первого возраста были перенесены на поверхность личиночного рациона с различными видами обработки. i) контрольная группа получала незараженный рацион, ii) контрольную группу сначала кормили незараженным рационом, но через 48 часов добавили LAB, и iii) экспериментальные группы получали личиночный рацион с определенным количеством M. plutonius (107, 106 и 105 бактерий мл-1). Через 24 часа после заражения личинки были перенесены в лунки, содержащие незараженный рацион и корм с добавлением LAB через 48 часов после заражения. Эксперимент был закончен через 21 день после заражения, и смертность личинок отслеживалась ежедневно. Всего в двух повторных экспериментах было использовано 420 личинок. Программа PoloPlus Probit и Logit Analysis (версия 2.0, программное обеспечение LeOra) использовалась для сравнения показателей смертности между экспериментальными группами в биопробе с экспозицией.
Цветы, нектар, пыльца и микроорганизмы
Мы проанализировали микробный состав 15 цветков, часто посещаемых A. mellifera в Швеции (Таблица S1). Цветы были собраны асептическим способом в Куллаберге, Швеция. Затем цветы встряхивали в стерильном буфере (PBS) и немедленно доставляли в лабораторию Лундского университета. Разведения делали со стерильной пептонной водой (0,2% w/v), наносили на агаровые пластины MRS (Oxoid), APT (Oxoid) и TSB (Oxoid) и инкубировали анаэробно при 35°C (агаровые пластины MRS и APT) и аэробно при 22°C (агаровые пластины TSB) в течение 5 дней. Идентификация микробных изолятов проводилась путем секвенирования генов 16S рРНК (для бактерий) [16] и областей D1-D2 генов LSU 26S рРНК (для дрожжей) [54].
Анализ наложения двух культур
Мы проанализировали ингибирующие свойства всех LAB медовых культур, выращенных по отдельности и вместе, против патогена M. plutonius, а также против 55 штаммов бактерий и 5 штаммов дрожжей, выделенных из цветов. Анализы проводили, как описано ранее [55], со следующими изменениями. LAB инокулировали на агаровые пластины MRS (Oxoid, дополненные 0,1% L-цистеина и 2,0% фруктозы) в течение 12 часов. Мы использовали среду, ранее описанную для культивирования M. plutonius [56], [57], и ту же среду, что и для выделения микробов из цветов, для верхнего слоя мягкого агара. После инкубации в течение 2-4 дней в зависимости от скорости роста измеряли зону ингибирования.
LAB и антибиотики
LAB медовых культур тестировали на чувствительность к окситетрациклину и тилозину методом дисковой диффузии на MRS-агаре (Oxoid, с добавлением 0,1% L-цистеина и 2,0% фруктозы).
Вспомогательная информация
Симбионты как основные модуляторы здоровья насекомых: Молочнокислые бактерии и медоносные пчелы
Скачать здесь таблицу S1
Микробный состав цветков 15 видов Angiosperma (левая колонка), часто посещаемых пчелами Apis mellifera в Швеции. Пятьдесят пять различных видов бактерий и 5 видов дрожжей из цветков были проанализированы in vitro против всех 13 LAB медоносной культуры A. mellifera, выращенных по отдельности и вместе (правая колонка). Зоны ингибирования представлены в виде диаметра в миллиметрах. Ноль означает отсутствие ингибирования, а (-) — отсутствие результата.
Таблица S1.
Микробный состав цветков 15 видов Angiosperma (левая колонка), часто посещаемых пчелами Apis mellifera в Швеции. Пятьдесят пять различных видов бактерий и 5 видов дрожжей из цветков были проанализированы in vitro против всех 13 LAB медоносной культуры A. mellifera, выращенных по отдельности и вместе (правая колонка). Зоны ингибирования представлены в виде диаметра в миллиметрах. Ноль означает отсутствие ингибирования, а (-) — отсутствие результата.
Ссылки
1.Rajilic-Stojanovic M, Smidt H, de Vos WM (2007) Diversity of the human gastrointestinal tract microbiota revisited. Environ Microbiol 9: 2125–2136.
2.Eckburg PB, Bik EM, Bernstein CN, Purdom E, Dethlefsen L, et al. (2005) Diversity of the human intestinal microbial flora. Science 308: 1635–1638.
3.Backhed F, Ley RE, Sonnenburg JL, Peterson DA, Gordon JI (2005) Host-bacterial mutualism in the human intestine. Science 307: 1915–1920.
4.Dillon RJ, Dillon VM (2004) THE GUT BACTERIA OF INSECTS: Nonpathogenic Interactions. Annual review of entomology 49: 71–92.
5.Ryu J-H, Kim S-H, Lee H-Y, Bai JY, Nam Y-D, et al. (2008) Innate Immune Homeostasis by the Homeobox Gene Caudal and Commensal-Gut Mutualism in Drosophila. Science 319: 777–782.
6.Silverman N, Paquette N (2008) Immunology. The right resident bugs. Science 319: 734–735.
7.Evans J, Armstrong T-N (2006) Antagonistic interactions between honey bee bacterial symbionts and implications for disease. BMC Ecology 6: 4.
8.Hughes DP, Pierce NE, Boomsma JJ (2008) Social insect symbionts: evolution in homeostatic fortresses. Trends Ecol Evol 23: 672–677.
9.Hammes W, Hertel C (2006) The Genera Lactobacillus and Carnobacterium: The Prokaryotes. In: Dworkin M, Falkow S, Rosenberg E, Schleifer K-H, Stackebrandt E, editors. Springer New York. pp. 320–403.
10.FAO/WHO (2001) Health and nutritional properties of probiotics in food including powder milk with live lactic acid bacteria, a joint FAO/WHO expert consultation Cordoba, Argentina. Available: http://www.who.int/foodsafety/publications/fs_management/probiotics/en/index.html#.TmTPiQL25zM.email. Accessed 2012 Jan 5.
11.FAO/WHO (2002) Guidelines for the Evaluation of Probiotics in Food:Joint FAO/WHO Working Group meeting. London Ontario, Canada. Available: http://www.who.int/foodsafety/publications/fs_management/probiotics2/en/index.html. Accessed 2012 Jan 5.
12.Klaenhammer T, Altermann E, Arigoni F, Bolotin A, Breidt F, et al. (2002) Discovering lactic acid bacteria by genomics. Antonie van Leeuwenhoek 82: 29–58.
13.Servin AL (2004) Antagonistic activities of lactobacilli and bifidobacteria against microbial pathogens. FEMS Microbiology Reviews 28: 405–440.
14.Ventura M, O’Flaherty S, Claesson MJ, Turroni F, Klaenhammer TR, et al. (2009) Genome-scale analyses of health-promoting bacteria: probiogenomics. Nat Rev Micro 7: 61–71.
15.Euzéby JP List of Prokaryotic names with Standing in Nomenclature — Genus Lactobacillus. Available: http://www.bacterio.cict.fr/l/lactobacillus.html. Accessed 2012 Jan 5.
16.Olofsson TC, Vásquez A (2008) Detection and Identification of a Novel Lactic Acid Bacterial Flora Within the Honey Stomach of the Honeybee Apis mellifera. Current microbiology 57: 356–363.
17.Olofsson TC, Vásquez A, Sammataro D, Macharia J (2011) A scientific note on the lactic acid bacterial flora within the honeybee subspecies; Apis mellifera (Buckfast), A. m. scutellata, A. m. mellifera, and A. m. monticola. Apidologie 1–4.
18.Vásquez A, Olofsson TC, Sammataro D (2009) A scientific note on the lactic acid bacterial flora in honeybees in the USA – A comparison with bees from Sweden. Apidologie 40: 26–28.
19.Vásquez A, Olofsson TC (2009) The lactic acid bacteria involved in the production of bee pollen and bee bread. Journal of Apicultural Research 48: 189–195.
20.Cox-Foster D, Sean C, Edward CH, Gustavo P, Jay DE, et al. (2007) A Metagenomic Survey of Microbes in Honey Bee Colony Collapse Disorder. Science 318: 283–287.
21.van Engelsdorp D, Evans JD, Saegerman C, Mullin C, Haubruge E, et al. (2009) Colony Collapse Disorder: A Descriptive Study. PLoS ONE 4: 1–17.
22.Martinson Vincent G, Danforth Bryan N, Minckley Robert L, Rueppell O, Tingek S, et al. (2011) A simple and distinctive microbiota associated with honey bees and bumble bees. Molecular Ecology 20:
23.Mohr Kathrin I, Tebbe Christoph C (2006) Diversity and phylotype consistency of bacteria in the guts of three bee species Apoidea at an oilseed rape field. Environmental Microbiology 8: 258–272.
24.Forsgren E, Olofsson TC, Vásquez A, Fries I (2010) Novel lactic acid bacteria inhibiting Paenibacillus larvae in honey bee larvae. Apidologie 41: 99–108.
25.Ludwig W, Strunk O, Klugbauer S, Klugbauer N, Weizenegger M, et al. (1998) Bacterial phylogeny based on comparative sequence analysis. Electrophoresis 19: 554–568.
26.FDA (2005) FDA Approves TYLAN Soluble for the Control of American Foulbrood in Honey Bees. Available: http://www.fda.gov/AnimalVeterinary/NewsEvents/CVMUpdates/ucm048398.htm. Accessed 2012 Jan 5.
27.Cardinal S, Straka J, Danforth BN (2010) Comprehensive phylogeny of apid bees reveals the evolutionary origins and antiquity of cleptoparasitism. Proceedings of the National Academy of Sciences 107: 16207–16211.
28.Domingue PA, Sadhu K, Costerton JW, Bartlett K, Chow AW (1991) The human vagina: normal flora considered as an in situ tissue-associated, adherent biofilm. Genitourinary Medicine 67: 226–231.
29.Lebeer S, Verhoeven TLA, Vélez MP, Vanderleyden J, De Keersmaecker SCJ (2007) Impact of Environmental and Genetic Factors on Biofilm Formation by the Probiotic Strain Lactobacillus rhamnosus GG. Applied & Environmental Microbiology 73: 6768–6775.
30.Macfarlane S, Dillon JF (2007) Microbial biofilms in the human gastrointestinal tract. Journal of Applied Microbiology 102: 1187–1196.
31.Flemming H-C, Wingender J (2010) The biofilm matrix. Nat Rev Micro 8: 623–633.
32.De Vuyst L, De Vin F, Vaningelgem F, Degeest B (2001) Recent developments in the biosynthesis and applications of heteropolysaccharides from lactic acid bacteria. International Dairy Journal 11: 687–707.
33.Jolly L, Vincent SJF, Duboc P, Neeser J-R (2002) Exploiting exopolysaccharides from lactic acid bacteria. Antonie van Leeuwenhoek 82: 367–374.
34.Jones S, Versalovic J (2009) Probiotic Lactobacillus reuteri biofilms produce antimicrobial and anti-inflammatory factors. BMC Microbiology 9: 35.
35.Axelsson LT, Chung TC, Dobrogosz WJ, Lindgren SE (1989) Production of a Broad Spectrum Antimicrobial Substance by Lactobacillus reuteri. Microbial Ecology in Health and Disease 2: 131–136.
36.Chung TC, Axelsson L, Lindgren SE, Dobrogosz WJ (1989) In Vitro Studies on Reuterin Synthesis by Lactobacillus reuteri. Microbial Ecology in Health and Disease 2: 137–144.
37.Talarico TL, Dobrogosz WJ (1989) Chemical characterization of an antimicrobial substance produced by Lactobacillus reuteri. Antimicrob Agents Chemother 33: 674–679.
38.Edwards CG, Haag KM, Collins MD, Hutson RA, Huang YC (1998) Lactobacillus kunkeei sp. nov.: a spoilage organism associated with grape juice fermentations. Journal of Applied Microbiology 84: 698–702.
39.Huang Y-C, Edwards CG, Peterson JC, Haag KM (1996) Relationship Between Sluggish Fermentations and the Antagonism of Yeast by Lactic Acid Bacteria. Am J Enol Vitic 47: 1–10.
40.Maarit M (2004) Lactic Acid Bacteria in Vegetable Fermentations. Lactic Acid Bacteria: CRC Press.
41.Champagne CP, Ross RP, Saarela M, Hansen KF, Charalampopoulos D (2011) Recommendations for the viability assessment of probiotics as concentrated cultures and in food matrices. International Journal of Food Microbiology 149: 185–193.
42.Gorbach S, Seppo S, Yuan-Kun L, Benno Y (2004) Human Studies on Probiotics. Lactic Acid Bacteria: CRC Press.
43.Crane E (1999) The world history of beekeeping and honey hunting: Routledge.
44.Consortium THGS (2006) Insights into social insects from the genome of the honeybee Apis mellifera. Nature (London) 443: 931–949.
45.Evans JD, Lopez DL (2004) Bacterial Probiotics Induce an Immune Response in the Honey Bee (Hymenoptera: Apidae). Journal of Economic Entomology 97: 752–756.
46.Wilson-Rich N, Spivak M, Fefferman NH, Starks PT (2009) Genetic, Individual, and Group Facilitation of Disease Resistance in Insect Societies. Annual review of entomology 54: 405–423.
47.Morse RA, Hooper T (1985) The Illustrated encyclopedia of beekeeping: E.P. Dutton.
48.Ammor MS, Belen Florez A, Mayo B (2007) Antibiotic resistance in non-enterococcal lactic acid bacteria and bifidobacteria. Food Microbiology 24: 559–570.
49.Moubareck C, Gavini F, Vaugien L, Butel MJ, Doucet-Populaire F (2005) Antimicrobial susceptibility of bifidobacteria. Journal of Antimicrobial Chemotherapy 55: 38–44.
50.Gallai N, Salles J-M, Settele J, Vaissière BE (2009) Economic valuation of the vulnerability of world agriculture confronted with pollinator decline. Ecological Economics 68: 810–821.
51.Moritz RFA, de Miranda J, Fries I, Le Conte Y, Neumann P, et al. (2010) Research strategies to improve honeybee health in Europe*. Apidologie 41: 227–242.
52.Pettis JS, Delaplane KS (2010) Coordinated responses to honey bee decline in the USA*. Apidologie 41: 256–263.
53.Bell PB Jr, Lindroth M, Fredriksson BA (1988) Preparation of cytoskeletons of cells in culture for high resolution scanning and scanning transmission electron microscopy. Scanning Microscopy 2: 1647–1661.
54.Cano J, Guarro J, Gené J (2004) Molecular and Morphological Identification of Colletotrichum Species of Clinical Interest. Journal of clinical microbiology 42: 2450–2454.
55.Magnusson J, Ström K, Roos S, Sjögren J, Schnürer J (2003) Broad and complex antifungal activity among environmental isolates of lactic acid bacteria. FEMS Microbiology Letters 219: 129–135.
56.Bailey L, Collins MD (1982) Reclassification of ‘Streptococcus pluton’ (White) in a new genus Melissococcus, as Melissococcus pluton nom. rev.; comb. nov. Journal of Applied Microbiology 53: 215–217.
57.Hornitzky MAZ, Smith L (1998) Procedures for the culture of Melissococcus pluton from diseased brood and bulk honey samples. Journal of Apicultural Research 37: 293–294.

Добавить комментарий